Ⅰ. 서 론
장내미생물(Gut microbiota)은 위장관 내 분포하는 세균, 바이러스, 진핵생물을 포함하는 미생물 군집을 말한다1). 인간의 몸에는 약 40조의 미생물이 분포하고 있으며, 특히 장내에는 가장 다양한 미생물이 서식하며 단순히 소화작용을 도울 뿐 아니라 병원균 침입을 방어하고 우리 몸의 면역과 대사 조절에 관여하는 등 인체와의 상호작용을 통해 인간의 건강과 질병에 큰 영향을 미치고 있다2). 인체 미생물에 대한 연구는 2000년대 후반부터 장내미생물에 대한 연구로 본격적으로 시작되어 현재는 호흡기, 피부 등에 서식하는 미생물로 대상이 확장되었다. 기존의 미국이나 유럽연합 중심으로 이루어지던 연구가 한국, 일본 등 개별 국가에서도 진행되고 있는 것은 장내미생물과 여러 질환의 관련성에 대한 관심이 증가하고 있음을 보여준다3).
장내미생물은 위장관질환은 물론 대사질환, 자가면역질환, 신경계 질환 등과도 관련 있는 것으로 밝혀져 있으며 알레르기 질환 발병에도 관여하는 것으로 알려져 있다. Storrø의 연구에서는 특히 영유아기에 장내미생물 다양성이 부족하면 알레르기 질환 위험성이 증가한다는 사실이 밝혀졌다4). 또, Abrahamsson 등은 아토피피부염과 알레르기 천식을 가지고 있는 영유아는 건강한 영유아보다 장내미생물 다양성이 상대적으로 부족하다고 밝혔다5,6). 또 장내미생물이 피부 혹은 폐에 영향을 미칠 수 있다는 이론인 장-폐축(gut-lung axis), 장-피부축(gut-skin axis) 이론도 체계적으로 정리되어지고 있다. 예를 들어, 장내미생물의 불균형이 발생하면 T세포 활성화로 이어지고 동시에 면역억제성 사이토카인과 Treg cell을 방해하게 된다. 결국 장과 피부엔 만성 염증이 발생하고 정상적인 면역 반응으로는 염증을 스스로 조절할 수 없는 상태가 된다7).
선진국의 알레르기 질환 유병률은 지속적으로 증가하여, 특히 아토피피부염, 알레르기 비염, 천식, 음식 알레르기를 진단받는 아이들이 늘어나고 있다8). 알레르기 질환의 치료에는 항히스타민제, 스테로이드 요법이 1차적으로 많이 사용되고 있지만 대증치료라는 한계점이 있다. 최근에는 양방의학에서도 같은 질환에 같은 치료를 제공하는 가이드라인을 기초로 한 치료를 벗어나 개인의 다양성을 고려하여 질병의 진단과 관리에서 개인화된 방법을 적용하는 시도를 하고 있다. 이는 환자마다 다른 유전적, 환경적 요인을 고려하여 개개인의 정확한 치료 타겟을 설정하여 치료를 행하는 정밀의료(precision medicine)로, 유전체정보와 더불어 장내미생물이 중요인자이다9). 여기에 장내미생물과 알레르기와의 연관성이 밝혀지며 개개인마다 다른 장내미생물의 조절이 알레르기 질환의 근본적인 해결책으로 대두되고 있다.
한편, 최근 여러 연구를 통하여 한약이 프리바이오틱스 역할을 한다는 것이 밝혀지고 있다10,11). 한약의 여러 성분이 경구 투여 후 대장에서 장내미생물의 조성과 대사를 조절하고, 반대로 장내미생물이 한약의 성분을 변화시키는 등의 상호작용을 일으킨다는 것이다12). 이러한 상호작용을 통해 여러 대사산물이 생겨나고, 그 결과 장내미생물의 유해균 증식을 억제하여 장점막 염증을 방어하는 효과를 가지게 된다13). 이에 따라 비만, 당뇨, 대사증후군 등의 질환에서 장내미생물과 한약의 상호작용을 알아본 연구가 많이 이루어졌고14), 이후 알레르기 질환에 적용한 연구도 지속적으로 이루어지고 있다. 이에 본 연구에서는 알레르기 질환에서 장내미생물 조절에 따른 한약 치료의 효과를 연구한 논문을 분석하여 연구 동향을 살펴보고, 향후 장내미생물에 대한 한약 치료 임상 연구의 기초 자료로 사용하고자 한다.
Ⅱ. 연구대상 및 방법
본 연구는 2023년 12월 13일 기준으로 Pubmed를 이용하여 “Allergic disease”, “Atopic dermatitis”, “Allergic rhinitis”, “Asthma”, “Gut Microbiome”, “Medicine, Herbal” 등을 키워드로 검색하였고, Riss, Kiss, OASIS 총 3가지 국내 검색 엔진을 이용하여 “알레르기”, “아토피”, “비염”, “천식”, “장내미생물”을 조합하여 검색하였다.
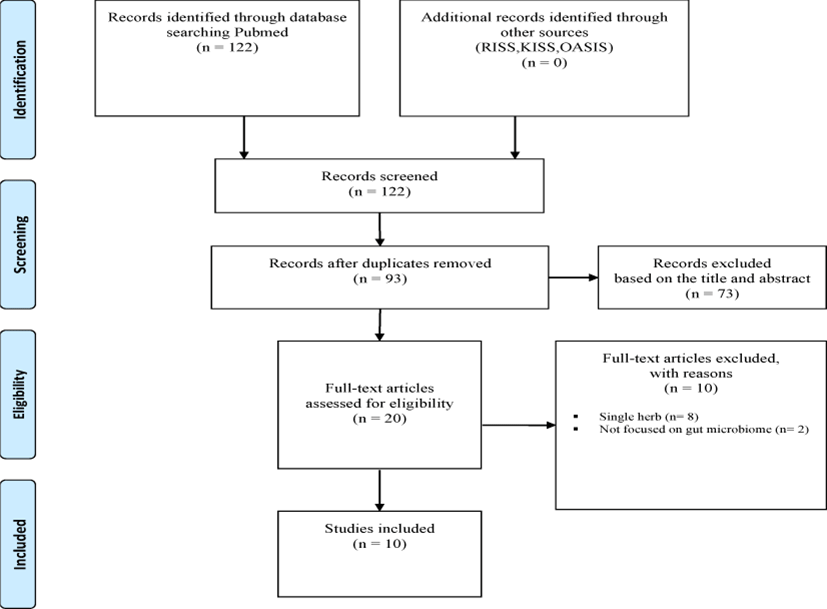
논문 선정 기준은 2000년 1월 1일부터 2023년 12월 13일까지 발표된 논문을 대상으로 하였고, 모든 형태의 논문을 포함하였고 학위 논문은 배제하였다. 상기의 방법으로 검색된 총 122개의 논문 중 중복된 논문을 제거하고, 제목과 초록을 확인하여 주제와 관련 없는 논문을 배제하였다. 처방이 아닌 단일 한약재를 대상으로 한 논문도 배제하였다. 이후 본문의 내용을 확인하여 장내미생물이 주요 평가 결과로 활용되지 않은 논문을 배제하여 총 10편의 논문이 선정되었다(Fig. 1).
Ⅲ. 결 과
각 연구의 평가지표와 결과에 대한 분석은 Table 1에 정리되어 있다.
| Disease | Herbal Medicine | Experimental Subjects | Groups | Usage and Dosage | Microbiota Modulation | Results | Ref. |
|---|---|---|---|---|---|---|---|
| Atopic Dermatitis (AD) | Gwakhyangjeonggisan (GJS) | 52 aged 19–60 years with AD | -GJS treatment group(n=27)-Placebo treatment group(n=25) | thrice daily, 8 weeks | slightly increased gut microbiome diversity. no significant difference in gut microbiota at the phylum level |
1. SCORAD, EASI, DLQI ↓ (but no significant difference between GJS and placebo group) 2. IgE↑ 3. EQ-5D-5L↑NDI-K scores↓ 4. no significant change in indoxyl sulfate , pheylacetylglutamine compared to placebo group |
Mi Mi Ko15) (2024) |
| HuangLianJieDu Decoction, replaced GF(Gardenia Fructus) with DC(Dictamni Cortex) . (MHLJDD) | DNCB or MC903 -induced mice | -Normal group -AD model group -Dexamethasone group -MHLJDD group -Three MHLJDD-F groups |
MHLJDD 1.48 g/㎏ MHLJDD-F-L (0.26 g/㎏) MHLJDD-F-M (0.52 g/㎏) MHLJDD-F-H (1.04 g/㎏) Once daily, 2 weeks |
Alistipes, Ruminococcaceae UCG-014, Lachnospiraceae NK4A136↓ Bacteroides, Akkermansia, Parabacteroides, Enterococcus↑ |
<ear> 1. ear dermatitis score↓ (MHLJDD-F-M**,H**) scratching behaviors↓(MHLJDD* , MHLJDD-F-M*) 2. epidermal thickness, mast cells↓(MHLJDD**, MHLJDD-F-M,H**) 3. IgE, TNF-α ↓(MHLJDD-F-M,H**) 4. FLG, LOR ↑(MHLJDD-F*) <dorsal skin> 1. EASI↓(MHLJDD*,MHLJDD-F-M*,H**) scratching behaviors↓ (MHLJDD-F-L,*M**,H**) 2. IgE, TNF-α ↓ (MHLJDD**, MHLJDD-F-L,*M**,H**), histamine↓(All**) 3. epidermal thickness, mast cells↓(All**) 4. FLG, LOR ↑(All**) |
Lan Wang17) (2022) | |
| Sihocheonggan-Tang (SHCGT) | DNCB-induced mice | -Sham group -AD group -SHCGT group |
SHCGT 625 ㎎/㎏, Intragastric administration, Once daily, 2 weeks |
17 species showed significant recovery in SHCGT group. (M. schaedleri*, AB606259**↓) |
1. ADI↓***, skin thickness↓*, WBC↓*, neutrophil↓* 2. IL-4↓*, IL-10↓**, IFN-γ↓* TNF-α↓Treg cell↑ 3. villous atrophy↓ claudin-5*, occluding**, ZO-1**↑ 4. SCFA : butyrate, isobutyrate*, propionate**, valerate*↑, |
Jaemoo Chun23) (2021) | |
| Allergic Rhinitis (AR) | Mahuang Fuzi Xixin Decoction (MFXD) | OVA-induced AR rats | -Normal group -AR model group -MFXD group -loratadine group -sodium butyrate group |
7.6 g/㎏, oral administration, once daily, 2 weeks | At the phylum level, Firmicutes, Bacteroidetes, Actinobacteria↑ Proteobacteria, Cyanobacteria↓ At the genus level, Anaerotruncus**, Butyricicoccus*, Lachnospiraceae**, and Ruminococcaceae**↑ Bacteroides**, Bifidobacterium**, Enterococcus**, Erysipelotrichaceae*↓ Lactobacillus group, Butyricicoccus pullicaecorum↑ Bacteroides fragilis group, Enterococcus spp.↓ |
1. nasal mucosa recovered Nasal symptom scores↓** IgE and histamine↓** 2. SCFA: Acetic, propionic, butyric acids↑** ZO-1 ↑ 3. IL-10↑* IL-17↓** ratio of Th17/Treg cells↓ IL-1β and IL-23 in lung tissues ↓** |
Xiao Liang24) (2020) |
| Xiao-Qing-Long-Decoction (XQLD) | 53 diagnosed AR patients who had not received prior pharmacologic treatment for AR →33 completed the whole study. | 150 ml of the decoction two times daily, 10 weeks | Bacteroides↑ Firmicutes↓ Dialister, Roseburia, Bacteroides (OTU_22), and Bacteroides (OTU_2040)↑ Prevotella_9↓ |
1. TNSS, RQLQ ↓* 2. IL-2,4, IFN-γ, TNF-α↑* (decreased at 6 month) 3. PPAR signaling pathway, peroxisome, citrate cycle↑ |
Libing Zhu16) (2021) | ||
| Asthma | recuperating lung decoction (RLD) | OVA-induced Asthma Model | -Normal group -Asthma model group -Dexamethasone group -Two RLD treated groups(Tb, Tc) |
1. Tb: 3.6 g/㎏, oral administration, once daily, 2 weeks 2. Tc: 7.26 g/㎏, oral administration, once daily, 2 weeks |
1. RLD(vs Dex): Adlercreutzia, Escherichia↑ 2. Tb: higher Prevotella Vs Tc: higher Aggregatibacter, Akkermansia, Enterococcus, Proteus / lower Lactobacillus and Bifidobacterium (no statistically significant dose-dependent effect was found) |
1. asthma symptom↓ 2. lung function: central airway resistance↓, airway hyperresponsivence↓(Tb**,Tc*)) 3. eosinophils in BALF↓ (Tb***,Tc***) serum IgE levels↓(Tb**,Tc**) 4. lung tissue damage↓ |
KONG Yan Hua18) (2016) |
| Pentaherbs formula (PHF) | OVA-induced allergic asthma mice | -Normal group -Asthma group -Two PHF treated groups(PHF14,PHF8) -Dexamethasone group |
PHF (9.2 ㎎) in 0.2 ml H2O, oral administration, 14 days(PHF14) or 8 days(PHF8) |
Bacteroidetes, Saccharibacteria ↑ Firmicutes↓ |
1. IgE↓* Airway Hyperresponsiveness↓(PHF14) Airway wall recovered. 2. eosinophils, neutrophils↓ (PHF14*) IL-4*, IL-33*, IL-31↓ Th1/Th2 ratio↑ 3. SCFAs: acetate, butyrate*↑ Propionate, isobutyrate↓ 4. Treg cells↑ |
Miranda Sin-Man Tsang22) (2018) | |
| You-Gui-Wan (YGW) | Der-p induced allergic asthma mice | -Control group -Asthma group -Dexamethasone group -Two YGW treated groups |
1. 0.2g/㎏ YGW 2. 0.5g/㎏ YGW Oral administration, daily, 27 days |
1.Eubacterium, Blautia, Ruminiclostridium, Lachnospiraceae_NK4A136_group were relatively enriched. 2. ratio of Firmicutes to Bacteroidetes↓ |
1. Penh value, IgE ↓ 2. Serum metabolite: significantly reverse the increased level of 7 metabolites (acetylcarnitine, tryptophan, norleucine, isoleucine, betaine, methionine, valine) |
Wei-Hsiang Hsu19) (2021) | |
| ShaoyaoGancao Tang (SGT) | OVA-induced asthma rats OVA-none rats | -OVA-none groups treated with physiologic saline, dexamethasone, 3 SGT. -Asthma groups Treated with physiologic saline, dexamethasone, 3 SGT. |
2.5g/㎏ SGT(LSGT) 5.0g/㎏ SGT(MSGT) 10.0g/㎏ SGT(HSGT) Intragastric administration, Once daily, 4 weeks |
Ethanoligenens, Harryflintia, Ruminococcus_2, Alistipes↓ Family_XIII_AD3011_group, Ruminococcaceae UCG-005, Candidatus_Saccharimonas↑ Ratio of Firmicutes/Bacteroidetes↑ |
1. IgE↓(MSGT**, HSTT**) 2. airway remodeling improved. GC hyperplasia↓(MSGT**,HSTT**) Change in colon tissue↓(MSGT **, HGST**) 3. IL-4↓ IFN-γ↑ Th1/Th2 ratio in lung and colon↑(HSGT*) 4. carbohydrate metabolism↑ |
Rui He22) (2023) | |
| Pingchuan formula(PC) | OVA-induced asthma mice | -Normal group -Asthma group -Dexamethasone group -Three PC treated group(LPC,MPC,HPC) |
200㎎/㎏ PC(LPC) 400㎎/㎏ PC(MPC) 800㎎/㎏ PC(HPC) Intragastric administration, Once daily, 1 week |
Akkermansia↑ Ruminococcaceae, Lachnospiraceae↓ |
1. lung tissues were recovered. 2. MPC : IL-4**, IL-6*, eotaxin*↓ IL-18***↑ 3. MPC: acacetin, abscisic acid ↑ |
Fei Liu21) (2023) |
SCORAD: Scoring Atopic Dermatitis, EASI: Eczema Area and Severity Index, DLQI: Dermatology Life Quality Index, EQ-5D-5L: EuroQol 5 dimension 5 level Questionnaire, NDI-K: Nepean Dyspepsia Index-Korean version, MHLJDD-F: active fraction of MHLJDD, FLG: filaggrin, LOR: loricrin, ADI: Atopic Dermatitis Index, WBC: white blood cell, ZO-1: zonula occludens-1, TNSS: Total Nasal Symptom Score, RQLQ: Rhinoconjunctivitis Quality of Life Questionnaire, PPAR: Peroxisome proliferator-activated receptor, BALF: bronchoalveolar lavage fluid, Penh: enhanced pause, GC: globlet cell, *: p<0.05, **: p<0.01, ***: p<0.001
본 연구에 수집된 총 10편의 논문 중 2편은 한국, 8편은 중국에서 출간되었다. 8편이 동물실험 연구, 2편이 인간 대상 연구였으며 이 중 1편15)은 무작위 대조 연구(randomized controlled trial, RCT), 1편16)은 단일군 전후 비교 연구였다. 알레르기 질환에 대한 한약 치료에 있어 장내미생물 관련성을 알아보는 연구는 2016년에 처음 출판되어 발표되었으며, 2021년 이후 출판된 논문이 10편 중 7편으로 최근에 이루어지고 있는 추세이다. 대상 질환은 아토피피부염이 3편, 알레르기 비염이 2편, 천식이 5편이었으며 모든 연구에서 각기 다른 한약 처방이 사용되었다.
8편의 동물실험에서 한약 투여기간은 1-4주 사이였으며, 2편의 임상연구인 RCT, 단일군 연구에서는 각 8주, 10주간 투여되었다. 단일군 연구16)에서는 유일하게 치료 종료 후 6개월간의 추적관찰을 시행하였다. 8편의 동물실험 중 2편은 2,4-dinitrochlorobenzene (DNCB)로 아토피피부염을 유발한 마우스, 1편은 Ovalbumin(OVA)로 알레르기 비염을 유발한 마우스, 4편은 OVA로 천식을 유발한 마우스, 1편은 Dermatophagoides pteronyssinus(Der-p)로 천식을 유발한 마우스를 이용하였다. Wang 등의 연구17)에서는 부위에 따라 다른 약물로 아토피피부염 증상을 유발하였다. Calcipotriol(MC903)을 왼쪽 귀에 사용하였고 DNCB를 등 피부에 사용하여, 등 피부의 아토피피부염 증상이 더 중증으로 발현되게 하였다.
단일군 임상연구 외의 9편의 논문에서 대조군을 설정하였다. 그 중 5편17-21)의 논문에서 투약한 한약의 용량에 따라 실험군을 나누었고, 1편22)의 논문에서는 한약의 투약기간에 따라 실험군을 나누었다. 6편17-22)의 연구는 한약치료군 이외에 덱사메타손(dexamethasone)을 투여한 양성대조군을 설정하여 연구를 진행하였다.
아토피피부염을 대상으로 한 3편의 논문 중 2편의 동물실험17,23)과 알레르기 비염을 대상으로 한 2편의 논문 중 1편의 동물실험24)에서 질환 유발로 증가한 혈중 immunoglobulin E(IgE)와 염증성 사이토카인이 대조군에 비해 유의하게 감소하는 것을 확인할 수 있었다. 천식을 대상으로 한 5편의 동물실험 중 4편의 연구18-20,22)에서 기도 과민성과 관련 있는 IgE가 대조군에 비해 유의하게 감소하였고, 1편의 연구21)에서 또한 염증성 사이토카인이 감소하였다.
반면, 아토피피부염을 대상으로 한 RCT15)에서는 염증 관련 물질의 유의한 변화가 없었다. 알레르기 비염을 대상으로 한 단일군 임상연구16)에서는 평가 시점에 따라 변화하는 양상을 보였는데, 대표적으로 interleukin-2(IL-2), interleukin-4(IL-4), tumor necrosis factor-α(TNF-α), interferon-γ(IFN-γ)가 치료 후 유의하게 증가한 후 6개월 차에 감소하였다.
10편의 논문 모두 장내미생물 다양성과 조성 변화를 평가하였다. 8편의 동물실험 중 4편의 연구17,19,22,24)에서 한약치료 후 장내미생물 다양성이 증가하였고, 모든 동물실험에서 장내미생물의 조성 변화가 나타났다. 한편, RCT 연구15)에서는 한약치료 후 장내미생물 다양성이 증가하였으나 조성 차이는 유의하게 나타나지 않았다. 단일군 연구16)에서는 한약치료 후 장내미생물 조성 변화는 있었지만 다양성은 오히려 감소하였다.
6편의 논문에서 장내미생물 관련 대사물질을 평가하여 면역반응과의 관련성을 알아보았다. 그 중 1편의 RCT 연구15)에서는 요독소인 indoxyl sulfate, phenylacetylglutamine이 대조군에서 크게 증가한 반면, 한약치료군에서는 유의한 변화가 나타나지 않았다. 나머지 5편의 동물실험 중 3편의 연구22-24)에서 특히 면역 조절에 중요한 역할을 한다고 알려진 단쇄지방산(short chain fatty acids, SCFA) 변화를 측정하였고, 대조군과 비교하였을 때 모두 유의한 변화가 있었다. 그 외 2편의 연구19,21)에서도 알레르기 질환을 유발하였을 때 증가한 대사물질이 한약치료 후 감소하였다. 한편, He 등20)은 치료 후 carbohydrate metabolism이 증가한 사실을 바탕으로 SCFA에 변화가 있을 것으로 추정하였다.
모든 연구에서 각 질환의 증상 변화에 대한 평가가 이루어졌다. 8편의 동물실험 중 6편의 연구에서 모두 대조군과 비교하여 임상 증상이 호전되는 모습을 보였고, 2편의 연구20,21)에서는 조직학적 변화를 통하여 증상 호전을 간접적으로 확인할 수 있었다. 2편의 임상연구 중 단일군 연구16)에서는 한약치료 후 임상 증상이 호전되었으나, RCT 연구15)에서는 실험군과 대조군 사이에 유의한 차이를 발견하지 못하였다.
위장관 관련 증상 평가는 RCT 연구15)에서만 이루어졌다. 실험군과 대조군 모두에서 증상의 호전을 보였으나 둘 사이의 유의한 차이는 발견하지 못하였다. 하지만 입에 쓴맛이 나는 증상, 상복부 팽만감, 구역감과 관련된 지표는 한약치료군에서 유의하게 감소하였다.
Ⅳ. 고 찰
장내미생물의 역할 중 면역 및 대사조절은 알레르기 질환을 비롯하여 대사성 질환, 신경계 질환 등 다양한 질환 발병에 영향을 미친다. 특히 장내미생물은 T 세포를 조절하여 염증과 면역 조절에 관여한다. 예를 들어, 장내미생물의 한 종류인 Bifidobacterium은 Treg cell을 활성화시켜 항염증 작용과 면역 관용을 유지하는 데 중요한 역할을 한다. 또한 장내미생물은 탄수화물을 분해하여 butyrate, propionate, acetate와 같은 SCFA을 생산한다. SCFA는 장벽을 견고히 유지하며 항염증 작용과 면역조절 작용을 가진다. 즉 SCFA는 섭취 음식, 장내미생물의 대사, 염증 반응을 연결하는 주요 물질이며, 염증성 질환을 예방하는 역할을 한다7).
본 연구에서는 한약이 장내미생물을 조절하여 알레르기 증상을 조절하는 효과와 기전에 대해 알아보고자 관련 연구를 정리하고 분석하였다. 본 연구에서 선정된 10편의 연구 중 대상 질환은 아토피피부염이 3편, 알레르기 비염이 2편, 천식이 5편이었다. 각 연구에 사용된 처방은 모두 달랐으며, 아토피피부염에 藿香正氣散, 黃連解毒湯, 柴胡淸肝湯, 알레르기 비염에 麻黃附子細辛湯, 小靑龍湯, 천식에 右歸丸, 芍藥甘草湯, 平喘湯, Recuperating lung decoction, Pentahurbs formula가 사용되었다. 한의학은 변증에 따른 처방이 이루어지기 때문에 연구에 사용된 처방이 일관되지 않고 다양할 수밖에 없다. 하지만 기존 연구들에서 이미 항염증 효과가 확인된 처방들이 선정되었다. 알레르기 질환은 공통적으로 IgE 증가와 T helper type 1(Th1)/T helper type 2(Th2) 불균형, 염증성 사이토카인의 증가를 보인다. 따라서 이러한 염증관련 물질들을 측정하는 것은 실제 임상 증상 변화와 더불어 알레르기 질환의 발병과 호전을 평가할 수 있는 지표가 될 수 있다. 10편의 연구에서 모두 관련 지표를 측정하였고 8편의 동물실험에서는 임상 증상의 호전과 함께 관련 지표들의 유의한 감소를 보여 알레르기 질환에 대한 한약의 항염증 효과를 확인할 수 있었다.
다만, RCT 연구에서는 염증관련 물질과 임상 증상의 유의한 차이가 발견되지 않았는데, 아토피피부염 대상의 선행 임상연구25)에서 藿香正氣散 복용 후 증상 완화와 염증성 사이토카인의 감소가 관찰된 바 있으므로 해당 연구에서는 유의한 결과가 나타나기엔 복용기간이 비교적 짧았던 것으로 사료된다. 또, 단일군 임상연구에서는 10주간의 치료기간 이후 오히려 염증성 사이토카인이 증가하였다가 6개월 후 감소하였다. 하지만 일부 장내미생물과 사이토카인의 상관관계를 밝혔고 장내미생물의 조성이 치료 후 6개월까지 변화하는 양상을 보였다. 이는 비교적 짧은 치료기간 동안에는 항염증 효과가 나타나지 않았지만 이후 지속적인 장내미생물 조성의 변화가 장기적인 항염증 효과를 나타낸 것으로 사료된다.
한편, 위장관 관련 증상에 대한 평가는 RCT 연구에서만 이루어졌다. 장내미생물은 염증성 장질환, 과민성장증후군과 같은 위장관 질환 발병에도 영향을 미치므로 관련 증상을 평가하는 것은 장내미생물 불균형 개선을 평가할 수 있는 하나의 지표가 될 수 있다. 본 논문에서 분석한 1편의 RCT 연구에서는 장내미생물 다양성 증가와 함께 위장관 관련 증상 중 일부가 호전되는 결과가 나타났다. 이는 위장관 관련 증상을 동반한 알레르기 질환 환자에게 한약 치료가 특히 효과적일 수 있음을 보여준다. 하지만 증상 평가가 1편의 논문에서 설문으로만 이루어져 명확한 결론을 내리기엔 한계가 있었다.
장내미생물의 다양성과 조성 변화는 면역 반응 변화에 영향을 미친다. 5편의 논문15,17,19,22,24)에서 치료 후 대조군에 비하여 장내미생물 다양성 지표가 개선되었으나, 단일군 연구16)에서는 치료 후 오히려 장내미생물 다양성이 감소하였는데 이를 병원성 박테리아의 감소 때문으로 설명하였다. 따라서 치료 후 면역 반응에 대한 효과를 알아보기 위해서는 장내미생물의 다양성뿐만 아니라 조성 변화를 함께 평가하는 것이 필요하다. 1편의 RCT 연구를 제외한 9편의 연구에서 알레르기 질환을 유발하였을 때와 한약 치료를 시행하였을 때 장내미생물 조성에 변화가 있었다. Thursby 등은 사람의 장내미생물에서 12개의 phylum으로 분류될 수 있는 총 2,172 미생물 종(species)이 확인되었으며, 이들 대다수가 Proteobacteria, Firmicutes, Actinobacteria 및 Bacteroidetes로 구성되어 있다고 밝혔다26). 그 중 특히 Bacteroidetes는 Treg cell 발달과 면역 조절 인자와 연관이 있고, Firmicutes는 알레르기 질환 환자에게 더 높은 비율로 나타나는 것으로 알려져 있다27). Begley 등28)은 천식 환자의 경우 Firmicutes/ Bacteroidetes 비율이 높은 경향을 보임을 밝혔고, Zhu 등은 Firmicutes가 비염 환자에게 더 많이 존재한다고 하였다29). 따라서 3편의 연구16,19,22)에서 공통적으로 Bacteroides가 증가하고 Firmicutes가 감소한 것은 한약의 장내미생물에 대한 긍정적인 효과를 보여준다. 이외에도 염증 조절과 관련 있는 미생물 변화21,23), SCFA 생산을 돕는 미생물 증가24) 등의 결과를 통해 한약치료 후 장내미생물 조성 변화에 따른 면역 조절 효과를 확인할 수 있었다.
장내미생물은 대사산물을 통하여 염증과 면역 조절에 관여하기도 한다. 그 중 SCFA는 Th17/Treg cell의 균형과 기능을 조절하고 장벽 결합을 견고하게 하며 면역 항상성을 유지함으로써 알레르기 질환을 완화시키는 잠재적인 면역조절자 역할을 한다30,31). 정상적인 장에서 가장 많은 비중을 차지하는 SCFA는 acetate, propionate, butyrate이다20). 본 논문에서 고찰한 6편의 연구에서 장내미생물과 상관성이 있는 대사물질을 측정하였고 그 중 3편의 연구는 SCFA를 측정하였다. SCFA는 한약 치료 후 유의한 증가를 보였고, 이는 한약의 장내미생물 조성 변화와 항염증 효과 사이의 인과관계를 설명할 수 있다.
2편의 연구23,24)에서는 장벽의 tight junction protein 변화도 측정하였는데, 모두 한약 치료 후 유의한 증가가 있었다. 장내미생물의 면역 조절 기능은 장벽의 결합으로도 설명할 수 있다. 미생물 불균형으로 인하여 대사산물에 변화가 생기면 장벽에 결함이 생기고 장내의 독소, 소화되지 않은 음식, 유해균 등이 전신 순환계로 유입될 수 있다32). 이는 전신 염증 반응과 자가면역질환 발병과 밀접하게 관련이 있다. 따라서 장벽 결합을 구성하는 단백질의 증가 또한 한약의 장내미생물 조절과 항염증 효과 사이의 인과관계를 설명할 수 있다.
한약은 미생물의 성장과 활동 조절을 도와주는 잠재적 프리바이오틱스로서 다양한 질환 치료에 중요한 역할을 할 수 있다33,34). 본 연구에 수집된 10편의 논문은 모두 다른 한약 처방을 사용하였으나, 1편의 RCT를 제외하고는 염증관련 물질 감소와 장내미생물 조성 변화를 확인할 수 있었다. 이는 한약이 알레르기 질환을 치료하는 여러 기전 중 하나로 장내미생물 조절을 통한 항염증 효과가 있다는 것을 알 수 있다. 물론 인과관계가 명확하지 않다는 한계가 있으나 한약 치료와 장내미생물 변화, 항염증 효과 사이의 상관관계를 확인할 수 있었다. 아토피 행진으로 이어지는 알레르기 질환 치료법이 완전하지 않은 현 상황에서 한약이 유용하게 활용될 수 있을 것으로 사료된다.
본 연구의 한계점은 아직까지 각 알레르기 질환별로 연구 수가 충분하지 않고 특히 임상연구가 부족하여 명확한 결론을 내기 어려웠다는 점이다. 그러나 본 연구는 알레르기 질환에 대한 한약의 장내미생물 조절에 대해 최초로 정리한 연구로서 향후 관련 연구를 계획하고 있는 연구자와 알레르기 질환을 치료하고자 하는 임상 한의사에게 도움이 될 수 있을 것으로 기대된다. 해당 주제에 대한 연구는 현재도 꾸준히 이루어지고 있으므로 후속 논문들의 결과를 다시 종합하여 고찰하는 것이 필요할 수 있다. 또한 각 논문에서 사용된 평가 지표가 각기 달라 치료 효과를 일정하게 분석하기 어려웠다는 점을 고려하여, 후속 논문에서는 염증관련 지표, 장내미생물 조성변화, 장내미생물의 대사산물에 대해 모두 평가가 이루어져야 할 것으로 사료된다. 특히 알레르기 질환은 IgE 증가, Treg cell 감소와 Th2가 우세한 모습이 특징적으로 보인다35). 따라서 해당 지표와 함께 장내미생물 대사산물 중 특히 면역 반응에 관여하는 것으로 밝혀진 SCFA에 대한 평가는 공통적으로 시행되어야 할 것이다. 또한 임상연구에서는 알레르기 항원에 대한 민감성 정도, SCORAD, TNSS, FVC(forced vital capacity), FEV1(forced expiratory volume in one second)과 같은 폐기능 측정을 통하여 알레르기 질환의 개선 정도를 평가할 수 있다. 이와 더불어 위장관 관련 증상에 대하여 설문뿐만 아니라 몸무게, 대변 상태 평가 등의 객관적 지표도 함께 측정한다면 한약의 장내미생물 조절 효과를 더욱 명확히 밝힐 수 있을 것이다. 또, 기존 임상연구에서 동물실험과 비교하여 상대적으로 긴 치료기간동안 연구가 진행되었음에도 염증관련 지표와 장내미생물 조성의 치료 전후 차이가 명확하지 않았다. 이는 인간의 장내미생물은 섭취되는 음식, 환경, 약물 복용 등 여러가지 외부 요인에 의해 지속적으로 영향을 받기 때문이다. 따라서 앞으로 시행될 임상연구에서는 충분한 치료기간이 필요할 것으로 사료된다.
Ⅴ. 결 론
본 연구는 장내미생물 조절을 통한 알레르기 질환의 한약 치료 연구 동향에 대해 분석하기 위해 국내외 전자데이터베이스를 이용하여 모든 논문을 고찰하였으며 다음과 같은 결론을 얻었다.
-
최종 선정된 10편의 논문을 분석한 결과, 2024년 1편, 2023년 2편, 2022년 1편, 2021년 3편, 2020년, 2018년, 2016년에 각 1편씩 출판되었다.
-
대상 질환은 아토피피부염이 3편, 알레르기 비염이 2편, 천식이 5편이었다. 각 연구에서 설정된 처방은 모두 다른 처방이었다.
-
모든 연구에서 알레르기 관련 염증물질, 장내미생물 조성 변화, 대상 질환의 증상 변화를 평가하였고, 6편의 연구에서 장내미생물 관련 대사물질, 1편의 연구에서 위장관 관련 증상을 평가하였다.
-
8편의 동물실험에서 염증물질의 유의한 감소가 있었다. 1편의 RCT를 제외한 9편의 연구에서 한약치료 후 장내미생물 조성 변화를 확인할 수 있었다. 장내미생물 관련 대사물질을 측정한 6편의 연구 중 5편은 알레르기 질환을 유발하였을 때 변화하는 대사물질이 한약치료 후 회복되는 양상을 확인하였고 1편은 한약치료 시 요독소에 변화가 없음을 확인하였다.
-
향후 연구에서는 일정한 평가지표를 활용하여 분석하고, 더 많은 임상연구가 이루어질 것을 제안한다.