Ⅰ. 서 론
웰빙(Well being)은 ‘삶의 질’을 강조하는 용어로 생활수준이 향상되고, 평균 수명도 증가하게 되면서 점점 사회적인 이슈가 되었다. 이런 사회적 변화에 따라 건강과 아름다움이라는 두 가지 목표를 이루기 위한 사람들의 욕구와 신체를 가꾸고 외모를 관리하며 아름답게 늙는 것에 대한 관심이 증가하였다1-3). 이에 따라 미용을 위한 기능성 화장품 분야의 산업 규모가 확대되었고, 보다 안전하고 유효한 천연물을 활용하기 위해 이의 효과를 검증하는 연구4-8)가 진행되고 있다2,3).
石膏는 性은 大寒하고, 味는 辛甘하여 生用하면 淸熱瀉火, 除煩止渴하여 熱病壯熱不退, 煩渴, 發狂, 發斑 등을 治하고, 煆用하면 生肌斂瘡하여 癰疽瘡瘍, 潰不收口 등에 外治한다.9) 이런 石膏의 효능을 활용하여 단일 약재로 활용했을 때10-12)와 石膏를 포함한 방제를 활용했을 때13-16)의 효과를 검증한 연구들이 보고되었다.
또한, 피부 질환을 치료하는 데에 石膏를 포함한 白虎湯17), 白虎加人蔘湯18), 荊防瀉白散19) 등의 방제의 효과를 검증하는 연구가 보고되었고, 石膏의 보습 강화 효과20)와 이를 포함한 加味防風通聖散의 미백 효과21)를 검증한 논문도 보고되었다.
최근까지 보고된 연구들을 살펴본 결과, 石膏의 미백 효과를 검증한 연구는 접하지 못하였다. 이에 저자는 石膏 추출물(Gypsum Extract, GE)이 미백에 미치는 효과를 알아보기 위해 GE가 흑색종 세포주인 B16F10 세포의 증식율, 멜라닌 생성, α-MSH(α-melanocyte stimulating hormone)으로 유도된 멜라닌의 생합성, Superoxide dismutase(SOD) 유사활성, 시험관 내에서와 세포 내에서의 tyrosinase 활성, α-MSH로 유도된 tyrosinase 활성에 미치는 효과를 관찰하였고, 유의한 결과를 얻었기에 보고하는 바이다.
Ⅱ. 재료 및 방법
본 실험에 사용된 石膏(Gypsum)은 황산염류에 속한 광물인 천연의 함수황산칼슘(CaSO4·2H2O)으로 그 중에 CaO 32.57%, SO346.50%, H2O 20.93%이며 채취 후에 泥砂와 雜石을 제거한 것9)을 동신대학교 부속 광주 한방병원에서 구입하여 사용하였다.
生石膏 100g과 증류수 1,500㎖를 전기약탕기 (대웅, 한국)로 120분간 전탕하였다. 전탕액을 필터로 거른 다음, 원심분리기 (비젼과학, 한국)를 이용하여 2,500 rpm에서 25분간 원심분리하여 상층액만을 취하였다. 얻어진 상층액을 감압농축기 (EYELA, Japan)로 감압 농축한 다음, 동결건조기(일신, Korea)를 이용하여 최종적으로 石膏 0.15g의 건조분말(Gypsum Extract, GE)을 얻었고, 수득율은 0.15%였다. 이 시료는 동결건조 분말을 인산 완충액(phosphate buffered saline, PBS)에 녹인 후, 0.22㎛의 필터(PALL, UK)에 걸러 멸균을 대신하였다.
B16F10 세포주의 생육 배지는 DMEM (Lonza, USA)을 사용하였고, 배지에 Antibiotic-Antimycotic (Gibco, USA)과 10% fetal bovine serum (Gibco, USA)을 첨가하였다. 실험기간 동안 B16F10 세포주는 37°C, 5% CO2 incubator에서 배양하였다.
EZ-Cytox Assay kit (Dogenbio, Korea)를 사용하여 GE가 B16F10 세포에 미치는 생존율을 측정하였다. B16F10 세포를 배양하여 96 well plate에 5×103cells/well의 농도로 각 well당 분주하고, 37°C, 5% CO2 incubator에서 24시간 배양하였다. 그 후, GE를 각 농도별 (0, 62.5, 125, 250, 500, 1,000㎍/㎖)로 처리하고, 37°C, 5% CO2 incubator에서 24시간 배양하였다. 다음으로 각 well에 EZ-Cytox 용액 10㎕를 처리하고, 37°C, 5% CO2 incubator에서 2시간 배양한 후 450nm에서 Microplate Reader (Bio-rad, USA)를 사용해서 측정하여 흡광도를 분석하였다.
멜라닌 생성에 GE가 미치는 영향은 Hosoi 등의 방법22)을 바탕으로 측정하였다. B16F10 세포주를 배양하여 각 well당 24 well plate에 2×104cells/well의 농도로 분주하고, 37°C, 5% CO2 incubator에서 부착 및 안정화를 위해 24시간 배양하였다. 그 후 GE를 농도별 (0, 62.5, 125, 250, 500, 1,000㎍/㎖)로 처리한 다음 37°C, 5% CO2 incubator에서 48시간 배양하였다. 배양한 후 PBS로 각 well을 세척하고, 1N NaOH 용액 400㎕을 첨가하여 1시간 동안 60°C에서 용해한 후, 405nm에서 Microplate Reader를 사용하여 측정하였다.
GE가 α-MSH(α-melanocyte stimulating hormone)으로 유도된 멜라닌 생합성에 미치는 효과를 알아보기 위하여 GE를 농도별 (0, 62.5, 125, 250, 500, 1,000㎍/㎖)로 처리하고, 37°C, 5% CO2 incubator에서 1시간 배양한 후 α-MSH 100nM를 처리하였다. 다음으로 37°C, 5% CO2 incubator에서 48시간 배양한 후 PBS로 각 well을 세척하고, 1N NaOH 용액 400㎕을 첨가하여 1시간 동안 60°C에서 용해한 다음 405nm에서 Microplate Reader를 사용하여 측정하였다.
GE의 SOD 유사활성도는 과산화수소(H2O2)로 활성 산소종을 전환하는 반응을 촉매하는 pyrogallol의 생성량을 Marklund 등의 방법23)을 바탕으로 측정하여 나타내었다. 또한, GE 처리 후의 SOD 유사활성을 알아보기 위하여 GE 각 농도 (0, 62.5, 125, 250, 500, 1,000㎍/㎖)를 buffer에 녹여 10㎕씩 96 well plate에 첨가한 다음 실온에서 Tris-HCl Buffer(50mM Tris aminomethane, 10mM EDTA, pH 8.0) 150㎕와 7.2mM pyrogallol 10㎕를 첨가하여 10분간 반응시키고, 반응을 정지시키기 위해 1N HCl 50㎕을 첨가한 후, 420nm에서 흡광도를 ELISA reader (Biorad, USA)를 이용하여 측정하였다. SOD 유사활성도는 추출물 무첨가구와 첨가구 간의 흡광도 차이를 백분율(%)로 나타내었다.
· A : 추출물 첨가구의 흡광도
· B : 추출물 무첨가구의 흡광도
GE가 tyrosinase 활성 억제에 미치는 효과는 Yagi 등의 방법24)을 이용해서 측정하였다. 0.175 M sodium phosphate buffer(pH 6.5) 0.5㎖와 10mM L-DOPA 용액 0.2㎖를 가한 다음 GE를 buffer에 녹이고 최종농도(0, 62.5, 125, 250, 500, 1,000㎍/㎖)로 되기 위해 0.1㎖를 가했다. 그 후, 37°C에서 2분간 mushroom tyrosinase(110unit/㎖) 0.2㎖를 첨가하여 반응하고, 475nm에서 흡광도를 측정하였다. Tyrosinase 저해율은 시료 용액의 무첨가구와 첨가구의 흡광도 감소율로 측정하였고, 저해율은 다음과 같이 계산하였다.
· A : 시료와 효소가 모두 첨가된 반응 용액
· B : 시료만 첨가된 반응 용액
· C : 효소만 첨가된 반응 용액
· D : 시료와 효소가 모두 첨가되지 않은 반응 용액
GE가 세포 내 tyrosinase 활성 억제에 미치는 효과는 Martinez-Esparza 등의 방법25)을 이용해 측정하였다. B16F10 세포를 1.5×106cells/dish의 농도로 cell culture dish에 분주한 후, 37°C, 5% CO2 incubator에서 부착 및 안정화를 위해 24시간 배양하였다. 다음으로 37°C, 5% CO2 incubator에서 GE 500㎍/㎖로 처리한 후 24시간 배양하였다. 배양 후, 세포를 Protein Extration solution 1㎖에 현탁시키고, 세포를 vortexing한 후 5분간 1,000rpm에서 원심분리하여 얻은 상층액을 활성 측정 효소액으로 사용하였다. 96 well plate에 기질인 L-DOPA(2㎎/㎖) 100㎕를 tyrosinase 활성을 측정하기 위하여 넣고, 효소액 40㎕를 첨가한 다음 37°C, 5% CO2 incubator에서 1시간 반응시킨 후 Microplate Reader를 사용하여 405nm에서 측정하였다. tyrosinase 활성 저해율은 대조군의 흡광도에 대한 백분율로 계산하였다. 또한, GE가 세포 내 tyrosinase 활성 억제에 미치는 효과를 알아보기 위해 arbutin을 양성 대조군으로 설정한 후 GE와 비교 측정하였다. B16F10 세포를 첨가하지 않고 tyrosinase를 처리한 군을 Non-treated군으로, GE나 arbutin을 처리하지 않은 군을 Control군으로, arbutin 500㎍/㎖를 처리한 군을 Arbutin 군으로 GE 500㎍/㎖를 처리한 군을 Gypsum군으로 설정하여 이들의 세포 내 tyrosinase 활성율을 관찰하였다.
α-MSH로 세포 내 tyrosinase 활성율에 미치는 효과를 알기 위해 GE 500㎍/㎖와 arbutin 500㎍/㎖를 처리하였다. 1시간 후 α-MSH 100nM를 처리한 다음 37°C, 5% CO2 incubator에서 24시간 배양 후 세포를 RIPA lysis buffer 1㎖에 현탁시켰다. 다음으로 세포를 vortexing한 후 5분간 1,000rpm에서 원심분리하여 얻은 상층액을 활성 측정 효소액으로 사용하였다. 이후 저해율과 실험방법은 tyrosinase의 활성 저해율과 동일하게 시행하였다. 또한, GE가 α-MSH에 의해 유도된 tyrosinase에 미치는 효과를 알기 위해서도 arbutin을 양성 대조군으로 설정하였는데, α-MSH 및 tyrosinase를 처리하지 않은 군을 Non-treated군으로, tyrosinase에 α-MSH와 약물을 처리하지 않은 군을 Control군으로, tyrosinase에 α-MSH를 처리한 군을 α-MSH군으로 그리고 tyrosinase에 α-MSH 처리된 상태에 다시 arbutin과 GE를 처리한 군을 각각 Arbutin군과 Gypsum군으로 설정한 후 이들의 tyrosinase 활성율을 측정하였다.
Ⅲ. 결 과
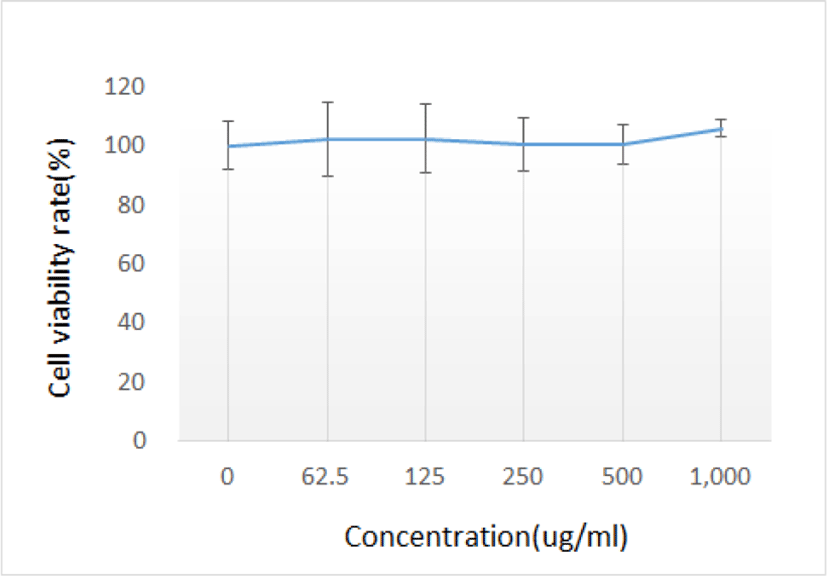
GE가 흑색종 세포주인 B16F10 세포의 증식율에 미치는 효과를 알아본 결과, 추출물의 농도에 따라 세포 증식율이 증가하였으나 통계적인 유의성은 보이지 않았다(Table 1, Fig. 1).
| Concentration (㎍/㎖, n=8) | 0 | 62.5 | 125 | 250 | 500 | 1,000 | |
|---|---|---|---|---|---|---|---|
| Cell viability rate(%) | Mean | 100.00 | 102.03 | 102.48 | 100.50 | 100.32 | 105.98 |
| SD | 8.13 | 12.50 | 11.64 | 9.28 | 6.68 | 2.71 | |
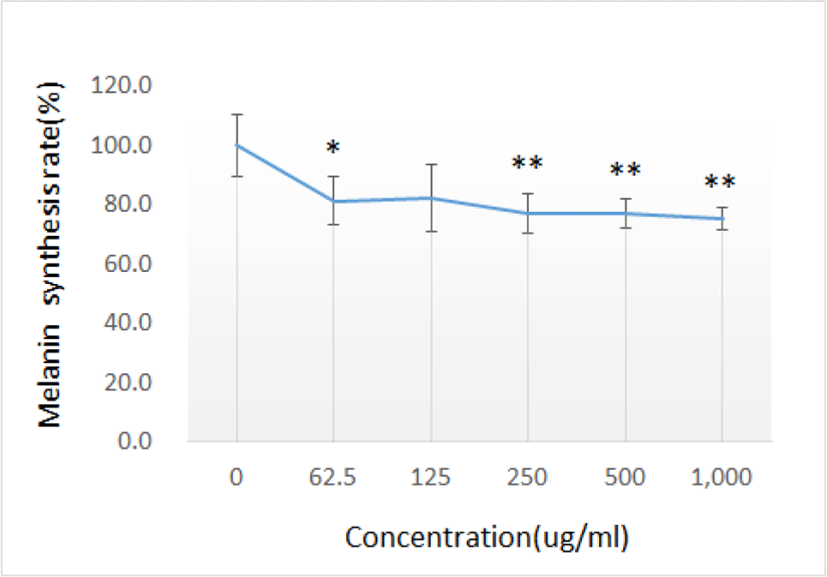
GE가 멜라닌 생성 억제에 미치는 효과를 측정한 결과, GE를 처리한 후 125㎍/㎖ 처리군(p=0.058)을 제외하고는 모두 유의하게 멜라닌 생성을 억제하였다(Table 2, Fig. 2).
| Concentration (㎍/㎖, n=4) | 0 | 62.5 | 125 | 250 | 500 | 1,000 | |
|---|---|---|---|---|---|---|---|
| Melanin synthesis rate(%) | Mean | 100.0 | 81.2 | 82.3 | 77.1 | 77.1 | 75.2 |
| SD | 10.60 | 8.24 | 11.34 | 6.54 | 4.97 | 3.68 | |
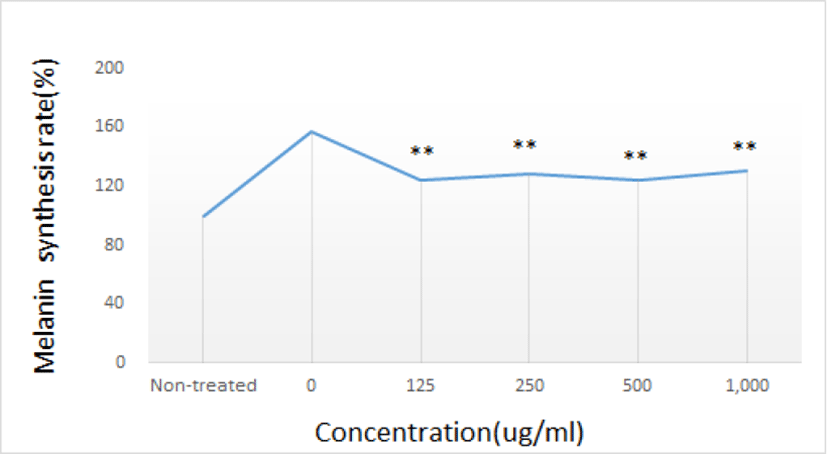
α-MSH(α-melanocyte stimulating hormone)로 유도된 멜라닌 생합성에 대한 GE의 효과를 관찰한 결과, α-MSH와 GE를 처리하지 않은 Non-treated군에 비해 α-MSH를 처리한 다른 실험군에서는 멜라닌 생합성율이 증가하였다. 또한, α-MSH를 처리한 실험군 중에서 GE를 처리하지 않은 0 농도군에 비해 GE를 처리한 다른 실험군이 유의하게 멜라닌 생합성율이 감소하였다(Table 3, Fig. 3).
| Concentration (㎍/㎖, n=4) | cell only | 0 | 125 | 250 | 500 | 1,000 | |
|---|---|---|---|---|---|---|---|
| Melanin synthesis rate(%) | Mean | 100.00 | 157.23 | 124.10 | 128.92 | 124.70 | 130.12 |
| SD | 1.39 | 9.91 | 4.17 | 7.49 | 3.61 | 2.78 | |
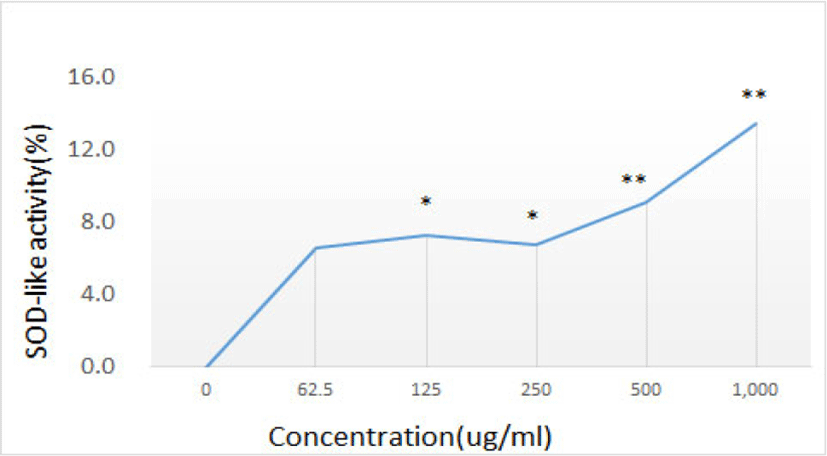
GE가 SOD 유사활성에 미치는 효과를 관찰한 결과, GE를 첨가하지 않은 0의 활성 저해율을 0%라 하였을 때, 125㎍/㎖ 농도 이상에서 모두 유의하게 SOD 유사활성이 증가하였다(Table 4, Fig. 4).
| Concentration (㎍/㎖, n=8) | 0 | 62.5 | 125 | 250 | 500 | 1,000 | |
|---|---|---|---|---|---|---|---|
| SOD-like activity(%) | Mean | 0 | 6.58 | 7.24 | 6.73 | 9.07 | 13.50 |
| SD | 0 | 3.01 | 4.88 | 3.29 | 2.64 | 8.36 | |
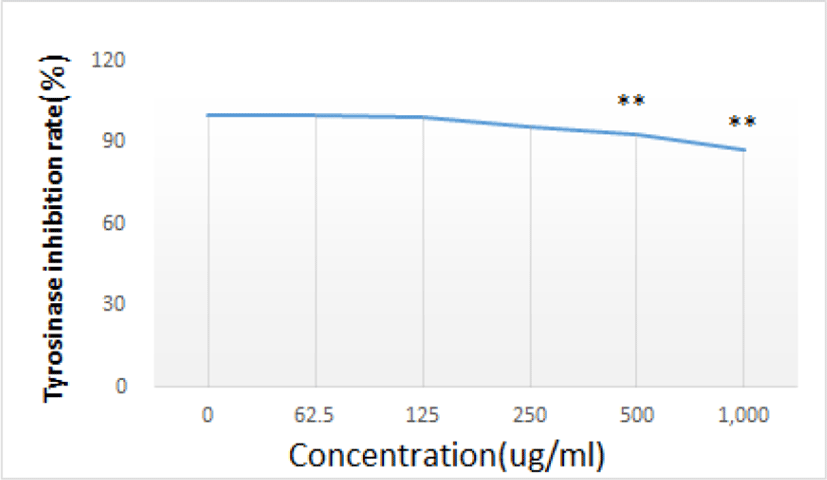
GE가 시험관 내에서의 tyrosinase에 미치는 효과를 관찰한 결과, GE를 처리하지 않은 군을 100%로 보았을 때 500㎍/㎖와 1,000㎍/㎖ 군에서 유의하게 tyrosinase 활성을 저해하였다(Table 5, Fig. 5).
| Concentration (㎍/㎖, n=8) | 0 | 62.5 | 125 | 250 | 500 | 1,000 | |
|---|---|---|---|---|---|---|---|
| Tyrosinase inhibition rate(%) | Mean | 100 | 100.35 | 99.39 | 96.11 | 93.05 | 87.22 |
| SD | 0 | 1.58 | 3.26 | 2.29 | 2.39 | 2.84 | |
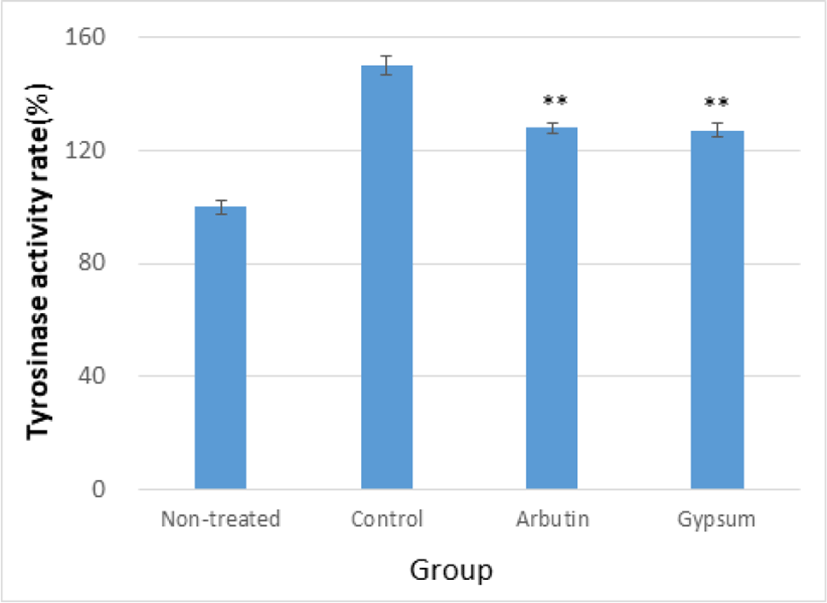
GE가 세포 내에서의 tyrosinase 활성에 미치는 효과를 관찰한 결과, Arbutin군과 Gypsum군 모두 Control군에 비해 유의하게 tyrosinase 활성을 감소시켰다(Table 6, Fig. 6).
| Group (500㎍/㎖, n=4) | Non-treated | Control | Arbutin | Gypsum | |
|---|---|---|---|---|---|
| Tyrosinase activity rate(%) | Mean | 100.00 | 150.17 | 128.05 | 127.18 |
| SD | 2.31 | 3.09 | 1.92 | 2.58 | |
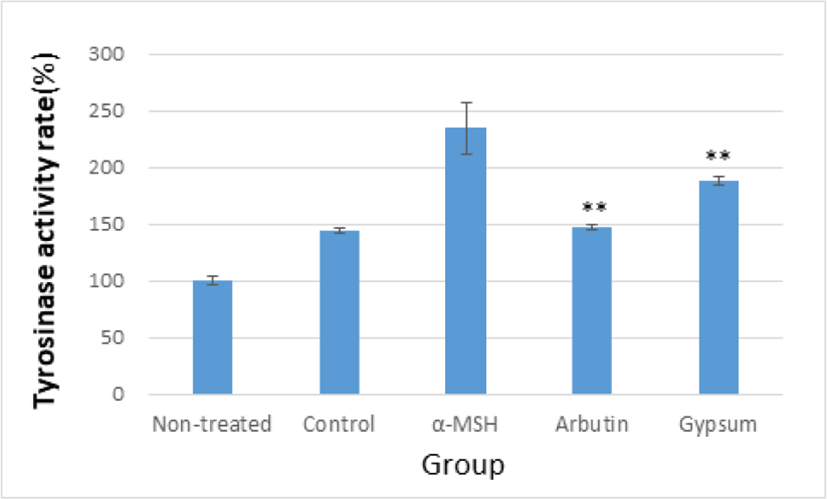
α-MSH로 유도된 tyrosinase 활성에 GE가 미치는 효과를 관찰한 결과, α-MSH를 처리한 후 α-MSH군, Arbutin군 그리고 Gypsum군 모두 Control군에 비해 tyrosinase 활성이 상승하였다. 또한 Arbutin군과 Gypsum군은 α-MSH군에 비해 유의하게 tyrosinase 합성을 감소시켰다(Table 7, Fig. 7).
| Group (500㎍/㎖, n=4) | Non-treated | Control | α-MSH | Arbutin | Gypsum | |
|---|---|---|---|---|---|---|
| Tyrosinase activity rate(%) | Mean | 100.00 | 143.96 | 234.56 | 147.15 | 187.75 |
| SD | 4.28 | 2.36 | 22.89 | 2.15 | 3.52 | |
Ⅳ. 고 찰
피부는 환경들로부터 인체를 구분하는 경계로 신체의 가장 외측에 있으면서 외부로부터 우리 몸을 보호하는 역할을 한다26,27). 또한, 피부는 이와 같은 생물학적 피부(biologic skin)의 작용과 더불어 미적인 기능과 감정 표현을 하는 사회적 피부(social skin)로도 중요한 역할을 한다28,29).
최근 생활수준이 향상되면서 피부의 미적인 기능에 대한 관심이 높아졌고, 미백, 주름, 노화 방지 등에 대한 연구가 다방면에서 증가하였다. 특히, 천연물은 안전하고 유효하여 이를 활용하는 연구가 활발히 진행되고 있다1-3).
이 가운데 미백에 대한 연구는 천연물을 활용하여 활발히 보고되고 있다. 拘杞子4), 金銀花5), 綠豆6), 豨簽7)과 같은 단일 약재의 효과를 검증한 연구를 보고하였고, 溫淸飮8) 등처럼 방제의 효과를 검증한 연구들도 진행되었다.
石膏는 性은 大寒하고, 味는 辛甘한 약재로 肺, 胃 二經으로 들어가 辛味로 散하고, 大寒하여 淸熱한다. 이로써 退熱生津하며 除煩止渴하므로 肺胃 氣分의 實熱을 淸解하는 要藥이 된다. 또한, 石膏는 血藥을 도와서 凉血解毒하여 發疹과 發斑에도 사용할 수 있고, 煆하면 淸熱작용이 감소하며 收斂 작용을 갖기 때문에 硏末하여 外敷하면 生肌斂瘡의 효능이 있다9).
石膏는 많은 질병에 대해 단일제제와 복합제로 활용되고 있다. 단일 제제를 사용해서 비장세포 IL-4 분비10), 만성 신부전의 신기능 보호와 조직학적 변화11), 당뇨병성 신증에 미치는 효과12) 등을 연구한 논문들이 보고되었고, 石膏를 포함한 방제를 활용해서 항암화학요법제의 세포독성과 종양세포의 라이소솜에 竹葉石膏湯加減方14), 비만에 越婢加半夏湯15), 인체의 수분컨트롤에 白虎加人蔘湯16)이 미치는 영향을 검증한 연구들도 보고되었다.
石膏를 포함한 방제는 피부질환을 치료하는 데에도 많이 활용되고 있다. IgE 매개 피부 반응을 억제하는 데에 白虎加人蔘湯18), 건선 치료에 白虎湯17), 陽毒發斑 치료에 荊防瀉白散19), 아토피 피부염 치료에 防風通聖散30), 만성두드러기 치료에 加減通淸散31), 등의 효과를 검증한 연구가 보고되었다. 또한, 石膏를 경구 투여 시 피부의 보습 작용을 강화하는 메커니즘에 대한 연구20)와 石膏를 포함한 방제인 加味防風通聖散의 미백 효과를 검증한 연구21)도 보고되어 미용 분야에 활용될 가능성도 보였다.
이처럼 石膏의 여러 효능에 대해 많은 연구가 진행되었고, 石膏가 피부과 질환에도 많이 쓰이지만, 미백에 대한 효과를 검증한 연구는 접하지 못했다. 이에 본 저자는 石膏가 피부 미백에 미치는 효과를 알아보기 위해 실험을 진행하였다.
멜라닌(melanin)은 피부색 결정에 가장 큰 역할을 한다32). 멜라닌 세포는 멜라닌을 포함하는 멜라닌소체(melanosome)를 합성하고, 분비하는 수지상 세포(dendritic cell)로 자외선의 유해한 효과로부터 우리 몸을 보호하고, 여러 염증상태의 부산물로 생기는 자유기 산소 유도체(free radical oxygen derivation)에 대한 생화학적 중화제로 작용한다26). 그러므로 자외선에 피부가 노출되면 방어하기 위해 멜라닌이 생성되고, 과다하게 자외선에 노출되거나 멜라닌이 α-MSH(α-melanocyte stimulating hormone)에 의해 과다 생성33)되면 표피에 침착되어서 기미, 주근깨 등 다양한 색소 침착이 유발된다34). 또한 멜라닌은 tyrosinase가 작용해서 tyrosine이 여러 물질로 대사되는 과정을 거쳐 최종적으로 합성되기 때문에 tyrosinase의 합성이 감소하거나 그 활성이 저해되면 멜라닌 생성이 감소된다35-37). 즉, 멜라닌의 생성과 tyrosinase의 활성은 미백에 결정적인 요인이 된다.
한편, Tyrosinase는 인체 내에서 주요한 산화 촉매 효소로 볼 수 있고, 이러한 기능 때문에 melanin을 합성하는데 중요한 역할을 한다38). 그러므로 산화적 스트레스는 tyrosinase 활성과 Melanin 합성에 영향을 줄 수 있다고 볼 수 있기에 SOD 활성에 미치는 영향을 살펴보는 것은 미백 효과를 알아볼 수 있는 기전이 될 수 있다7).
본 저자는 위의 기전들을 반영해서 石膏가 미백에 미치는 효과를 검증하기 위해 石膏 추출물(Gypsum extract, GE)이 멜라닌 생성, tyrosinase 활성, SOD 활성에 미치는 효과를 관찰하였고, 그 결과는 다음과 같다.
우선, 흑색종 세포주인 B16F10 세포의 증식율에 GE가 미치는 효과를 알아보기 위하여 GE를 농도별(0, 62.5, 125, 250, 500, 1,000㎍/㎖)로 배지에 처리한 후, 24시간 배양하여 관찰한 결과, GE의 농도에 따라 증가하였으나 통계적인 유의성은 보이지 않았다(Table 1, Fig. 1).
GE의 미백효과를 알아보기 위해 B16F10 세포를 이용하여 우선 GE가 멜라닌 생성 억제에 미치는 효과를 알아보았다. 이를 위해 GE를 농도별(0, 62.5, 125, 250, 500, 1,000㎍/㎖)로 처리한 후 24시간 배양하여 멜라닌 생성에 미치는 억제 효과를 측정한 결과, GE를 처리한 후 멜라닌 생성을 억제하는 효과를 보였으며 125㎍/㎖ 처리군(p=0.058)을 제외하고는 모두 유의하게 감소하였다(Table 2, Fig. 2).
다음으로 α-MSH로 유도된 멜라닌 생합성에 GE가 미치는 영향을 알아보았다. GE를 마찬가지로 농도별(0, 62.5, 125, 250, 500, 1,000㎍/㎖)로 투여하고 α-MSH를 처리한 후 멜라닌 생합성율을 측정하였고, 그 결과 α-MSH와 GE를 처리하지 않은 Non-treated군에 비해 α-MSH를 처리한 다른 실험군에서 멜라닌 생합성율이 증가하였고, α-MSH를 처리한 실험군 중에서 GE를 처리하지 않은 0 농도군에 비해 GE를 처리한 다른 실험군이 유의하게 멜라닌 생합성율이 감소하였다(Table 3, Fig. 3).
또한, 미백과 연관될 수 있는 다른 기전도 확인해보기 위해 GE가 SOD 유사활성에 미치는 효과를 알아보았다. GE를 마찬가지로 농도별(0, 62.5, 125, 250, 500, 1,000㎍/㎖)로 처리하여 SOD 유사활성도를 측정하였다. SOD 유사활성도는 GE 첨가구과 무첨가구 사이의 흡광도 차이를 백분율(%)로 나타내었고 그 결과 GE를 첨가하지 않은 0의 활성 저해율을 0%라 하였을 때, 125㎍/㎖ 농도 이상에서 모두 유의하게 SOD 유사활성을 증가시켰다(Table 4, Fig. 4).
GE가 멜라닌 합성에 영향을 주는 tyrosinase를 저해하는 효과가 있는지 관찰하기 위해서 우선, 시험관 내에서 GE를 농도별(0, 62.5, 125, 250, 500, 1,000㎍/㎖)로 처리하여 시험관 내에서 tyrosinase 활성을 저해시키는 감소율을 측정하였다. Tyrosinase 저해율은 시료 용액의 무첨가구와 첨가구의 흡광도 감소율로 측정하였고, 결과적으로 GE를 처리하지 않은 군을 100%로 보았을 때 500㎍/㎖와 1,000㎍/㎖ 군에서 유의하게 저해하는 것으로 보였다(Table 5, Fig. 5).
이어서 GE의 세포 내에서의 tyrosinase 활성 저해 효과를 관찰하기 위하여 의약부외품과 기능성 화장품의 미백 원료로 많이 사용되고 있는 arbutin39,40)을 양성 대조군으로 설정한 후 GE와 비교하여 측정하였다. B16F10 세포를 첨가하지 않고 tyrosinase를 처리한 군을 Non-treated군으로, 石膏나 arbutin을 처리하지 않은 군을 Control군으로, 앞의 실험들에서 유의한 결과를 냈던 농도 중 GE 500㎍/㎖를 처리한 군을 Gypsum군으로, 같은 농도로 arbutin 500㎍/㎖를 처리한 군을 Arbutin군으로 설정하여 이들의 세포 내 tyrosinase 활성율을 관찰하였다. 그 결과 Arbutin군과 Gypsum군 모두 Control군에 비해 유의하게 tyrosinase 활성을 감소시킨 것으로 관찰되었다(Table 6, Fig. 6).
마지막으로 GE가 α-MSH에 의해 유도된 tyrosinase에 미치는 효과를 알아보았고, 이는 B16F10 세포에 α-MSH와 함께 GE 500㎍/㎖를 병용 처리하여 tyrosinase 활성율을 측정하였다. 이 실험에서도 세포 내에서의 tyrosinase 활성 저해 효과를 관찰할 때처럼 arbutin을 양성 대조군으로 설정하였다. 이번 실험에서는 α-MSH 및 tyrosinase를 처리하지 않은 군을 Non-treated군으로, tyrosinase에 α-MSH와 약물을 처리하지 않은 군을 Control군으로, tyrosinase에 α-MSH를 처리한 군을 α-MSH군으로 그리고 tyrosinase에 α-MSH 처리된 상태에 다시 arbutin 500㎍/㎖과 GE 500㎍/㎖를 처리한 군을 각각 Arbutin군과 Gypsum 군으로 설정한 후 이들의 tyrosinase 활성율을 측정하였다. 그 결과 α-MSH를 처리한 후 α-MSH군, Arbutin군 그리고 Gypsum군 모두 Control군에 비해 상승하였다. 또한, Arbutin군과 Gypsum군은 약물을 처리하지 않은 α-MSH군에 비해 tyrosinase 합성을 유의하게 저해시켰다(Table 7, Fig. 7).
石膏는 肺, 胃 二經으로 들어가 肺胃氣分의 實熱을 淸解하는 要藥이 되는데, 肺는 피부를 主하고, 足陽明胃經은 안면부를 流注하므로 石膏가 피부와 안면부의 火를 淸케하고, 이로 인한 미백의 효과를 기대할 수 있다고 사료되어 본 저자는 이상의 실험을 진행해 보았다. 그 결과, GE는 미백에 결정적인 역할을 하는 멜라닌 합성과 Tyrosinase 활성을 저해하였고, 미백의 기전이 될 수 있는 SOD 유사활성을 증가시켰다. 이를 통해 본 저자는 石膏가 미백에 유의한 효과가 있음을 확인하였고, 이는 대조군인 arbutin과 비교하면 효과가 다소 부족하나 미백을 위해 石膏를 활용할 수 있는 가능성을 제시했다는 점에서 의미가 있다고 사료된다.
이에 저자는 본 연구가 미백에 石膏가 활용되기 위해 검증되어야 할 부작용 여부 확인 및 최소화, 그리고 외용제 등으로 사용할 때나 포제 과정을 거친 후 사용할 때의 효과와 비교를 통한 최적의 제제 개발, 나아가 이를 포함한 복합제 활용 가능성에 대한 연구의 초석이 되길 바라는 바이다.
Ⅴ. 결 론
石膏 추출물(Gypsum Extract, GE)이 미백에 미치는 효과를 관찰하여 다음과 같은 결론을 얻었다.
-
GE는 농도에 따라 B16F10 세포의 증식율이 증가하는 경향이 보였으나 유의성은 보이지 않았다.
-
GE는 125㎍/㎖ 처리하였을 때를 제외하고는 멜라닌 생합성을 모두 유의하게 감소시켰다.
-
α-MSH를 처리하면, 멜라닌 생합성율이 크게 증가하였고, α-MSH를 처리한 실험군 중에서 GE를 처리한 실험군은 처리하지 않은 0 농도군에 비해 유의하게 멜라닌 생합성율이 감소하였다.
-
GE는 125㎍/㎖ 이상으로 처리하였을 때, 모두 유의하게 SOD 유사활성을 증가시켰다.
-
GE는 시험관 내에서 500㎍/㎖와 1,000㎍/㎖ 처리하였을 때, 유의하게 Tyrosinase 활성을 감소시켰다.
-
시험관 내에서 tyrosinase 활성을 유의하게 감소시켰던 GE 500㎍/㎖를 처리한 Gypsum군과 양성대조군으로 arbutin 500㎍/㎖ 처리한 Arbutin군은 처리하지 않은 Control군에 비해 세포 내에서 유의하게 tyrosinase 활성을 감소시켰다.
-
α-MSH를 처리하면, tyrosinase 활성율이 크게 증가하였고, α-MSH를 처리한 실험군 중에서 GE 500㎍/㎖를 처리한 Gypsum군과 양성대조군으로 arbutin 500㎍/㎖ 처리한 Arbutin군은 처리하지 않은 α-MSH군에 비해 유의하게 tyrosinase 활성을 감소시켰다.






