Ⅰ. 서 론
아토피 피부염(Atopic dermatitis)은 심한 가려움 등을 특징으로 호전과 악화를 반복하는 만성 재발성 피부염으로, 주로 영·유아기, 특히 생후 2개월 전후(약 10%)에서 많이 나타났지만 근래에 이르러서는 연령을 불문하고 성인(약 3%)에서도 많이 나타난다1,2). 아토피 피부염의 원인은 현재까지 정확한 기전이 밝혀지지 않았으나 유전적, 환경적, 면역학적 요인과 감염, 위생 가설, 혈관 이상, 피부 장벽 이상 등이 있으며 여러 가지 인자간의 상호작용이 관여하며 최근 환경적 인자의 요인으로 세계적인 유병률은 증가 추세에 있다1-4).
임상 양상은 유아기(생후 2개월~2세 미만)의 경우 얼굴·두피·사지의 신측 부위에 급성 병변으로 인설을 동반하거나 동반하지 않는 홍반성 반·가피·삼출액을 동반한 습윤성 반점 등이 나타나고, 소아기(2~12세 미만)의 경우 주관절과 슬관절 등의 굴측부에 홍반을 동반한 인설과 가피 및 태선화의 형태가 나타나며, 청소년기와 성인기(12세~)의 경우 주로 얼굴·목·두피에 만성형의 피부 습진과 홍반이 나타난다5).
서양의학에서는 습도 및 온도를 유지하여 피부의 건조를 예방하는 등의 대증요법과 함께 국소치료로서 부신피질 호르몬·면역조절제·항생제·항진균제·항바이러스제 등을 도포하며, 국소 도포에 반응이 없는 병변에는 전신 요법으로서 항히스타민제·부신피질 호르몬제·항생제·항진균제·Cyclosporine 등의 경구투여와 면역글로불린의 정맥 주사, 광선 치료와 탈감작 요법 혹은 달맞이꽃 종자유를 포함한 음식 혹은 약제 투여 등 다양한 치료법이 개발되어 사용되고 있다5,6).
아토피 피부염의 가장 특징적인 증상인 소양증은 피부의 건조 정도가 심할수록 악화되므로 피부 보습을 유지하는 것이 무엇보다 중요하다1). 특히 최근 아토피 피부염 환자들의 질환 대응 방식이 약물 치료에 국한된 방법에서 점차 아토피 케어용 연고나 기능성 화장품 등을 통한 일상 관리의 영역으로 확대되고 있는데 반해 그 동안 의학적으로 입증되지 않은 아토피성 피부 건조 개선용 기능성 제품들이 시장에 만연하고 있음을 고려할 때, 임상연구를 통한 객관적 평가 및 검증 절차를 거친 아토피성 피부 건조 개선용 보습제의 개발이 매우 중요하다고 볼 수 있다.
이에 따라 아토피 피부염의 치료에 대해 내복약뿐만 아니라 한약제재 및 천연자원의 생리활성물질 등을 이용한 외용제와 관련된 임상연구가 진행되고 있는데, 오 등7)의 托裏消毒飮 함유 외용제, 강 등8)의 神效托裏散 함유 한방화장품, 이 등9)의 도고 온천수에 첨가한 게르마늄 성분, 손 등10)의 편백유 2% 크림형, 김 등11)의 이온화된 맥반석 용액, 정 등12)의 상황버섯 추출물을 함유한 한방화장품 등을 이용하여 아토피 피부염이 호전되는 임상 증례를 보고한 바 있으나, 최근 증가하고 있는 아토피성 피부 건조 개선용 화장품에 대한 수요에 비해 한약추출물 원료를 활용한 아토피 케어용 기능성 화장품의 개발에 있어서는 여전히 부족한 실정이다.
본 연구에서 사용된 환삼덩굴추출물의 원재료인 율초(葎草, Humulus japonicus Sieboid & Zucc.)는 삼과(Cannabinaceae)에 속한 환삼덩굴 또는 한삼덩굴이라 불리는 1년생 혹은 다년생 식물의 전초로 한국, 일본, 대만, 중국 등에 자생하는 덩굴성 한해살이풀이며, 일반적으로 여름, 가을에 채취하여 햇볕에 건조한 전초(뿌리 제외)를 율초라고 한다13,14). 율초에는 luteolin, glucoside, choline, asparagine, cosmosiin, vitexin 및 정유 성분 등이 함유되어 있으며, 정유 성분 중에는 주로 β-humulene, α-copaene, caryophyllene, α-selinene, β-selinene, γ-cadinene 등이 함유되어 있다15).
율초는 淸熱, 鎭痛, 消炎, 利尿, 解毒 등의 효능이 있다고 알려져 있으며16), 이와 관련하여 율초의 항산화, 항염 및 항지질 효과 등에 관한 연구가 활발하게 진행되고 있다13,17-20). 특히 율초의 항산화 및 항염 효과와 관련하여 이 등21)의 간 보호 효과, 문 등22)의 신장염 개선 효과, 이 등23)의 심근독성 개선 효과 등이 보고된 바가 있으나, 율초, 즉 환삼덩굴추출물을 이용한 아토피 피부염 개선 효과와 관련된 연구는 전무한 실정이다.
이에 따라 본 임상연구에서는 아토피성 피부로 건조함을 가진 대상자에게 환삼덩굴추출물 원료를 함유하는 기능성 화장품이 피부 보습, 피부 장벽 보호 등의 기능으로 아토피성 피부 건조 증상을 개선시키는지 그 효과를 확인하고 사용상의 안전성을 평가해 보고자 하였다.
Ⅱ. 연구 대상 및 방법
인체적용시험 모집 공고를 통해 세명대학교 부속 제천한방병원 한방안이비인후피부과에 내원하여 한방안이비인후피부과 전문의 및 전문수련의 진료 후 경증 아토피 피부염으로 진단된 만 5세 이상 30세 이하의 남성 및 임신 가능성이 없는 비수유부 여성 중 선정기준에 적합하며 제외기준에 해당되지 않는 환자를 대상으로 2018년 03월 20일부터 2018년 07월 05일까지 본 임상연구를 진행하였다.
인체적용시험에 들어가기 전, 아토피성 피부로 건조함을 가진 대상자에 한하여 인체적용시험의 목적과 내용에 대해 보호자 및 대상자에게 상세히 설명하고, 보호자와 대상자의 자유의사에 따라 대상자 동의서에 서명한 대상자들만을 연구에 참여시켰다.
총 48명이 인체적용시험에 참여하였으며, 참여한 48명 중 동의철회/치료거부에 의한 중도탈락은 1명으로 총 47명이 6주간의 인체적용시험을 계획서에 따라 종료하였다.
본 임상연구는 2018년 03월 13일 세명대학교 부속 제천한방병원 기관생명윤리위원회(IRB)에서 승인 받고 실시하게 되었으며(IRB 승인번호: SMJOH- 2018-04), 구체적인 선정기준과 제외기준은 다음과 같다.
-
① 천연물 및 천연추출물에 과민증 또는 그 병력이 있는 대상자
-
② 아토피 피부염 이외에 다른 피부질환이나 전신질환을 가지고 있는 대상자
-
③ 4주 이내 지속적으로 피부 상태 개선 및 면역 기능에 영향을 미치는 건강기능식품 및 의약품(호르몬제, 경구 및 국소스테로이드, NSAIDs, 연고제 포함) 복용 및 한방약제와 약품을 이용한 습포치료, 광선치료, Probiotics, 면역요법 등의 치료요법을 지속적으로 받아야 하거나 받고있는 대상자
-
④ 평가 부위에 기타 피부병변이 있어 측정이 곤란한 대상자
-
⑤ 3개월 이내 외과적인 수술을 받았거나 최근 5년 내 암 진단 및 치료 받은 적이 있는 대상자
-
⑥ 최근 4주 이내에 다른 임상시험에 참여한 경험이 있는 대상자
-
⑦ 임신부, 수유부 및 가임 여성으로 참여기간 동안 임신 및 수유의 계획이 있는 대상자
-
⑧ 연구자 소견으로 볼 때, 시험의 준수사항을 따를 수 없다고 판단되거나 기타 의사가 부적합 하다고 판단되는 대상자
-
① 시험자에 의해 중지, 탈락되는 경우
-
㉮ 인체적용시험 진행 도중 선정/제외기준 위반이 발견된 경우
-
㉯ 갑작스런 사고로 인하여 시험을 계속할 수 없는 경우
-
㉰ 대상자의 안전성에 문제를 일으킬 수 있다고 담당의사가 판단한 경우
-
㉱ 과도한 예측 이상반응 증상, 사망을 포함한 중대한 이상반응의 경우
-
㉲ 방문 계획 등에 대한 순응도: 계획된 방문 일에 방문하지 않아 안전성 및 유효성 평가를 하지 못하는 경우(단, 계획된 방문일이 지났으나 여유분의 시험용 화장품이 있어 제대로 사용한 경우는 제외)
-
㉳ 병용 금지된 약물을 복용하거나 병용금지약물의 치료가 필요하다고 판단된 경우
-
㉴ 인체적용시험용 화장품을 용법 용량대로 사용하지 않아 인체적용시험을 진행 할 수 없다고 판단될 경우
-
㉵ 시험대상자의 추적관찰이 불가능한 경우
-
㉶ 대상자의 증상 악화로 더 이상 인체적용시험을 진행할 수 없다고 판단될 경우
-
㉷ 기타 연구자가 판단했을 때 시험지속이 곤란하다고 판단한 경우
-
-
② 대상자에 의해 중지, 탈락되는 경우
본 인체적용시험에 사용되는 시험제품과 대조제품은 동일한 플라스틱 용기(PET)에 포장되어 공급받았고, 한방병원 IP 보관실에서 관리하였다.
선정된 대상자는 시험군 또는 대조군에 1:1의 비율로 무작위배정 되었으며 무작위배정 코드에 따라 두 군 중의 한 군에 첫 번째 방문일 순서대로 낮은 번호부터 할당되었다. 시험 진행 중에는 연구자와 대상자 모두 각 대상자가 어느 군에 배정되어 있는지 알지 못하였고, 의학적 긴급 상황이 발생하기 전까지는 이중맹검을 해제하지 않아 배정된 군의 비밀을 유지하였다.
-
① 시험제품명 : PB301 로션
-
② 포장단위 : 200g(제공량: 1인당 2통, 총 400g 제공)/ 포장재질 : 플라스틱 용기(PET)/ 펌프(OTHER)
-
③ 용법 및 용량 : 1일 3회(아침, 점심, 저녁), 총 6주간 팔 주관절 부위 및 피부 병변 부위에 적당히 도포한 후 이를 사용일지에 기록함.
-
④ 시험제품의 전성분(Table 1)
-
① 대조제품명 : 현재 시중에서 유통 중인 일반 보습 화장품
-
② 포장단위 : 200g(제공량: 1인당 2통, 총 400g 제공)/ 포장재질 : 플라스틱 용기(PET)/ 펌프(OTHER)
-
③ 용법 및 용량 : 1일 3회(아침, 점심, 저녁), 총 6주간 팔 주관절 부위 및 피부 병변 부위에 적당히 도포한 후 이를 사용일지에 기록함.
-
④ 대조제품의 전성분(Table 1)
1차 및 2차 유효성 평가지표로 아토피성 피부로 건조함을 가진 대상자의 객관적 상태를 측정하기 위하여 항온항습시설이 갖추어진 세명대학교 부속 제천한방병원 피부진단실에서 피부 측정 장비를 통한 기기적 평가를 실시하였다. 피부진단실의 항온항습조건은 실내온도 20-25°C, 실내습도 40-60%를 유지하도록 하였다.
연구대상자가 검사실에 들어오면 물이나 비누로 측정 부위를 가볍게 세척 후 마른 상태를 유지하도록 하여 최소 30분 이상 측정 부위를 노출한 다음 안정을 취해 피부 표면의 온도와 습도를 측정 장소의 온도와 습도에 적응하게 하였고, 정확한 평가를 위해 수분 섭취 및 배설을 제한하였다. 피부측정은 피부수분 함유량 측정, 경피수분 손실량 측정 순으로 진행하였고, 각각 총 5회에 걸쳐 반복 실시 후 최댓값과 최솟값을 제외한 3개 값의 평균을 사용하였다.
-
① 피부수분 함유량(Skin Hydration) 측정
Corneometer CM825(Courage+Khazaka electronic GmbH, Germany)를 사용하여 좌측 주관절 1㎝ 아래 및 완관절과 주관절 내측 사이 중앙 부위의 피부수분 함유량을 측정하였으며, 측정값의 단위는 arbitrary unit(A.U.)이다.
-
② 경피수분 손실량(Transepidermal Water Loss, TEWL) 측정
Tewameter TM300(Courage+Khazaka electronic GmbH, Germany)를 사용하여 좌측 주관절 1㎝ 아래 및 완관절과 주관절 내측 사이 중앙 부위의 경피수분 손실량을 측정하였으며, 측정값의 단위는 g/h/㎡이다.
인체적용시험의 시험제품 및 대조제품 사용 전, 사용 중, 사용 6주 후의 이상반응과 EASI Score 값의 변화 및 가려움 증상 평가 점수 변화를 측정하여 증상의 악화여부를 평가하고 활력징후 측정(체중, 혈압, 맥박수, 체온)을 실시한다. 이상반응이 없는 경우라면, 종료 방문 검사로 인체적용시험의 참여를 종료하였다.
본 연구 대상자로부터 얻어진 자료는 크게 Safety군, ITT(intention to treat)군, PP(per protocol)군의 세 가지 형태로 분석하였다.
-
① 안전성 평가(Safety)군
Safety군은 본 연구에 무작위배정 되어 최소한 1회 이상 시험 및 대조제품을 사용한 대상자를 의미한다.
-
② ITT군
ITT군은 본 연구에 무작위배정 되어 시험 및 대조제품을 받아 제품을 1회 이상 사용한 대상자 중 제품 사용 후 1차 유효성 평가 자료가 1회 이상 수집된 대상자를 의미한다.
-
③ PP군
PP군은 ITT군에 포함되는 대상자 중 인체적용시험계획서에 따라 중대한 계획서 위반 없이 본 연구를 성공적으로 완료한 대상자이며, 중대한 계획서 위반으로는 동의서 미취득, 선정/제외기준 위반, 병용금기약물 복용, 2회 연속 사용 순응도 80% 미만, 종료시점의 방문기간 미 준수 등을 포함한다.
유효성 자료에 대한 분석은 ITT군과 PP군을 대상으로 하고 주 분석군은 ITT군으로 하였다.안전성 자료에 대한 평가는 Safety군, 그리고 인구통계학적 및 기타 기저특성에 대한 분석은 ITT군을 대상으로 하였다. ITT군의 유효성 자료에 한해 최종 종료 시점의 자료가 부재한 경우 LOCF(Last Observation Carried Forward Analysis)를 적용해 무작위배정 후 가장 최근에 얻어진 자료로 대체하였다. 중간분석은 실시하지 않았다.
인구통계학적 및 기타 기저 특성에 대한 분석은 연속형 자료의 경우 시험 대상자 수, 평균, 표준편차, 중앙값, 최솟값 및 최댓값을 제시하고, 군 간 차이에 대한 통계적 유의성은 Independent two-sample t-test 또는 Mann-Whitney test 로 검정하였다. 범주형 자료의 경우 빈도와 비율을 제시하고, 군 간 차이에 대한 통계적 유의성은 Chi-square test 또는 Fisher’s exact test 로 검정하였다.
분석에 앞서 관측치가 정규분포인지 탐색하기 위해 Kolmogorov-Smirnov test 등의 방법으로 정규성을 증명하여 정규분포를 따를 경우 모수적 방법을 사용하였고, 정규분포를 따르지 않을 경우 비모수적 방법을 사용하였다. 모든 통계 분석은 R 3.5.1, SPSS 24.0을 이용하여 실시하였다.
-
① 1차 유효성 평가변수 분석방법
인체적용시험용 제품 사용 전 V2(Baseline) 대비 V4(6주, 종료방문)의 시험군 내의 피부수분 함유량(Corneometer), 경피수분 손실량(TEWL) 변화치에 대해 기술통계량으로 시험 대상자 수, 평균, 표준편차, 중앙값, 최솟값 및 최댓값을 제시하고, 군 내 차이에 대한 통계적 유의성은 paired t-test 또는 Wilcoxon signed rank test로 검정하였다.
-
② 2차 유효성 평가변수
-
㉮ V2(Baseline) 대비 V3(3주)의 시험군 내 피부수분 함유량 및 경피수분 손실량의 변화치 인체적용시험용 제품 사용 전 V2(Baseline) 대비 V3(3주)의 피부수분 함유량 및 경피수분 손실량의 변화치에 대해 기술통계량으로 시험 대상자 수, 평균, 표준편차, 중앙값, 최솟값 및 최댓값을 제시하고, 군 내 변화량의 통계적 유의성은 paired t-test 또는 Wilcoxon signed rank test 로 검정하였다.
-
㉯ V3(3주) 대비 V4(6주, 종료방문)의 시험군 내 피부수분 함유량 및 경피수분 손실량 변화치 인체적용시험용 제품 사용 후 V3(3주) 대비 V4(6주, 종료방문)의 시험군 내 피부수분 함유량 및 경피수분 손실량 변화치에 대해 기술통계량으로 시험 대상자 수, 평균, 표준편차, 중앙값, 최솟값 및 최댓값을 제시하고, 군 내 변화량의 통계적 유의성은 paired t-test 또는 Wilcoxon signed rank test로 검정하였다.
-
㉰ V2(Baseline) 대비 V4(6주, 종료방문)의 시험군과 대조군의 군 간 피부수분 함유량 및 경피수분 손실량의 변화치의 차이
인체적용시험용 제품 사용 후 V2(Baseline) 대비 V4(6주, 종료방문)의 시험군과 대조군의 군 간 피부수분 함유량 및 경피수분 손실량 변화치의 차이에 대해 기술통계량으로 시험 대상자 수, 평균, 표준편차, 중앙값, 최솟값 및 최댓값을 제시하고, 두 군 간 차이에 대한 통계적 유의성은 Independent two-sample t-test 또는 Mann-Whitney test, 각 군 내 변화량의 통계적 유의성은 paired t-test 또는 Wilcoxon signed rank test로 검정하였다.
-
㉱ V2(Baseline) 대비 V3(3주)의 시험군과 대조군의 군 간 피부수분 함유량 및 경피수분 손실량 변화치의 차이
인체적용시험용 제품 사용 후 V2(Baseline) 대비 V3(3주)의 시험군과 대조군의 군 간 피부수분 함유량 및 경피수분 손실량 변화치의 차이에 대해 기술통계량으로 시험 대상자 수, 평균, 표준편차, 중앙값, 최솟값 및 최댓값을 제시하고, 두 군 간 차이에 대한 통계적 유의성은 Independent two-sample t-test 또는 Mann-Whitney test, 각 군 내 변화량의 통계적 유의성은 paired t-test 또는 Wilcoxon signed rank test로 검정하였다.
-
㉲ V3(3주) 대비 V4(6주, 종료방문)의 시험군과 대조군의 군 간 피부수분 함유량 및 경피수분 손실량 변화치의 차이
인체적용시험용 제품 사용 후 V3(3주) 대비 V4(6주, 종료방문)의 시험군과 대조군의 군 간 피부수분 함유량 및 경피수분 손실량 변화치의 차이에 대해 기술통계량으로 시험 대상자 수, 평균, 표준편차, 중앙값, 최솟값 및 최댓값을 제시하고, 두 군 간 차이에 대한 통계적 유의성은 Independent two-sample t-test 또는 Mann-Whitney test, 각 군 내 변화량의 통계적 유의성은 paired t-test 또는 Wilcoxon signed rank test로 검정하였다.
-
-
③ 추가 분석방법
경시적 연구에서 대상자의 반복 관찰치는 상관된(correlated) 반응 결과를 얻기 때문에 상관성을 고려하지 않으면 통계적 의미를 과장하게 된다. 따라서 같은 연구대상자의 반복 관찰치는 서로 상관성이 있음을 고려한 통계기법으로 분석해야 하므로 본 연구에서는 반복측정 분산분석(RM ANOVA; Repeated measures ANOVA)을 실시하였다.
두 군에 서로 다른 처치를 가한 뒤 두 군의 시간에 따른 차이를 비교하면서 시간과 군의 상호작용에 초점을 맞추고, 연구의 정밀도를 높이기 위해 치료 전과 후 만을 비교한 것뿐만 아니라 각 개체 내에서 시간에 따른 변화를 측정하였다. 시점 간 비교를 위한 사후검정은 다중비교에서 생길 수 있는 오류를 보정하기 위해 Bonferroni’s method(p-value=0.05/3=0.017)를 이용하여 추세를 탐색하였다.
-
① 이상반응
전체, 중대한 그리고 중도 탈락의 원인이 된 이상반응과 인체적용시험용 제품과 관련 있는 이상반응에 대해 시험대상자 수와 비율을 제시하고, Chi-square test 또는 Fisher’s exact test를 이용하여 군 내 및 군 간 차이에 대한 유의성을 검정하였다. 또한 이들의 중등도, 중대성, 취해진 조치 그리고 결과 등에 대한 발생건수를 제시하였다.
-
② EASI Score, 가려움 증상 평가
가려움 설문 문진을 통해 평가한 가려움 증상에 대해 인체적용시험용 제품 사용 전 Baseline(0일) 대비 종료 시점(6주)의 EASI Score, 가려움 증상 평가 점수 변화치를 산출하고 이에 대한 기술통계량으로 시험 대상자 수, 평균, 표준편차, 중앙값, 최솟값 및 최댓값을 제시하였다. 또한 군 내 및 군 간 차이에 대한 통계적 유의성은 Independet two-sample t-test 또는 Mann-Whitney test, 각 군 내 변화량의 통계적 유의성은 paired t-test 또는 Wilcoxon signed rank test로 검정하였다.
-
③ 활력징후
활력징후는 인체적용시험용 제품 사용 전 Baseline(0일) 대비 종료 시점(6주)의 변화량에 대해 기술통계량으로 시험 대상자 수, 평균, 표준편차, 중앙값, 최솟값 및 최댓값을 제시하고 군 내 및 군 간 차이에 대한 통계적 유의성은 Independent two-sample t-test 또는 Mann- Whitney test, 각 군 내 변화량의 통계적 유의성은 paired t-test 또는 Wilcoxon signed rank test로 검정하였다.
Ⅲ. 결 과
본 인체적용시험에 참가하기로 동의한 대상자 48명 중 스크리닝 검사 결과 탈락자 없이 총 48명이 모두 무 작위배정을 받았다. 무작위배정을 받은 대상자 48명 중 동의 철회/치료거부 1명으로 중도 탈락하여 총 47명이 6주간의 인체적용시험을 종료하였다(Table 3).
인구학적 특성을 포함한 대상자의 기저 특성에 대한 분석은 ITT군을 대상으로 하였다.
시험군과 대조군 간의 무작위배정의 타당성 여부를 확인하기 위해 성별, 선행약물, 연령, 신장, 체중 등의 항목에서 동질성 검정을 한 결과, 성별 분포에 있어서 남성 대상자의 비율은 시험군과 대조군 각각 47.8%와 33.3%이며, 여성 대상자의 비율은 각각 52.2%와 66.7%로 확인되었고, 선행 약물의 경우 선행 약물이 없는 경우의 비율은 시험군과 대조군 각각 82.6%, 87.5%이며, 선행약물이 있는 경우의 비율은 각각 17.4%, 12.5%로, 두 군 간 차이는 통계적으로 유의한 차이가 없었다. 평균 연령은 시험군의 경우 19.13±5.19세, 대조군의 경우 19.25±4.86세, 평균 신장은 시험군의 경우 161.70±14.67㎝, 대조군의 경우 161.59±12.36㎝, 평균 체중은 시험군의 경우 59.54±15.53㎏, 대조군의 경우 60.83±15.95㎏이었으며, 두 군 간 차이는 통계적으로 유의한 차이는 없었다. 이상 모든 항목에서 두 군 간 유의한 차이가 없는 것으로 나타나 무작위배정이 효과적으로 이루어 졌다고 판단하였다(Table 4).
-
① 피부수분 함유량(주관절 1㎝ 아래)
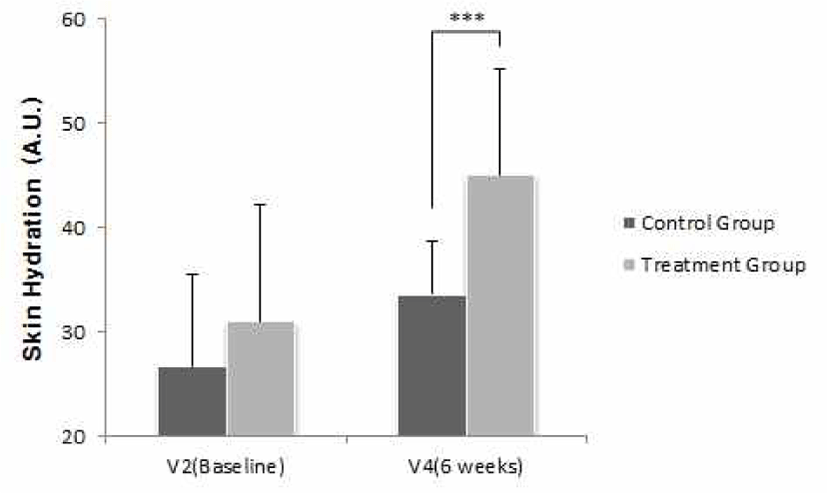
1차 유효성 평가를 위해 시험군 내 V2(Baseline)와 V4(6주) 시점 간 주관절 부위의 피부수분 함유량 차이를 비교 하였다. V2(Baseline) 대비 V4(6주)의 시험군 내 주관절 1㎝ 아래의 피부수분 함유량은 31.088에서 45.100으로 증가(변화량 14.012)하였으며, 군 내 변화량에도 통계적으로 유의한 차이(p<0.05)가 있는 것으로 나타났다(Table 5).
-
② 피부수분 함유량(완관절과 주관절 내측 사이 중앙)
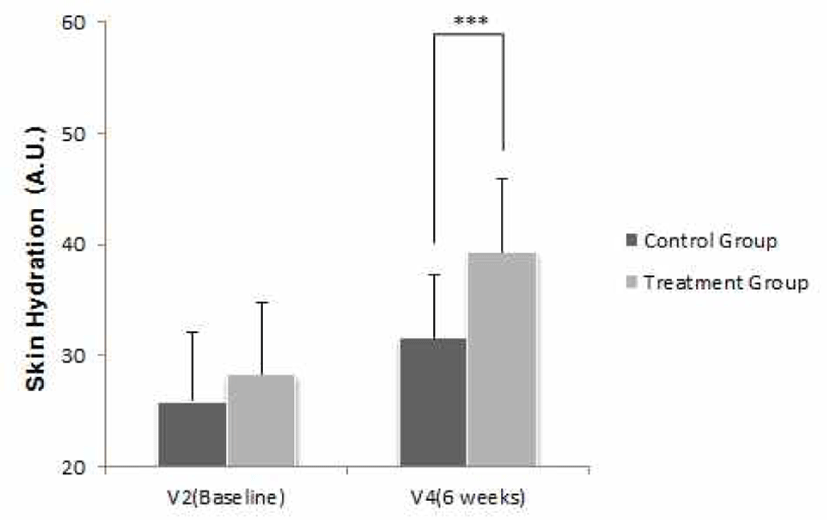
1차 유효성 평가를 위해 시험군 내 V2(Baseline)와 V4(6주) 시점 간 정상 피부 부위의 피부수분 함유량 차이를 비교하였다. V2(Baseline) 대비 V4(6주)의 시험군 내 완관절과 주관절 내측 사이 중앙의 피부수분 함유량은 28.307에서 39.380으로 증가(변화량 11.072)하는 것으로 나타났고, 군 내 변화량은 통계적으로 유의한 차이(p<0.05)가 있는 것으로 나타났다(Table 6).
-
③ 경피수분 손실량(주관절 1㎝ 아래)
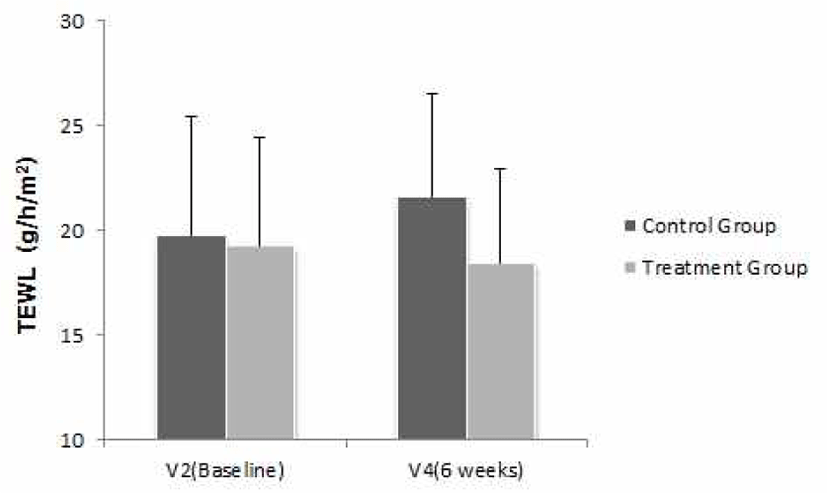
1차 유효성 평가를 위해 시험군 내 V2(Baseline)와 V4(6주) 시점 간 주관절 부위의 경피수분 손실량 차이를 비교하였다. V2(Baseline) 대비 V4(6주)의 시험군 내 주관절 1㎝ 아래의 경피수분 손실량은 19.245에서 18.422로 감소(변화량 −0.823)하는 것으로 나타났지만, 군 내 변화량은 통계적으로 유의한 차이(p>0.05)가 없었다(Table 7).
-
④ 경피수분 손실량(완관절과 주관절 내측 사이 중앙)
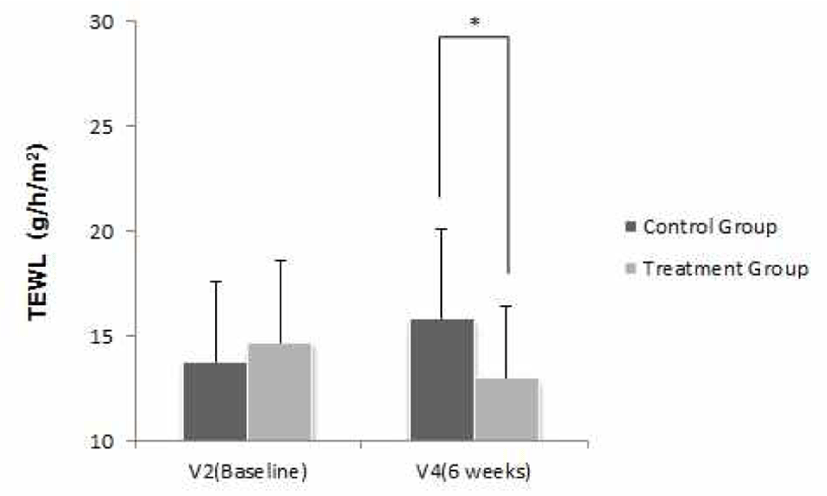
1차 유효성 평가를 위해 시험군 내 V2(Baseline)와 V4(6주) 시점 간 정상 피부 부위의 경피수분 손실량 차이를 비교하였다. V2(Baseline) 대비 V4(6주)의 시험군 내 완관절과 주관절 내측 사이 중앙의 경피수분 손실량은 14.712에서 13.003로 감소(변화량 −1.709)하였으며, 군 내 변화량은 통계적으로 유의한 차이(p<0.05)가 있는 것으로 나타났다(Table 8).
| Descriptives | V2 | V4 | Difference | t or V | p–value |
|---|---|---|---|---|---|
| n | 23 | 23 | 23 | 6.060 | 0.000a |
| Mean±SD | 31.088±11.179 | 45.100±10.089 | 14.012±11.089 | ||
| Median | 29.767 | 46.000 | 11.000 | ||
| Min | 10.333 | 28.167 | −0.066 | ||
| Max | 54.300 | 65.233 | 38.233 |
| Descriptives | V2 | V4 | Difference | t or V | p–value |
|---|---|---|---|---|---|
| n | 23 | 23 | 23 | 5.901 | 0.000a |
| Mean±SD | 28.307±6.470 | 39.380±6.593 | 11.072±8.998 | ||
| Median | 28.633 | 38.367 | 9.233 | ||
| Min | 15.600 | 30.233 | −0.034 | ||
| Max | 38.967 | 58.033 | 32.167 |
| Descriptives | V2 | V4 | Difference | t or V | p–value |
|---|---|---|---|---|---|
| n | 23 | 23 | 23 | 108.5 | 0.378b |
| Mean±SD | 19.245±5.227 | 18.422±4.555 | −0.823±2.992 | ||
| Median | 16.767 | 16.900 | -0.300 | ||
| Min | 11.300 | 9.667 | −9.333 | ||
| Max | 33.267 | 28.767 | 3.400 |
| Descriptives | V2 | V4 | Difference | t or V | p–value |
|---|---|---|---|---|---|
| n | 23 | 23 | 23 | 73 | 0.048b |
| Mean±SD | 14.712±3.866 | 13.003±3.449 | −1.709±4.306 | ||
| Median | 14.000 | 12.767 | −0.966 | ||
| Min | 6.700 | 5.200 | −15.300 | ||
| Max | 26.500 | 20.767 | 5.966 |
-
① V2(Baseline) 대비 V3(3주)의 시험군 내 피부수분 함유량과 경피수분 손실량
2차 유효성 평가를 위해 시험군 내 V2(Baseline)와 V3(3주) 시점 간 피부수분 함유량과 경피수분 손실량 차이를 비교하였다.
주관절 1㎝ 아래의 피부수분 함유량은 31.088에서 37.991로 증가(변화량 6.903)하는 것으로 나타났고, 군 내 변화량은 통계적으로 유의한 차이(p<0.05)가 있는 것으로 나타났다(Table 9). 그리고 완관절과 주관절 내측 사이 중앙의 피부수분 함유량은 28.307에서 32.993으로 증가(변화량 4.686)하였으며, 군 내 변화량은 통계적으로 유의한 차이(p<0.05)가 있는 것으로 나타났다(Table 10).
주관절 1㎝ 아래의 경피수분 손실량은 19.245에서 19.551로 증가(변화량 0.306)하는 것으로 나타났지만, 군 내 변화량은 통계적으로 유의한 차이(p>0.05)가 없었다(Table 11). 이에 반해, 완관절과 주관절 내측 사이 중앙의 경피수분 손실량은 14.712에서 13.587로 감소(변화량 –1.125)하는 것으로 나타났지만, 군 내 변화량은 역시 통계적으로 유의한 차이(p>0.05)가 없었다(Table 12).
-
② V3(3주) 대비 V4(6주)의 시험군 내 피부수분 함유량과 경피수분 손실량
2차 유효성 평가를 위해 시험군 내 V3(3주)와 V4(6주) 시점 간 피부수분 함유량과 경피수분 손실량의 차이를 비교하였다.
주관절 1㎝ 아래의 피부수분 함유량은 37.991에서 45.100으로 증가(변화량 7.109)하는 것으로 나타났고, 군 내 변화량은 통계적으로 유의한 차이(p<0.05)가 있는 것으로 나타났다(Table 13). 그리고 완관절과 주관절 내측 사이 중앙의 피부수분 함유량 역시 32.993에서 39.380으로 증가(변화량 6.387)하는 것으로 나타났고, 군 내 변화량은 통계적으로 유의한 차이(p<0.05)가 있는 것으로 나타났다(Table 14).
주관절 1㎝ 아래의 경피수분 손실량은 19.551에서 18.422로 감소(변화량 –1.129)하는 것으로 나타났고, 군 내 변화량은 통계적으로 유의한 차이(p<0.05)가 있는 것으로 나타났다(Table 15). 반면, 완관절과 주관절 내측 사이 중앙의 경피수분 손실량은 13.587에서 13.003으로 감소(변화량 –0.584)하는 것으로 나타났지만, 군 내 변화량은 통계적으로 유의한 차이(p>0.05)가 없었다(Table 16).
-
③ V2(Baseline) 대비 V4(6주)의 시험군과 대조군의 군 간 피부수분 함유량과 경피수분 손실량
2차 유효성 평가를 위해 V2(Baseline)와 V4(6주)의 시험군과 대조군 간 피부수분 함유량과 경피수분 손실량의 차이를 비교하였다.
주관절 1㎝ 아래의 피부수분 함유량의 경우 V2에서는 대조군이 26.721, 시험군이 31.088로 나타나 군 간 유의한 차이(p>0.05)는 없었으나, V4에서는 대조군이 33.618, 시험군이 45.100 으로 군 간 유의한 차이(p<0.05)가 있는 것으로 나타났으며, 군 간 변화량 역시 유의한 차이 (p<0.05)가 있는 것으로 나타났다(Table 17). 그리고 완관절과 주관절 내측 사이 중앙의 피부 수분 함유량의 경우 V2에서는 대조군이 25.911, 시험군이 28.307로 나타나 군 간 유의한 차이(p>0.05)는 없는 것으로 나타난 반면, V4에서는 대조군이 31.696, 시험군이 39.380으로 군 간 유의한 차이(p<0.05)가 있는 것으로 나타났으며, 군 간 변화량에 있어서도 유의한 차이(p<0.05)가 있었다(Table 18).
주관절 1㎝ 아래의 경피수분 손실량의 경우 V2에서는 대조군이 19.747, 시험군이 19.245로 나타나 군 간 유의한 차이(p>0.05)는 없었으나, V4에서는 대조군이 21.569, 시험군이 18.422로 군 간 유의한 차이(p<0.05)가 있는 것으로 나타났으며, 군 간 변화량에도 유의한 차이(p<0.05)가 있는 것으로 나타났다(Table 19). 그리고 완관절과 주관절 내측 사이 중앙의 경피수분 손실량의 경우 V2에서는 대조군이 13.795, 시험군이 14.712로 나타나 군 간 유의한 차이(p>0.05)가 없었으나, V4에서는 대조군이 15.824, 시험군이 13.003으로 군 간 유의한 차이(p<0.05)가 있는 것으로 나타났으며, 군 간 변화량 역시 유의한 차이(p<0.05)가 있었다(Table 20).
-
④ V2(Baseline) 대비 V3(3주)의 시험군과 대조군의 군 간 피부수분 함유량과 경피수분 손실량 2차 유효성 평가 변수로서 V2(Baseline)와 V3(3주)의 시험군과 대조군 간 피부수분 함유량과 경피수분 손실량의 차이를 비교하였다.
주관절 1㎝ 아래의 피부수분 함유량의 경우 V2에서는 대조군이 26.721, 시험군이 31.088로 나타나 군 간 유의한 차이(p>0.05)는 없는 것으로 나타난 반면, V3에서는 대조군이 32.018, 시험군이 37.991로 군 간 유의한 차이(p<0.05)가 있는 것으로 나타났으나, 군 간 변화량에는 유의한 차이(p>0.05)가 없었다(Table 21). 그리고 완관절과 주관절 내측 사이 중앙의 피부수분 함유량의 경우 V2에서는 대조군이 25.911, 시험군이 28.307로 나타나 군 간 유의한 차이(p>0.05)는 없었으며, V3에서도 대조군이 31.242, 시험군이 32.993으로 군 간 유의한 차이(p>0.05)가 없었고, 군 간 변화량 역시 유의한 차이 (p>0.05)가없는 것으로 나타났다(Table 22).
주관절 1㎝ 아래의 경피수분 손실량의 경우 V2에서는 대조군이 19.747, 시험군이 19.245로 나타나 군 간 유의한 차이(p>0.05)는 없는 것으로 나타났고, V3에서는 대조군이 19.722, 시험군이 19.551로 군 간 유의한 차이(p>0.05)가 없었으며, 군 간 변화량에도 유의한 차이(p>0.05)가 없었다(Table 23). 한편, 완관절과 주관절 내 측 사이 중앙의 경피수분 손실량의 경우 V2에서는 대조군이 13.795, 시험군이 14.712로 나타나 군 간 유의한 차이(p>0.05)는 없는 것으로 나타났고, V3에서도 대조군이 14.633, 시험군이 13.587로 군 간 유의한 차이(p>0.05)가 없었으나, 군 간 변화량은 유의한 차이(p<0.05)가 있는 것으로 나타났다(Table 24).
-
⑤ V3(3주) 대비 V4(6주)의 시험군과 대조군의 군 간 피부수분 함유량과 경피수분 손실량 2차 유효성 평가 변수로서 V3(3주)와 V4(6주)의 시험군과 대조군 간 피부수분 함유량과 경피수분 손실량의 차이를 비교하였다.
주관절 1㎝ 아래의 피부수분 함유량의 경우 V3에서는 대조군이 32.018, 시험군이 37.991로 나타나 군 간 유의한 차이(p<0.05)는 있었고, V4에서도 대조군이 33.618, 시험군이 45.100으로 군 간 유의한 차이(p<0.05)가 있는 것으로 나타났으며, 군 간 변화량에 있어서도 역시 유의한 차이(p<0.05)가 있었다(Table 25). 한편, 완관절과 주관절 내측 사이 중앙의 피부수분 함유량의 경우 V3에서는 대조군이 31.242, 시험군이 32.993로 나타나 군 간 유의한 차이(p>0.05) 는 없었으나, V4에서는 대조군이 31.696, 시험군이 39.380으로 군 간 유의한 차이(p<0.05)가 있는 것으로 나타났으며, 군 간 변화량에도 유의한 차이(p<0.05)가 있었다(Table 26).
주관절 1㎝ 아래의 경피수분 손실량의 경우 V3 에서는 대조군이 19.722, 시험군이 19.551로 나타나 군 간 유의한 차이(p>0.05)는 없는 것으로 나타났으나, V4에서는 대조군이 21.569, 시험군이 18.422로 군 간 유의한 차이(p<0.05)가 있었으며, 군 간 변화량도 유의한 차이(p<0.05) 가 있는 것으로 나타났다(Table 27). 그리고 완관절과 주관절 내측 사이 중앙의 경피수분 손실량의 경우 V3에서는 대조군이 14.633, 시험군이 13.587로 나타나 군 간 유의한 차이(p>0.05)는 없었지만, V4에서는 대조군이 15.824, 시험군이 13.003으로 군 간 유의한 차이(p<0.05)가 있었고, 군 간 변화량은 유의한 차이(p>0.05)가 없는 것으로 나타났다(Table 28).
| Descriptives | V2 | V3 | Difference | t or V | p–value |
|---|---|---|---|---|---|
| n | 23 | 23 | 23 | 3.336 | 0.003a |
| Mean±SD | 31.088±11.179 | 37.991±9.140 | 6.903±9.923 | ||
| Median | 29.767 | 37.100 | 4.867 | ||
| Min | 10.333 | 21.367 | −6.000 | ||
| Max | 54.300 | 60.367 | 33.234 |
| Descriptives | V2 | V3 | Difference | t or V | p–value |
|---|---|---|---|---|---|
| n | 23 | 23 | 23 | 233.5 | 0.004b |
| Mean±SD | 28.307±6.470 | 32.993±5.776 | 4.686±6.992 | ||
| Median | 28.633 | 33.400 | 1.500 | ||
| Min | 15.600 | 23.533 | −6.333 | ||
| Max | 38.967 | 45.267 | 21.234 |
| Descriptives | V2 | V3 | Difference | t or V | p–value |
|---|---|---|---|---|---|
| n | 23 | 23 | 23 | 0.416 | 0.681a |
| Mean±SD | 19.245±5.227 | 19.551±4.296 | 0.306±3.522 | ||
| Median | 16.767 | 18.267 | 0.433 | ||
| Min | 11.300 | 13.667 | −8.466 | ||
| Max | 33.267 | 28.867 | 6.933 |
| Descriptives | V2 | V3 | Difference | t or V | p–value |
|---|---|---|---|---|---|
| n | 23 | 23 | 23 | -1.785 | 0.088a |
| Mean±SD | 14.712±3.866 | 13.587±2.484 | −1.125±3.023 | ||
| Median | 14.000 | 14.267 | −0.867 | ||
| Min | 6.700 | 8.500 | −10.000 | ||
| Max | 26.500 | 17.633 | 3.667 |
| Descriptives | V3 | V4 | Difference | t or V | p–value |
|---|---|---|---|---|---|
| n | 23 | 23 | 23 | 270 | 0.000b |
| Mean±SD | 37.991±9.140 | 45.100±10.089 | 7.109±7.771 | ||
| Median | 37.100 | 46.000 | 4.866 | ||
| Min | 21.367 | 28.167 | −3.633 | ||
| Max | 60.367 | 65.233 | 33.466 |
| Descriptives | V3 | V4 | Difference | t or V | p–value |
|---|---|---|---|---|---|
| n | 23 | 23 | 23 | 272 | 0.000b |
| Mean±SD | 32.993±5.776 | 39.380±6.593 | 6.387±6.098 | ||
| Median | 33.400 | 38.367 | 4.500 | ||
| Min | 23.533 | 30.233 | −1.434 | ||
| Max | 45.267 | 58.033 | 27.766 |
| Descriptives | V3 | V4 | Difference | t or V | p–value |
|---|---|---|---|---|---|
| n | 23 | 23 | 23 | 41 | 0.010b |
| Mean±SD | 19.551±4.296 | 18.422±4.555 | −1.129±2.900 | ||
| Median | 18.267 | 16.900 | −0.533 | ||
| Min | 13.667 | 9.667 | −8.400 | ||
| Max | 28.867 | 28.767 | 6.334 |
| Descriptives | V3 | V4 | Difference | t or V | p–value |
|---|---|---|---|---|---|
| n | 23 | 23 | 23 | -0.842 | 0.409a |
| Mean±SD | 13.587±2.484 | 13.003±3.449 | −0.584±3.325 | ||
| Median | 14.267 | 12.767 | −0.500 | ||
| Min | 8.500 | 5.200 | −6.234 | ||
| Max | 17.633 | 20.767 | 6.634 |
-
① 피부수분 함유량(주관절 1㎝ 아래)
반복측정 분산분석(Repeated Measure ANOVA) 결과, 군과 방문 시점 간의 상호작용 효과는 유의하게 나타나(F=4.034, p=0.021), 군 간 방문 시 점에 따른 피부수분 함유량(주관절 1㎝ 아래)의 변화는 유의한 차이가 있었다. V2(Baseline), V3(3주), V4(6주)에 피부수분 함유량을 측정한 결과, 대조군은 각각 26.721, 32.018, 33.618이었고, 시험군은 각각 31.088, 37.991, 45.100인 것으로 나타났다. 또한 방문 시점에 따른 군 간 비교를 위해 Bonferroni's method (유의수준을 0.05/3=0.017로 보정)를 적용하여 사후검정을 진행한 결과, V3(3주)와 V4(6주)에 서 유의한 차이(p<0.017)가 있었다(Table 29, Fig. 1).
-
② 피부수분 함유량(완관절과 주관절 내측 사이 중앙)
반복측정 분산분석(Repeated Measure ANOVA) 결과, 군과 방문 시점 간의 상호작용 효과는 유의하게 나타나(F=5.515, p=0.008), 군 간 방문 시점에 따른 피부수분 함유량(완관절과 주관절 내측 사이 중앙)의 변화는 유의한 차이가 있었다. V2(Baseline), V3(3주), V4(6주)에 피부수분 함유량을 측정한 결과, 대조군은 각각 25.911, 31.242, 31.696이었고, 시험군은 각각 28.307, 32.993, 39.380인 것으로 나타났다. 또한 방문 시점에 따른 군 간 비교를 위해 Bonferroni's method(유의수준을 0.05/3= 0.017로 보정)를 적용하여 사후검정을 진행한 결과, V4(6주)에서 유의한 차이(p<0.017)가 있었다(Table 30, Fig. 2).
-
③ 경피수분 손실량(주관절 1㎝ 아래)
반복측정 분산분석(Repeated Measure ANOVA) 결과, 군과 방문 시점 간의 상호작용 효과는 유의하게 나타나(F=4.772, p=0.011), 군 간 방문 시점에 따른 경피수분 손실량(주관절 1㎝ 아래)의 변화는 유의한 차이가 있었다. V2(Baseline), V3(3주), V4(6주)에 경피수분 손실량을 측정한 결과, 대조군은 각각 19.747, 19.722, 21.569였고, 시험군은 각각 19.245, 19.551, 18.422인 것으로 나타났다. 또한 방문 시점에 따른 군 간 비교를 위해 Bonferroni's method(유의수준을 0.05/3=0.017로 보정)를 적용하여 사후검정을 진행한 결과, 유의한 차이(p>0.017)가 없는 것으로 나타났다(Table 31, Fig. 3).
-
④ 경피수분 손실량(완관절과 주관절 내측 사이 중앙)
반복측정 분산분석(Repeated Measure ANOVA) 결과, 군과 방문 시점 간의 상호작용 효과는 유의하게 나타나(F=6.666, p=0.004), 군 간 방문 시점에 따른 경피수분 손실량(완관절과 주관절 내측 사이 중앙)의 변화는 유의한 차이가 있었다. V2(Baseline), V3(3주), V4(6주)에 경피수분 손실량을 측정한 결과, 대조군은 각각 13.795, 14.633, 15.824였고, 시험군은 각각 14.712, 13.587, 13.003인 것으로 나타났다. 또한 방문 시점에 따른 군 간 비교를 위해 Bonferroni's method(유의수준을 0.05/3= 0.017로 보정)를 적용하여 사후검정을 진행한 결과, V4(6주)에서 유의한 차이(p<0.017)가 있었다(Table 32, Fig. 4).
안전성 평가를 위해 이상반응 발현 유무를 확인한 결과, 시험군의 경우 7명(30.4%)의 대상자에게 총 8건, 대조군의 경우 2명(8.3%)의 대상자에게 총 3건이 발생하였다. 이상반응 발현에 대한 군 간 차이는 통계적으로 유의한 차이가 없었으며, 시험 기간 동안 이상약물반응이나 중대한 이상반응은 보고되지 않았다(Table 33). 시험군과 대조군에서 발생한 이상반응은 아토피 피부염과 상관없는 일상생활에서 발생할 수 있는 질환으로 경항통 1건, 질염 2건, 결막염 1건, 부비동염 1건, 맥립종 1건, 발목 염좌 1건, 생리통 1건, 요통 1건, 빈혈 1건, 장염 1건이었다. 11건의 이상반응은 모두 경증이었으며, 치료 약물 병용 투여를 통해 모두 후유증 없이 회복되었다.
| Adverse Events | Control Group (n=24) | Treatment Group (n=23) | p–value | |
|---|---|---|---|---|
| V3 | No | 23(95.8%) | 18(78.3%) | 0.097b |
| Yes | 1(4.2%) | 5(21.7%) | ||
| V4 | No | 22(91.7%) | 20(87.0%) | 0.666b |
| Yes | 2(8.3%) | 3(13.0%) |
EASI Score 분석 결과 대조군은 통계적으로 유의하게 증가한 반면 시험군에서는 통계적으로 유의하게 감소하였는데 이는 각 군 내에서의 변화이며, 군 간 비교에서는 통계적으로 유의한 차이를 보이지 않았다(Table 34).
| EASI Score | V2 | V4 | p–value |
|---|---|---|---|
| Control Group | 5.213 ± 3.239 | 5.383 ± 3.540 | 0.043b |
| Treatment Group | 4.961 ± 3.507 | 4.174 ± 2.971 | 0.005a |
| p–value | 0.782d | 0.176d |
가려움 증상, 가려움 횟수, 가려움 지속 시간의 분석 결과 통계적으로 유의한 차이가 관찰되지 않았다(Table 35-37).
| itching Symptoms | Control Group (n=24) | Treatment Group (n=23) | p–value | |
|---|---|---|---|---|
| V2 | No | - | - | - |
| Yes | 24(100.0%) | 23(100.0%) | ||
| V3 | No | - | - | - |
| Yes | 24(100.0%) | 23(100.0%) | ||
| V4 | No | - | - | - |
| Yes | 24(100.0%) | 23(100.0%) |
활력 징후 분석 결과 대조군의 경우 혈압(이완기), 시험군의 경우 혈압(이완기)과 맥박에서 시험 전후의 수치에 있어 통계적으로 유의한 군 내 차이가 발견되었으나 모두 정상 범위 내에서의 변화로 군 간 통계적으로 유의한 차이는 없었다. 이 외에 각 군 내 및 군 간 비교에 있어 통계적으로 유의한 차이가 관찰된 활력 징후 항목은 없었다(Table 38-41).
| Systolic Blood Pressure | V2 | V4 | p–value |
|---|---|---|---|
| Control Group | 118.333 ± 11.189 | 116.083 ± 12.741 | 0.371a |
| Treatment Group | 114.696 ± 11.439 | 113.130 ± 12.278 | 0.754b |
| p–value | 0.276c | 0.423c |
| Diastolic Blood Pressure | V2 | V4 | p–value |
|---|---|---|---|
| Control Group | 76.042 ± 7.915 | 71.125 ± 10.195 | 0.021a |
| Treatment Group | 75.087 ± 10.131 | 70.478 ± 9.278 | 0.016a |
| p–value | 0.720c | 0.821c |
| Pulse | V2 | V4 | p–value |
|---|---|---|---|
| Control Group | 87.958 ± 10.925 | 90.625 ± 9.338 | 0.146a |
| Treatment Group | 83.783 ± 10.673 | 89.304 ± 10.350 | 0.020a |
| p–value | 0.134d | 0.730d |
| Body Temperature | V2 | V4 | p–value |
|---|---|---|---|
| Control Group | 36.633 ± 0.383 | 36.650 ± 0.335 | 0.838a |
| Treatment Group | 36.530 ± 0.464 | 38.848 ± 10.456 | 0.172b |
| p–value | 0.422d | 0.781d |
Ⅳ. 고 찰
아토피 피부염(Atopic dermatitis)은 유아와 소아기에 주로 발생하며 성인까지 광범위한 연령층에 나타나는 만성 재발성 피부염으로 원인은 불명확하지만, 유전 인자와 환경 인자가 발병에 관여하는 면역성 질환으로 알려져 있다5). 국외의 아토피 피부염 빈도는 1960년 이전에는 2-3%로 적은 수치였으나 1970년 이후 9-12% 가량으로 급증하였고, 국내에서의 아토피 피부염 진단 빈도 또한 2000년대 이전과 이후를 비교해 보았을 때 초등학생의 12-14%에서 24.9%, 중학생의 6-8%에서 12.8%로 점점 증가하는 추세에 있으며, 이러한 현상은 산업화, 도시화, 실내외 공해에 의한 알레르겐 노출 기회의 증가 등 서구화된 생활방식 및 환경적 요인들의 영향이 복합적으로 작용한 결과로 볼 수 있다5).
아토피 피부염의 특징적인 임상 양상은 피부 건조로 인한 소양증이 가장 흔하며, 특히 밤에 심해져 수면장애를 일으킬 수 있다24). 급성 병변은 소양증이 심한 홍반, 구진 및 수포가 나타나며 병변을 긁으면 삼출과 미란 및 이차감염이 쉬워지는 단계이며, 아급성기에는 소파흔, 홍반 혹은 인설을 동반한 구진 및 판이 발생하고, 만성기에는 반복적으로 긁은 결과 태선화가 생기고 결절성 양진 및 발진 등이 관찰될 수 있다24). 모든 단계에서의 아토피 피부염 환자의 병변 양상은 윤기 없고 건조한 피부 상태를 보인다고 할 수 있다.
아토피 피부염은 호전과 악화를 반복하는 질환으로, 특히 소양증은 피부 건조의 정도가 심할수록 악화되므로 피수 보습 관리 및 피부 장벽 보호를 위한 다양 하고 체계적인 접근을 통해 병변의 악화 및 재발을 방지하는 것이 치료 목표이며, 이를 위하여 보습제나 외용제 도포, 악화인자의 분석 및 제거 등의 대증 요법과 더불어 항히스타민제, 부신피질 호르몬제, 항생제, 항진균제, 항바이러스제의 경구 투여 및 광선 치료, 면역조절제 등을 병행할 수 있다24). 또한 병변이 지속 또는 자주 재발하는 경우 스테로이드 외용제의 간헐적 사용 등 유지 요법을 시행할 수 있다24).
아토피 피부염과 유사한 한의학적 병명으로는 奶癬, 胎斂瘡, 胎熱, 胎癬, 濕瘡 등이 있다6). 病因 病理는 체질적으로 稟賦不耐하여 內로 脾胃가 運化機能을 잃어 胎火濕熱이 있는 바탕에 濕熱內鬱, 飮食不節, 外死侵襲 등이 원인이 되어 外로 風濕熱이 침입하여 相搏하면 肌膚에 鬱滯되어 아토피 피부염이 발생한다고 하였으며, 이외에도 소화불량, 불규칙적인 수유습관, 음식물에 대한 과민반응, 의복마찰, 寒冷 등의 자극으로 인하여도 유발될 수 있다고 하였다8,25). 이에 따른 치료로 급성기에는 淸熱利濕의 치법, 아급성기에는 建脾除濕의 치법을 쓰고, 만성기에는 滋陰養血潤燥의 치법을 사용한다25). 또한 유아기에는 脾胃氣虛한 체질적인 소인과 濕熱邪氣의 감수로 補氣補血하면서 淸熱解毒하는 치료를 위주로 하고, 성인형으로 진행됨에 따라 건성과 습성으로 나누어 散風, 淸熱, 利濕 등의 치법을 운용하는 것이 도움이 된다고 하였다25). 즉, 아토피 피부염에 대한 치료로 淸熱利濕解毒 등의 염증을 가라앉히는 치료와 더불어 滋陰潤燥나 補血 등으로 건조한 피부 상태를 개선시키는 것을 중요시한다고 볼 수 있다.
이에 따라 현재 아토피 피부염 환자의 피부 건조 상태를 개선시키기 위한 방법으로서 한약제재나 천연물 자원 및 생리활성물질을 이용한 제품의 경구 투여 및 한방 외용제 도포 등과 관련된 임상연구가 다양하게 진행되고 있다. 그러나 최근 아토피 피부염으로 인한 피부 건조 증상을 개선하기 위한 환자들의 인식이 적극적 약물 치료에서 예방적 일상 관리로 변화함에 따라 아토피성 피부 건조를 개선하기 위한 항산화, 피부장벽기능 보호 및 보습용 기능성 화장품의 시장 규모가 급증하고 있는 것에 비해 이와 관련된 임상연구는 상대적으로 부족한 실정이다. 이러한 현상의 이유는 그 동안 관련 법규의 부재와 관련 업계의 인식차이로 인해 임상연구를 통해 기능성 및 안전성이 입증되고 식품의약품안전처로부터 효능을 인정받은 사례가 거의 없기 때문이나, 2017년 1월 화장품법 시행규칙 개정을 통해 기능성 화장품 범위에 기존에 포함되지 않았던 아토피성 피부 보습이 포함되었고 2017년 5월 30일부터 해당 법규가 시행되면서 아토피성 피부로 인한 건조함 등을 완화하는데 도움을 주는 기능성 화장품 개발을 위한 다양한 임상연구가 진행되고 있다.
또한 아토피 피부염 환자의 대다수를 차지하는 유아 및 소아의 경우에는 복용 상의 불편함이나 한약 특유의 진한 맛과 향으로 복용을 거부하는 경우가 많아8), 최근에는 비교적 한약추출물을 활용한 아토피성 피부 건조 개선용 한방 보습제의 개발에 대한 관심이 증가하고 있다. 이러한 현실 인식으로 아토피 피부염 환자에 대한 예방적 치료로서 기능성 한방 화장품을 도포하여 피부 장벽을 보호하고 건조한 피부 상태를 개선시키려는 임상연구6-8)가 활발하게 진행되고 있으며, 본 연구 또한 아토피성 피부로 건조함을 가진 대상자에 대하여 환삼덩굴추출물 함유 기능성 화장품의 유효성 및 안전성을 평가하고자 하였다.
본 인체적용시험에 사용된 환삼덩굴추출물의 원재료인 율초(葎草, Humulus japonicus)는 삼과(Cannabinaceae)에 속한 1년생 혹은 다년생 덩굴식물인 환삼덩굴 혹은 한삼덩굴이라 불리는 식물의 전초로 7~8월에 담황색의 꽃이 피며 여름 및 가을에 채취하여 햇볕에 말린 덩굴성 한해살이풀로서, 한국, 일본, 대만, 중국 등에서 쉽게 구할 수 있으나 한방에서의 활용 빈도는 높지 않은 편이다13,14,26).
율초는 外瘍과 陽毒의 外敷에 사용되는 약재로14), 梁代 陶弘景의 《名醫別錄》 에 勒草라는 명칭으로 최초 수록되었으며27), 이후 《新修本草》 에서부터 율초로 불리기 시작하였다22). 《東醫寶鑑》 에서는 “性寒, 味甘, 無毒. 主五淋, 止水痢, 除瘧, 主癩瘡.” 이라 하여 性味는 微苦甘寒無毒하고 肝肺大腸膀胱經에 入하여 淸熱利尿, 消瘀解毒, 消炎退熱, 建胃, 潤五臟, 消五穀하는 효능으로 五淋을 치료하여 소변을 잘 나오게 하며 水痢를 그치게 하고 瘧疾을 낫게 하며 나병으로 생긴 부스럼 및 피부 발진 등을 치료한다고 하였다14,16,26).
율초는 全草에 luteolin, glucoside, choline, asparamide 등을 함유하며 β-humulene, α-copaene, caryophyllene, α-selinene, β-selinene, γ-cadinene 등의 정유 성분을 함유하여 항균 및 이뇨작용 등의 약리작용을 한다고 알려져 있으며15,22), 이에 따라 임 등16)은 rat 실험을 통해 율초의 진통, 소염, 이뇨 작용에 유의한 효과가 있음을 보고하였고, 황 등28)은 율초 추출물의 항염 효과에 관한 기전을 밝혀 rat의 paw edema를 감소시키는 등 항염, 이뇨 효과를 입증하였으며, 문22) 또한 항염, 이뇨 작용을 통해 율초의 신장염에 대한 효능을 rat 실험을 통해 보고하였다. 이외에도 홍 등29)이 율초 추출물의 항결핵 효과를 입증하였으며, 이 등30)은 율초 추출물의 in vitro 항산화 및 항암 활성 효과를 보고하였고, 박 등20)이 율초 추출물로부터 분리한 Luteolin glucoside 성분의 활성산소 소거능을 입증하는 등 율초 추출물에 대한 염증성 질환의 유효성과 관련된 다양한 연구들이 진행되고 있다. 상기 연구들을 통해 율초의 염증 질환에 대한 항염, 이뇨, 해독 등의 효능이 입증된 바 이에 저자는 환삼덩굴추출물 함유 기능성 화장품이 아토피 피부염으로 인한 피부의 건조 증상을 완화하고 손상된 피부장벽기능을 회복하는데 효과가 있는지 알아보고자 하였다.
본 연구는 아토피성 피부로 건조함을 가진 대상자에서 환삼덩굴추출물 함유 기능성 화장품의 유효성과 안전성을 평가하기 위한 단일기관, 무작위배정, 이중눈가림, 보습화장품 대조 인체적용시험으로 설계되었다. 무작위배정 후 환삼덩굴추출물 함유 기능성 화장품 또는 보습화장품을 총 48명의 연구대상자에게 하루 3회씩 6주간 사용하도록 하였다.
무작위배정을 받은 대상자 48명 중 중도탈락 1명(치료거부/동의철회 1명)이 제외되어 최종 47명이 계획서에 따라 인체적용시험을 종료하였다. Safety군 대상자 중 주 평가 변수 자료가 무작위배정 이후 한 번도 수집되지 않은 대상자 1명(시험군 1명)을 제외한 총 47명을 분석하였다. 이중 시험군은 23명, 대조군은 24명이었고, 시험대상자의 평균 연령은 시험군의 경우 19.13±5.19세, 대조군의 경우 19.25±4.86세였으며, 성별, 선행약물, 신장, 체중 등에서 통계적인 차이가 없어 무작위배정이 효과적으로 이루어졌다고 판단하였다.
아토피 피부염과 같이 피부의 면역 과민반응 상태에서는 각질층의 수분 함유량이 감소하고 경피수분 손실량이 증가한다. 따라서 본 연구의 1차 기능성 평가 변수는 피부의 기기적 평가를 통해 인체적용시험용 제품 사용 전(V2) 대비 사용 6주 후(V4) 시점에서의 시험군 내 피부수분 함유량과 경피수분 손실량의 변화치가 통계적으로 유의한 차이가 있는지를 입증하는 것이었다. 측정 부위는 아토피 피부염의 피부 병변이 잘 발생하는 주관절 부위(주관절 1㎝ 아래)와 정상 피부(완관절과 주관절 내측 사이 중앙 부위) 2군데를 선택하였고, 객관적 결과를 얻기 위하여 연구자 1인이 5회 측정 후 최댓값과 최솟값을 제외한 3개 측정치의 평균값을 사용하였다. 피부수분 함유량과 경피수분 손실량은 객관적 측정을 위해 항온항습시설이 갖추어진 피부진단실에서 실시하였으며, 실내온도는 20-25°C, 실내습도는 40-60%로 설정하였다.
V2 대비 V4의 시험군 내 주관절 1㎝ 아래의 피부수분 함유량은 31.088에서 45.100으로 증가하였고, 군 내 변화량은 통계적으로 유의한 차이(p<0.05)가 있었다. 또한 완관절과 주관절 내측 사이 중앙의 피부수분 함유량 역시 28.307에서 39.380으로 증가하였고, 군 내 변화량에도 통계적으로 유의한 차이(p<0.05)가 있었다.
V2 대비 V4의 시험군 내 주관절 1㎝ 아래의 경피수분 손실량은 19.245에서 18.422로 감소했지만, 군 내 변화량은 통계적으로 유의한 차이(p>0.05)가 없었다. 그러나 완관절과 주관절 내측 사이 중앙의 경피수분 손실량은 14.712에서 13.003로 감소하였으며, 군 내 변화량도 통계적으로 유의한 차이(p<0.05)가 있었다. 즉, 시험제품인 환삼덩굴추출물 함유 기능성 화장품은 통계적으로 유의하게 피부수분 함유량을 증가시키고 경피수분 손실량을 감소시켜 아토피성 피부로 건조함을 가진 대상자의 피부 건조 상태를 개선시켰다고 볼 수 있다.
본 연구의 2차 기능성 평가 변수로 피부수분 함유량과 경피수분 손실량의 변화에 대한 시험 기간 내(V2 대비 V3, V3 대비 V4) 시험군 내의 시점 간 비교와 시험군과 대조군의 군 간 변화에 대해 유의한 차이가 있는지를 살펴보았다.
우선 V2 대비 V3의 시험군 내 피부수분 함유량과 경피수분 손실량 변화를 살펴보면, 주관절 1㎝ 아래의 피부수분 함유량은 31.088에서 37.991로 증가하였고, 완관절과 주관절 내측 사이 중앙의 피부수분 함유량은 28.307에서 32.993으로 증가하였으며, 두 부위 모두 군 내 변화량은 통계적으로 유의한 차이(p<0.05)가 있었다. 주관절 1㎝ 아래와 완관절과 주관절 내측 사이 중앙의 경피수분 손실량은 두 부위 모두 군 내 변화량에서 통계적으로 유의한 차이(p>0.05)가 없었다.
다음으로 V3 대비 V4의 시험군 내 피부수분 함유량과 경피수분 손실량 변화를 살펴보면, 주관절 1㎝ 아래의 피부수분 함유량은 37.991에서 45.100으로 증가하였고, 완관절과 주관절 내측 사이 중앙의 피부수분 함유량은 32.993에서 39.380으로 증가하였으며, 두 부위 모두 군 내 변화량은 통계적으로 유의한 차이(p<0.05)가 있었다. 주관절 1㎝ 아래의 경피수분 손실량은 19.551에서 18.422로 감소하였고, 군 내 변화량은 통계적으로 유의한 차이(p<0.05)가 있었으나, 완관절과 주관절 내측 사이 중앙의 경피수분 손실량의 군 내 변화량은 통계적으로 유의한 차이(p>0.05)가 없었다.
또한 V2 대비 V4의 시험군과 대조군의 군 간 피부수분 함유량과 경피수분 손실량의 변화치를 살펴보면, 주관절 1㎝ 아래의 피부수분 함유량은 V2에서 군 간 유의한 차이(p>0.05)는 없었으나, V4에서는 대조군이 33.618, 시험군이 45.100으로 군 간 유의한 차이(p<0.05)가 있었고, 군 간 변화량 또한 유의한 차이(p<0.05)가 있었다. 완관절과 주관절 내측 사이 중앙의 피부수분 함유량은 V2에서 군 간 유의한 차이(p>0.05)는 없었으나, V4에서는 대조군이 31.696, 시험군이 39.380으로 군 간 유의한 차이(p<0.05)가 있었고, 군 간 변화량 또한 유의한 차이(p<0.05)가 있었다. 주관절 1㎝ 아래의 경피수분 손실량은 V2에서 군 간 유의한 차이(p>0.05)는 없었으나, V4에서는 대조군이 21.569, 시험군이 18.422로 군 간 유의한 차이(p<0.05)가 있었고, 군 간 변화량 또한 유의한 차이(p<0.05)가 있었다. 완관절과 주관절 내측 사이 중앙의 경피수분 손실량은 V2에서 군 간 유의한 차이(p>0.05)는 없었지만, V4에서는 대조군이 15.824, 시험군이 13.003으로 군 간 유의한 차이(p<0.05)가 있었고, 군 간 변화량 또한 유의한 차이(p<0.05)가 있었다.
다음으로 V2 대비 V3의 시험군과 대조군의 군 간 피부수분 함유량과 경피수분 손실량의 변화치를 살펴보면, 주관절 1㎝ 아래의 피부수분 함유량은 V2에서 군 간 유의한 차이(p>0.05)는 없었으나, V3에서는 대조군이 32.018, 시험군이 37.991로 군 간 유의한 차이(p<0.05)가 있었고, 군 간 변화량에는 유의한 차이(p>0.05)가 없었다. 완관절과 주관절 내측 사이 중앙의 피부수분 함유량은 V2 및 V3에서 군 간 유의한 차이(p>0.05)가 없었으며, 군 간 변화량에도 유의한 차이(p>0.05)가 없었다. 주관절 1㎝ 아래의 경피수분 손실량은 V2 및 V3에서 군 간 유의한 차이(p>0.05)가 없었으며, 군 간 변화량에도 유의한 차이(p>0.05)가 없었다. 완관절과 주관절 내측 사이 중앙의 경피수분 손실량은 V2 및 V3에서 군 간 유의한 차이(p>0.05)가 없었으나, 군 간 변화량에는 유의한 차이(p<0.05)가 있었다.
마지막으로 V3 대비 V4의 시험군과 대조군의 군 간 피부수분 함유량과 경피수분 손실량의 변화치를 살펴보면, 주관절 1㎝ 아래의 피부수분 함유량은 V3에서 대조군이 32.018, 시험군이 37.991로 나타나 군 간 유의한 차이(p<0.05)가 있었고, V4에서는 대조군이 33.618, 시험군이 45.100으로 군 간 유의한 차이(p<0.05)가 있었으며, 군 간 변화량 또한 유의한 차이(p<0.05)가 있었다. 완관절과 주관절 내측 사이 중앙의 피부수분 함유량은 V3에서 군 간 유의한 차이(p>0.05)가 없었으나, V4에서는 대조군이 31.696, 시험군이 39.380으로 군 간 유의한 차이(p<0.05)가 있었고, 군 간 변화량 또한 유의한 차이(p<0.05)가 있었다. 주관절 1㎝ 아래의 경피수분 손실량은 V3에서 군 간 유의한 차이(p>0.05)는 없었으나, V4에서는 대조군이 21.569, 시험군이 18.422로 군 간 유의한 차이(p<0.05)가 있었고, 군 간 변화량 또한 유의한 차이(p<0.05)가 있었다. 그리고 완관절과 주관절 내측 사이 중앙의 경피수분 손실량은 V3에서 군 간 유의한 차이(p>0.05)는 없었고, V4에서는 대조군이 15.824, 시험군이 13.003으로 군 간 유의한 차이(p<0.05)가 있었으나, 군 간 변화량은 유의한 차이(p>0.05)가 없었다.
추가 분석으로 주관절 1㎝ 아래의 피부수분 함유량에서 반복측정 분산분석 결과, 군과 방문 시점 간의 상호작용 효과는 유의하게 나타났으며(F=4.034, p=0.021), 군 간 방문 시점에 따른 피부수분 함유량의 변화는 대조군에서 V2, V3, V4 순으로 26.721, 32.018, 33.618, 시험군에서 31.088, 37.991, 45.100로 유의한 차이가 있었다. 또한 방문 시점에 따른 군 간 비교를 위해 Bonferroni's method(유의수준을 0.05/3=0.017로 보정)를 적용하여 사후검정을 진행한 결과, V3과 V4에서 유의한 차이(p<0.017)가 있었다.
완관절과 주관절 내측 사이 중앙의 피부수분 함유량에서 반복측정 분산분석 결과, 군과 방문 시점 간의 상호작용 효과는 유의하게 나타났으며(F=5.515, p=0.008), 군 간 방문 시점에 따른 피부수분 함유량의 변화는 대조군에서 V2, V3, V4 순으로 25.911, 31.242, 31.696이었고, 시험군에서 28.307, 32.993, 39.380로 유의한 차이가 있었다. 또한 방문 시점에 따른 군 간 비교를 위해 Bonferroni's metho(유의수준을 0.05/3=0.017로 보정)를 적용하여 사후검정을 진행한 결과, V4에서 유의한 차이(p<0.017)가 있었다.
주관절 1㎝ 아래의 경피수분 손실량의 반복측정 분산분석 결과, 군과 방문 시점 간의 상호작용 효과는 유의하게 나타났으며(F=4.772, p=0.011), 군 간 방문 시점에 따른 경피수분 손실량의 변화는 대조군에서 V2, V3, V4 순으로 19.747, 19.722, 21.569였고, 시험군에서 19.245, 19.551, 18.422로 유의한 차이가 있었다. 또한 방문 시점에 따른 군 간 비교를 위해 Bonferroni's method(유의수준을 0.05/3=0.017로 보정)를 적용하여 사후검정을 진행한 결과, 유의한 차이(p>0.017)가 없었다.
완관절과 주관절 내측 사이 중앙의 경피수분 손실량의 반복측정 분산분석 결과, 군과 방문 시점 간의 상호작용 효과는 유의하게 나타났으며(F=6.666, p=0.004), 군 간 방문 시점에 따른 경피수분 손실량의 변화는 대조군에서 V2, V3, V4 순으로 13.795, 14.633, 15.824였고, 시험군에서는 14.712, 13.587, 13.003로 유의한 차이가 있었다. 또한 방문 시점에 따른 군 간 비교를 위해 Bonferroni's method(유의수준을 0.05/3=0.017로 보정)를 적용하여 사후검정을 진행한 결과, V4에서 유의한 차이(p<0.017)가 있었다.
안전성과 관련하여 이상반응은 시험군의 경우 7명(30.4%)의 대상자에게 총 8건, 대조군의 경우 2명(8.3%)의 대상자에게 총 3건이 발생하였다. 이상반응 발현에 대한 군 간 차이는 통계적으로 유의한 차이가 없었고, 시험 기간 동안 이상약물반응이나 중대한 이상반응은 보고되지 않았다. 시험군과 대조군에서 발생한 모든 이상반응은 아토피 피부염과 상관없는 일상생활에서 발생할 수 있는 질환으로 본 인체적용시험 제품과의 관련성은 없었고, 모두 경증으로 치료 약물 병용 투여 후 후유증 없이 회복되었다.
EASI Score(Eczema Area and Severity Index)는 아토피 피부염의 심한 정도를 평가하는 대표적인 지표 중 하나로, 머리/목, 팔, 몸통, 다리 등 신체의 4부위에서 아토피 피부염 병변의 면적과 증상(홍반, 구진, 찰상, 태선화)을 객관적으로 평가하여 점수화하는 체계이다. 본 연구에서는 안전성 평가 지표로 시험 전후 EASI Score의 변화를 측정하였다. 측정 결과 대조군에서 EASI Score가 통계적으로 유의하게 증가하였고, 시험군에서도 통계적으로 유의하게 감소하였지만, 군 간 비교에서는 통계적으로 유의한 차이가 없었다.
또한 시험 기간 동안 가려움 증상 평가 점수 변화를 측정하여 증상의 악화 여부를 평가한 결과, 시험군과 대조군 모두 가려움 증상, 가려움 횟수, 가려움 지속 시간에서 통계적으로 유의한 차이가 없었다.
시험 기간 동안 시험군과 대조군의 활력징후를 분석한 결과, 대조군의 경우 이완기 혈압, 시험군의 경우 이완기 혈압과 맥박에서 통계적으로 유의한 차이가 관찰되었으나, 군 내에서의 변화이며 정상범위 이내의 변화로 임상적 의미가 없는 것으로 판단되었다. 이 외에 각 군 내 및 군 간 비교에 있어 통계적으로 유의한 차이가 관찰된 활력징후 항목은 없었다.
본 연구는 아토피성 피부로 건조함을 가진 대상자에서 아토피성 피부 건조 개선용으로 개발된 환삼덩굴추출물 함유 기능성 화장품의 유효성과 안전성에 대한 단일기관, 무작위배정, 이중눈가림, 보습화장품 대조 인체적용시험으로 경증의 아토피 피부염 환자에게 시험제품을 1일 3회씩 6주간 사용하도록 하였다.
1차 유효성 평가 변수인 시험군에서의 피부수분 함유량을 통계적으로 유의하게 증가시키고 경피수분 손실량을 감소시키는 고무적인 결과를 얻었으며, 또한 안전성 평가에서도 특이 사항이 관찰되지 않아 안전한 제품임을 확인할 수 있었다. 이러한 결과는 환삼덩굴추출물 함유 기능성 화장품이 아토피성 피부로 건조함을 가진 대상자의 손상된 피부 장벽 보호 및 피부 보습에 도움을 줄 수 있는 제품이라고 볼 수 있다. 하지만 본 연구의 시험제품에는 환삼덩굴추출물 이외 아로마 오일 등 다양한 성분들이 함유되어 있어 환삼덩굴추출물만의 효과를 평가하기 어려운 점, 식품의약품안전처의 가이드라인에 따라 시중에 유통 중인 제품을 대조제품으로 선정하면서 시험제품의 주성분을 제외한 나머지 성분들을 모두 일치시키지 못한 점 등을 한계로 들 수 있다. 향후 이런 한계점들을 개선할 수 있는 추가적인 연구가 필요하다고 생각되며, 나아가 본 연구가 한방 외용제나 기능성 화장품 관련 다양한 임상연구의 기초 자료로 활용되기를 기대한다.
Ⅴ. 결 론
본 임상연구는 아토피성 피부로 건조함을 가진 대상자에게 환삼덩굴추출물 함유 기능성 화장품을 사용했을 때 아토피성 피부 건조 증상 개선 정도와 안전성을 평가하고자 2018년 03월 20일부터 2018년 07월 05일까지 세명대학교 부속 제천한방병원 한방안이비인후피부과에 내원한 아토피 피부염 환자 48명을 대상으로 진행하여 다음과 같은 결과를 얻었다.
-
1차 유효성 평가 변수인 시험군 내 피부수분 함유량과 경피수분 손실량의 시험 전(V2)과 시험 6주 후(V4) 변화치를 비교한 결과, 시험군에서 통계적으로 유의성 있게 피부수분 함유량을 증가시켰고 경피수분 손실량을 감소시켰다.
-
2차 유효성 평가 변수인 시험 전(V2)과 시험 3주 후(V3)의 시험군 내 피부수분 함유량과 경피수분 손실량의 변화치를 비교한 결과, 주관절 1㎝ 아래 및 완관절과 주관절 내측 사이 중앙의 피부수분 함유량은 통계적으로 유의하게 증가하였으나, 경피수분 손실량은 통계적으로 유의한 차이가 없었다.
-
2차 유효성 평가 변수인 시험 3주 후(V3)와 시험 6주 후(V4)의 시험군 내 피부수분 함유량과 경피수분 손실량의 변화치를 비교한 결과, 주관절 1㎝ 아래 및 완관절과 주관절 내측 사이 중앙의 피부수분 함유량은 통계적으로 유의하게 증가하였고, 주관절 1㎝ 아래의 경피수분 손실량은 통계적으로 유의하게 감소하였으나, 완관절과 주관절 내측 사이 중앙의 경피수분 손실량은 통계적으로 유의한 차이가 없었다.
-
2차 유효성 평가 변수인 시험 전(V2)과 시험 6주 후(V4)의 시험군과 대조군의 군 간 피부수분 함유량과 경피수분 손실량의 변화치의 차이를 비교한 결과, 주관절 1㎝ 아래 및 완관절과 주관절 내측 사이 중앙의 피부수분 함유량과 경피수분 손실량은 V2에서 군 간 유의한 차이가 없었으나, V4에서 통계적으로 유의한 차이를 보였고 군 간 변화량 또한 유의한 차이를 보였다.
-
2차 유효성 평가 변수인 시험 전(V2)과 시험 3주 후(V3)의 시험군과 대조군의 군 간 피부수분 함유량과 경피수분 손실량의 변화치의 차이를 비교한 결과, 피부수분 함유량은 V3의 주관절 1㎝ 아래에서만 통계적으로 유의한 차이가 있었고, 경피수분 손실량은 완관절과 주관절 내측 사이 중앙에서 군 간 변화량에만 통계적으로 유의한 차이를 보였다.
-
2차 유효성 평가 변수인 시험 3주 후(V3)와 시험 6주 후(V4)의 시험군과 대조군의 군 간 피부수분 함유량과 경피수분 손실량의 변화치의 차이를 비교한 결과, 피부수분 함유량은 V3에서 완관절과 주관절 내측 사이 중앙의 군 간 차이를 제외한 모든 통계값에서 유의한 차이가 있었고, 경피수분 손실량은 V4의 주관절 1㎝ 아래 및 완관절과 주관절 내측 사이 중앙에서 통계적으로 유의한 차이가 있었으며, 주관절 1㎝ 아래에서만 군 간 변화량에 유의한 차이가 있었다.
-
인체적용시험에 사용한 제품의 안전성을 평가하기 위하여 이상반응, EASI Score 평가, 가려움 증상 평가 및 활력징후를 측정하였다. 이상반응은 시험군의 경우 7명의 대상자에게 총 8건, 대조군의 경우 2명의 대상자에게 총 3건이 발생하였으나 아토피 피부염과 상관없는 일상생활에서 발생할 수 있는 질환으로 본 인체적용시험 제품과의 관련성이 없었다. 또한 EASI Score, 가려움 증상, 활력징후 등은 시험군과 대조군 모두 정상 범위 이외의 수치를 보이거나 군 간 통계적으로 유의한 차이를 보이지 않아 시험제품과 대조제품 모두 장기간 안전하게 사용할 수 있는 제품으로 판단되었다.






