Ⅰ. 서 론
건선은 전 세계 인구의 약 0.1-1.5%에 영향을 미치는 만성적인 다기관 염증성 질환이다1). 이 중 심상성 건선은 전체 환자의 80% 이상을 차지하는 가장 흔한 형태로, 홍반성의 비늘 모양 패치 또는 플라크가 팔다리의 신전 부위에 주로 나타나며 손바닥, 발바닥, 손톱 등 다양한 부위를 침범할 수 있다2).
또한 건선은 피부 증상에 국한되지 않고 전신적인 염증 및 대사 이상과 밀접하게 연관되어, 고혈압, 비만, 이상지질혈증, 당뇨병, 대사증후군 등 다양한 질환과 동반될 수 있다3). 현재까지 건선 치료는 주로 증상 완화 및 삶의 질 개선을 목표로 이루어지고 있으며, 국소 외용제, 광선 요법, 전신 면역 조절제, 생물학적 제제 등 다양한 접근이 활용되고 있다4). 그러나 실제 임상에서는 약물에 대한 반응 차이, 장기 사용에 따른 부작용, 치료 저항성, 비용 문제 등의 한계로 인해 여전히 보다 안전하고 효과적인 치료 전략의 개발이 요구된다4).
한의학에서는 건선을 濕熱, 血熱, 血瘀, 血燥, 陽虛 등 다양한 병인과 열․땀 배출 장애 같은 생리기능 이상에 의해 발생하는 전신 질환으로 파악하고, 한약, 침 치료, 생활습관 개선 등을 통해 전반적인 증상을 완화하는 것을 목표로 한다5). 최근에는 茵蔯蒿6), 半夏7), 大黃牧丹皮湯8) 등 여러 한약재 또는 처방을 대상으로 건선 조절 효과에 대한 네트워크 약리학 연구가 시도 되었며, 이를 통해 건선의 복합적인 병태에 대응할 수 있는 한약의 다표적 치료 가능성이 제시되고 있다.
한편, 澤瀉(Alismatis Rhizoma)는 이소변(利小便), 청습열(淸濕熱)의 효능을 가지며, 배뇨곤란, 부종, 신장병, 고지혈증, 당뇨병과 같은 다양한 질병을 치료하는 데 사용된다9). 澤瀉의 약리적 특성은 습열(濕熱)과 혈열(血熱) 등으로 설명되는 건선의 한의학적 병인과 맞닿아 있으며, 이러한 맥락에서 澤瀉를 건선 치료 후보 물질로 고려할 수 있을 것으로 생각된다.
본 연구에서는 네트워크 약리학적 접근을 통해 澤瀉의 유효 성분과 표적 단백질, 작용 경로를 분석하고, Prednisolone 및 Calcipotriol과의 기전 비교를 통해 澤瀉가 심상성 건선에 미치는 잠재적 치료 효과와 그 분자적 기전을 탐색하고자 하였다.
Ⅱ. 방 법 (Materials and Methods)
본 연구에서는 澤瀉의 활성 화합물을 수집하기 위하여 Traditional Chinese Medicine Systems Pharmacology Database(TCMSP, https://tcmsp-e.com/tcmsp.php)를 활용하였다. 해당 데이터베이스의 검색창에 澤瀉의 한약명을 간체자로 입력하여 관련 화합물 정보를 확인하였으며, 이 중 경구이용률(Oral Bioavailability, OB)≥30%, 약물유사성(Drug-Likeness, DL)≥0.18의 기준을 만족하는 성분을 유효 성분으로 선별하였다. 이후 PubChem(https://pubchem.ncbi.nlm.nih.gov/)을 통해 각 유효 성분의 분자 구조 및 SMILES(Simplified Molecular Input Line Entry System) 정보를 확인하였다.
澤瀉의 유효 성분에 대한 잠재적 표적 단백질은 SwissTargetPrediction(http://www.swisstargetprediction.ch/)을 이용하여 예측하였다. 각 성분의 SMILES 정보를 입력하여 얻어진 표적 단백질 중 생체 활성 확률(Probability) = 0인 항목은 분석에서 제외하였다.
건선 관련 표적 단백질은 GeneCards(https://www.genecards.org/)에서 ‘(psoriasis vulgaris) OR (plaque psoriasis)’를 검색어로 하여 수집하였다. 비교 약물로는 건선의 치료에 사용되는 경구 스테로이드제 prednisolone과 국소 비타민 D 유도체인 calcipotriol을 선정하였으며, 동일한 방식으로 GeneCards를 통해 각 약물의 표적 단백질을 수집하였다. 이후 수집된 Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/)을 활용하여 건선, 澤瀉, 비교 약물 간의 공통 유전자를 시각화하였다.
도출된 공통 표적 단백질에 대해 STRING database (version 12.0, https://string-db.org/)를 이용하여 단백질-단백질 상호작용(Protein-Protein Interaction, PPI) 네트워크를 구축하였다. Organism은 'Homo sapiens', Interaction score는 'highest confidence >0.700'으로 설정하였으며, 해당 조건에 따라 구축된 네트워크는 Cytoscape(version 3.10.3)를 통해 시각화하였다. 이후 CytoNCA plugin(version 2.1.6)을 이용해 Degree Centrality, Betweenness Centrality, Closeness Centrality, Eigenvector Centrality의 네 가지 중심성 지표를 산출하였으며, 모든 지표에서 평균 이상의 값을 나타낸 유전자를 핵심 유전자(Core gene)로 정의하였다.
공통 표적 단백질의 생물학적 기능과 경로를 분석하기 위해 Cytoscape의 ClueGO plugin(version 2.5.10)과 Enrichr(https://maayanlab.cloud/Enrichr/) 를 활용하여 Gene Ontology (GO) 및 Kyoto Encyclopedia of Genes and Genomes (KEGG) 분석을 수행하였다. ClueGO의 분석 조건은 P-value≤0.05, Kappa score≥0.7으로 설정하였다.
Ⅲ. 결 과 (Results)
TCMSP 데이터베이스를 통해 澤瀉 유래 활성 화합물을 수집한 결과, 경구이용률(OB)≥30% 및 약물유사성(DL)≥0.18의 기준을 만족하는 10개의 유효 성분이 선별되었다: sitosterol, alisol B, alisol B monoacetate, alisol B 23-acetate, 16β-methoxyalisol B monoacetate, alisol B, alisol C, alisol C monoacetate, 1-Monolinolein, [(1S,3R)-1-[(2R)-3,3-dimethyloxiran-2-yl]-3-[(5R,8S,9S,10S,11S,14R)-11-hydroxy-4,4,8,10,14-pentamethyl-3-oxo-1,2,5,6,7,9,11,12,15,16-decahydrocyclopenta[a]phenanthren-17-yl]butyl] acetate. 이 중 alisol C monoacetate는 PubChem에서 구조 정보를 확인할 수 없어 분석에서 제외하였으며, 최종적으로 9개의 유효 성분이 후속 분석에 사용되었다(Table 1).
선별된 유효 성분의 SMILES 정보를 SwissTarget Prediction에 입력하여 표적 단백질을 예측하였고, 중복 제거 및 Probability= 0인 항목을 제외한 결과, 총 302개의 표적 단백질이 도출되었다. 본 표적 단백질은 후속 네트워크 분석 및 질환 유전자와의 교집합 도출에 활용되었다.
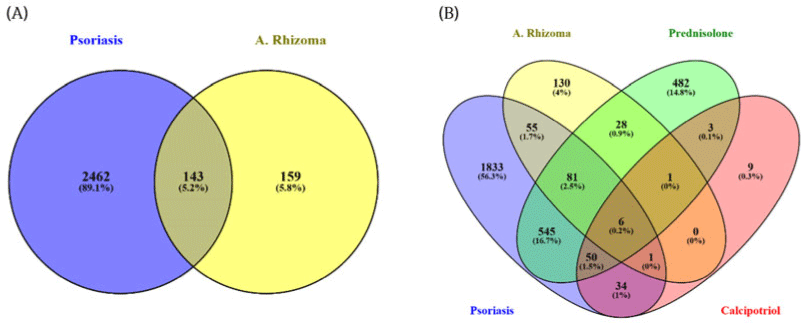
GeneCards에서 ‘psoriasis vulgaris’ 및 ‘plaque psoriasis'를 검색하여 총 2,605개의 건선 관련 유전 자가 수집되었다. 비교 약물로 선정된 prednisolone과 calcipotriol은 각각 1,196개, 104개의 표적 단백질이 확인되었다. Venny 2.1.0을 통해 교집합 분석을 수행한 결과, 건선-澤瀉 간 공통 유전자는 143개, 건선–prednisolone 간 682개, 건선–calcipotriol 간 91개로 나타났다(Fig. 1).
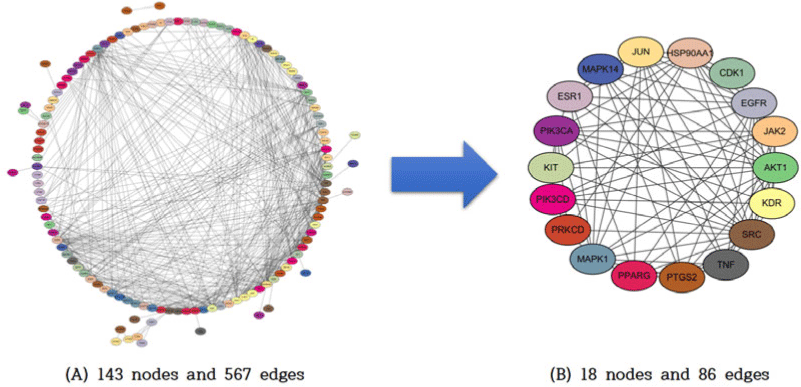
澤瀉–건선 간 공통 유전자 143개를 기반으로 STRING database(version 12.0)를 활용하여 PPI 네트워크를 구축하였다. Organism은 Homo sapiens, Interaction score>0.700으로 설정하였으며, 해당 네트워크를 Cytoscape(version 3.10.3)를 이용해 시각화한 결과 총 143개의 노드와 567개의 엣지로 구성되었다. CytoNCA plugin(version 2.1.6)을 이용해 Degree, Betweenness, Closeness, Eigenvector 중심성을 분석하였으며, 모든 지표에서 평균 이상 값을 나타낸 18개의 유전자를 핵심 유전자로 정의하였다(Fig. 2). 이들 유전자에는 SRC, HSP90AA1, EGFR, AKT1, PIK3CA, ESR1, JAK2, TNF, JUN, MAPK1, PIK3CD, PRKCD, MAPK14, PTGS2, PPARG, KDR, KIT, CDK1이 포함되었다(Table 2).
한편, 동일한 방법으로 중심성 분석을 수행한 결과, 건선–prednisolone 교집합 유전자에서는 94개의 핵심 유전자가 도출되었으며, 건선–calcipotriol 교집합 유전자의 경우 총 11개의 핵심 유전자가 확인되었다.
澤瀉–건선 간의 핵심 유전자 18개에 대한 생물학적 기능 및 관련 경로 분석을 위해 Cytoscape의 ClueGO plugin(version 2.5.10)과 Enrichr를 병행하여 활용하였다.
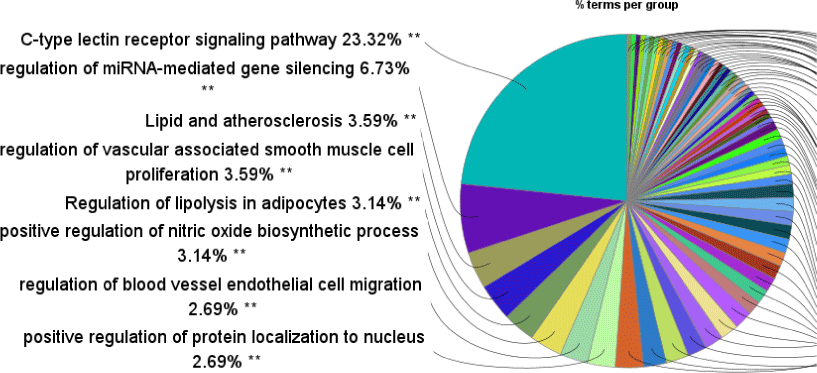
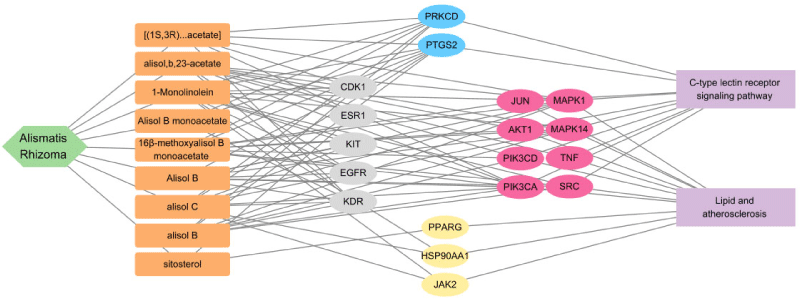
ClueGO 분석 결과, 유의미한 생물학적 경로로는 C-type lectin receptor signaling pathway, regulation of miRNA-mediated gene silencing, Lipid and atherosclerosis, regulation of vascular associated smooth muscle cell proliferation, Regulation of lipolysis in adipocytes 등이 상위에 도출되었다(Fig. 3).
Enrichr의 GO Biological Process 분석에서는 Regulation of Nitric Oxide Biosynthetic Process, Regulation of Phosphatidylinositol 3-Kinase/Prot Kinase B Signal Transduction, Cell Surface Receptor Protein Tyrosine Kinase Signaling Pathway, Epidermal Growth Factor Receptor Signaling Pathway, ERBB Signaling Pathway 등이 상위 항목으로 확인되었다(Fig. 4).

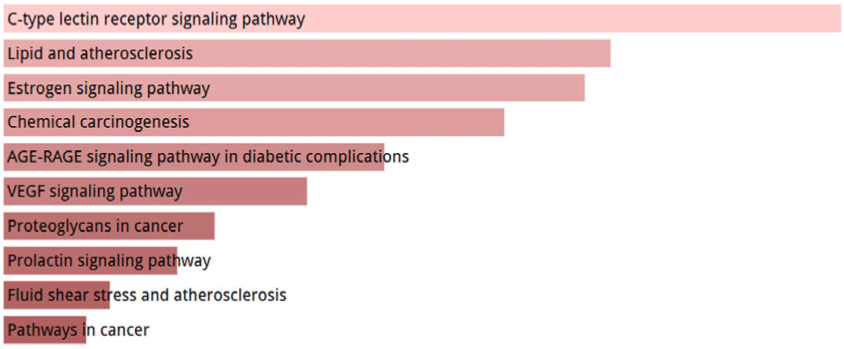
또한 Enrichr의 KEGG Pathway 분석 결과 ClueGO 분석과 마찬가지로 C-type lectin receptor signaling pathway와 Lipid and atherosclerosis 등이 상위에 확인되었으며, 추가로 Estrogen signaling pathway, AGE-RAGE signaling pathway in diabetic complications, VEGF signaling pathway, Fluid shear stress and atherosclerosis 등이 도출되었다(Fig. 5).
한편, 비교 분석을 위해 수행된 건선과 prednisolone의 핵심 유전자에 대한 Enrichr의 GO Biological Process 분석에서는 Positive Regulation of Macromolecule Biosynthetic Process, Cytokine-Mediated Signaling Pathway, Positive Regulation of Intracellular Signal Transduction, Positive Regulation of Gene Expression, Inflammatory Response 등 면역 및 염증 관련 경로가 확인되었다.
건선과 calcipotriol의 핵심 유전자 분석에서는 Positive Regulation of miRNA Transcription, Positive Regulation of miRNA Metabolic Process, Regulation of miRNA Transcription, Negative Regulation of Macromolecule Biosynthetic Process, Positive Regulation of Gene Expression 등 세포 증식 및 유전자 발현 조절과 관련된 항목이 상위에 도출되었다.
Cytoscape를 활용하여 Herb–Compound–Target–Pathway 네트워크를 시각화한 결과, 澤瀉의 활성 성분 중 1-Monolinolein이 총 11개의 핵심 유전자와 연관되어 가장 높은 연결성을 나타냈다. alisol C, 16β-methoxyalisol B monoacetate, alisol,b, 23-acetate는 각각 9개의 핵심 유전자와 관련되어 그 뒤를 이었다.
건선과 관련된 주요 경로인 C-type lectin receptor signaling pathway 및 lipid and atherosclerosis와 핵심 유전자 사이의 연결을 확인한 결과, SRC, AKT1, PIK3CA, TNF, JUN, MAPK1, PIK3CD, MAPK14의 8개 유전자가 두 경로 모두와 관련되었으며, PRKCD와 PTGS2는 C-type lectin receptor signaling pathway와, HSP90AA1, JAK2, PPARG는 lipid and atherosclerosis 경로와 관련되어 있었다(Fig. 6).
Ⅳ. 고 찰
건선은 유전적 요인, 환경적 자극, 면역 반응의 이상이 복합적으로 작용하여 발생하는 만성 염증성 피부 질환이다10). 임상적으로는 심상성 건선을 비롯하여 물방울양 건선, 농포성 건선, 홍피성 건선, 건선 관절염 등 여러 아형으로 구분되며, 이 중 심상성 건선이 전체 환자의 80% 이상을 차지한다1). 한편, 건선은 단순히 피부에 국한된 질환이 아니라, 다양한 전신 질환과의 연관성이 확인된다. 대사증후군, 심혈관계 질환, 신장 질환, 장 질환, 신경계 질환 등과 동반될 수 있으며1), 이는 건선의 병태생리가 피부를 넘어 전신 염증 반응과 긴밀히 연결되어 있음을 시사한다.
건선 피부는 각질형성세포의 과도한 증식과 비정상적인 분화, 진피의 혈관 확장, 면역세포의 침윤으로 인한 발적을 주요 특징으로 한다. 이러한 병변은 각질형성세포와 활성화된 면역세포 간의 복잡한 상호작용을 통해 형성된다11). 특히 Th17/IL-23 축은 건선의 면역학적 경로 중 핵심으로, 해당 경로에 속한 여러 유전자에서 유전적 위험 요인이 다수 확인된 바 있다10). 건선에서는 수지상세포와 각질형성세포에서 IL-23이 과도하게 생성되며, 이는 진피 내 Th17 세포를 자극하여 IL-17A와 IL-22 등의 염증성 사이토카인 분비를 유도한다. 이러한 사이토카인에 의해 각질세포의 증식과 염증 반응이 촉진되며, 결과적으로 이와 같은 면역 반응의 과활성화가 건선 발병의 중심 기전으로 작용한다.
본 연구에서는 경희대학교 한방 피부과에서 다빈도로 활용되는 生肝健脾湯의 구성 약재 중 澤瀉(Alismatis Rhizoma)를 대상으로, 심상성 건선에 대한 치료 기전을 규명하고자 하였다. 生肝健脾湯은 茵蔯五苓散과 加減胃苓湯을 합방한 처방으로, 茵蔯蒿·澤瀉·山査·麥芽·蒼朮·白朮·豬苓·茯苓·厚朴·陳皮·萊菔子·砂仁·神麯·靑皮·龍膽·藿香·半夏·大腹皮·三稜·莪朮·甘草·生薑 등으로 구성된다12,13). 濕熱을 제거하고 수분 대사 및 소화기 기능을 조절하는 효능이 있어 다양한 질환 치료에 활용되며, 구성 약물 중 茵蔯蒿과 澤瀉가 높은 비중으로 포함되어 주요 약재로 간주된다12). 앞선 연구에서는 네트워크 약리학적 접근을 통해 茵蔯蒿가 ω-hydroxylase P450 경로 및 콜레스테롤 대사 조절을 통해 건선에 치료 효과를 나타냄을 확인하였다6). 이에 본 연구에서는 네트워크 약리학적 접근을 통해, 澤瀉가 건선에 대해 어떠한 생물학적 경로를 통해 작용하는지를 확인하고자 하였다.
澤瀉의 유효 성분으로는 sitosterol, alisol B, alisol B monoacetate, alisol B 23-acetate, 16β-methoxyalisol B monoacetate, alisol B, alisol C, 1-Monolinolein, [(1S,3R)-1-[(2R)-3,3-dimethyloxiran-2-yl]-3-[(5R,8S,9S,10S,11S,14R)-11-hydroxy-4,4,8,10,14-pentamethyl-3-oxo-1,2,5,6,7,9,11,12,15,16-decahydrocyclopenta[a]phenanthren-17-yl]butyl] acetate가 확인되었다. 이 중 1-Monolinolein이 총 11개의 핵심 유전자와 연관되어 가장 높은 연결성을 나타냈다. alisol C, 16β-methoxyalisol B monoacetate, alisol,b,23-acetate는 각각 9개의 핵심 유전자와 관련되어 그 뒤를 이었다.
1-Monolinolein은 α-Glyceryl linoleate라고도 불리며, 글리세롤(glycerol)과 리놀레산(linoleic acid, LA)이 결합된 모노아실글리세롤(monoacylglycerol) 화합물이다. 이는 구조적으로 안정된 형태의 리놀레산 전달체로 작용하며, 피부에 적용 시 리놀레산의 생리 활성을 보다 효과적으로 유도할 수 있다. 리놀레산은 피부 장벽 강화, 염증 억제, 상처 치유, 모발 성장 등 다양한 생리 활성을 지닌 주요 지방산으로, 건선, 아토피 피부염, 여드름 등 염증성 피부 질환과 밀접한 관련이 있는 것으로 보고되고 있다14). 리놀레산은 세라마이드 합성, 각질세포 지질 외피(corneocyte lipid envelope, CLE) 형성, 경피 수분 손실(trans-epidermal water loss, TEWL) 억제를 통해 피부 장벽의 구조적 안정성과 기능적 항상성 유지에 중요한 역할을 한다14). 동시에 PPAR-α(peroxisome proliferator-activated receptor-α)를 활성화하여 각질세포의 분화와 지질 합성을 조절하며, 이러한 기전을 통해 피부 장벽 회복에 기여한다15). 또한 리놀레산은 PGE₂, 류코트리엔(leukotriene) 등의 염증 매개체의 전구체로 작용할 수 있지만, PPAR-α 경로를 통해 IL-1β, IL-6, TNF-α 등의 사이토카인 분비를 억제함으로써 항염 효과를 나타낼 수 있다14).
Alisol 유도체는 지질 대사 및 간 기능을 동시에 조절하며, 항염증, 항동맥경화, 항섬유화 등 다양한 병리 상황에서 다중 타겟을 통해 약리 활성을 나타내는 핵심 물질이다. Alisol C 유도체인 Alisol C 23-acetate는 지방분해효소(lipase)의 활성 부위(GLY-77, PHE-78 등)와 알로스테릭 부위(VAL-426 등)에 결합하여 효소 활성을 억제함으로써 체내 지방 흡수를 감소시키고, 이에 따라 비만 치료에 기여할 수 있는 가능성이 보고된 바 있다16). 또한 Alisol A, B, C 및 이들의 아세테이트 유도체는 혈중과 간 내 총 콜레스테롤 수치를 감소시키는 지질 저하 효과를 나타내며, farnesoid X receptor(FXR), PPARγ, LXR 등 다양한 핵수용체를 조절하는 것으로 알려져 있다17). 특히 Alisol B는 간세포 내에서 RARα-HNF4α-PPARγ 축을 조절하여 지질 축적과 염증 반응을 억제하고18), 비알코올성 지방간염(non-alcoholic steatohepatitis, NASH)과 같은 간 질환에 대한 보호 효과를 유도하는 것으로 보고된다.
澤瀉와 심상성 건선 간의 교집합으로 도출된 핵심 유전자 18개를 대상으로 Cytoscape 및 Enrichr 기반의 네트워크 분석을 수행한 결과, 주요 경로로 C-type lectin receptor signaling pathway가 확인되었다. C-type lectin 수용체(C-type lectin receptors, CLRs)는 수지상세포를 비롯한 선천면역세포에 발현되며, 병원체의 탄수화물 구조를 인식하여 면역 반응의 방향성을 조절하는 주요 수용체로 기능한다19). 특히 진균에 대한 인식을 중심으로 선천면역과 적응면역의 연결 고리로서 중요한 역할을 하는 것으로 알려져 있으며, 최근에는 박테리아, 기생충, 원생동물 등 다양한 병원체로 인식 범위가 확장되고 있다20). 나아가 CLRs는 자가면역, 알레르기, 면역 항상성 조절 등 비감염성 면역 환경에서도 기능적으로 관여한다.
CLRs는 독립적으로 혹은 다른 병원체 인식 수용체(PRRs, pattern recognition receptor)와의 상호작용을 통해 사이토카인 발현을 유도하고, 이를 통해 T세포의 분화 및 면역 반응의 특성을 조절한다19). 또한, CLRs는 단순한 병원체 인식 수용체를 넘어, 세포사멸에 수반되는 damage-associated molecular patterns(DAMPs)을 감지하여 선천 및 적응 면역의 균형을 조절하는 중심 신호 허브로 작용한다21). 이러한 기능은 CLRs가 감염성 질환뿐만 아니라 자가면역, 종양 미세환경, 대사성 염증(비만, 죽상동맥경화증 등) 등 다양한 병태 생리학적 상황에서 면역 항상성을 유지하거나 병리적 염증 반응을 조절하는 데 기여할 수 있음을 보여준다. CLRs는 병원체뿐 아니라 세포 손상이나 대사 변화와 같은 내인성 자극에도 반응할 수 있으며, 이러한 특성은 면역계가 대사성 환경 변화에 적절히 대응하도록 돕는 데 관여할 수 있다. 특히 탄수화물이 과잉되면 지방산과 중성지방 합성을 유도하는 대사 경로가 활성화되는데22), CLRs는 이러한 대사성 염증 환경에서 면역 반응과 대사 조절 사이의 상호작용을 매개하는 연결 고리로 작용할 수 있다.
대표적인 CLR인 Dectin-1은 진균의 β-glucan 성분을 인식한 뒤 SYK 및 Raf-1 경로를 활성화시키며, 이는 NF-κB 신호전달 경로를 통해 IL-6, IL-23, IL-10 등의 염증성 및 조절성 사이토카인 발현을 유도한다19). 이러한 사이토카인들은 Th1 및 Th17 세포의 분화를 촉진하고, 그 중에서도 IL-23/Th17 면역 축의 활성은 건선과 같은 만성 염증성 피부질환의 병태생리에 깊이 관여하는 것으로 알려져 있다. 실제로 건선 병변에서는 Th17 세포 및 관련 사이토카인(IL-17A, IL-22 등)의 발현이 증가되어 있으며, 이와 관련된 초기 면역 반응 유도 경로로서 CLR 신호 전달계의 이상 활성이 중요한 역할을 할 수 있다. 따라서 C-type lectin receptor signaling pathway는 건선 병태생리에서 주목할 만한 면역 조절 경로로 간주된다.
한편, Lipid and atherosclerosis와 Regulation of lipolysis in adipocytes 등 지질 대사 관련 경로들 역시 상위에 도출되었다. 이는 澤瀉가 면역 조절뿐만 아니라 지질 대사 경로를 통해서도 심상성 건선의 병태생리에 영향을 미칠 가능성을 시사한다. 지질 대사의 이상은 건선의 병태생리에서 중요한 요소로 인식되고 있으며, 여러 연구에서 건선 환자의 혈청 내 총콜레스테롤, LDL 콜레스테롤 및 중성지방의 증가, HDL 콜레스테롤의 감소, 아포지질단백(apolipoprotein) 구성의 변화, 산소 대사 산물의 과생성 등이 보고되었다23). 이러한 지질 변화는 대사증후군의 특징적 지표로 간주될 뿐 아니라, 건선 환자에게 흔히 동반되는 심혈관계 질환 등의 주요 합병증과도 밀접한 관련이 있다23). 건선과 대사증후군은 전신 염증 및 인슐린 저항성과 같은 병태생리적 경로를 공유하며24), Th1 및 Th17 세포, IL-6, TNF-α 등의 사이토카인 과발현과 같은 만성 염증의 축이 양 질환의 공통된 면역 기전으로 제시된다25). 특히, 과도한 지방조직 축적은 TNF, IL-6, leptin, resistin 등 아디포카인의 분비를 증가시켜 전신 염증 반응을 유도하고, 이는 각질형성세포의 과증식 및 Th1 면역 반응의 항진을 통해 건선 병태생리에 영향을 미칠 수 있다26).
지질 대사는 전신 대사뿐 아니라 피부 장벽 항상성 유지에도 밀접히 관여하며, 이러한 측면에서 피부 장벽의 구조적 ․ 기능적 이상 역시 건선 병태생리와 연결될 수 있다. 각질층(stratum corneum)은 무핵성 각질세포(corneocyte)와 이를 둘러싼 다층 지질막(multilamellar lipid membranes)으로 구성되며, 수분 손실을 방지하고 외부 항원이나 병원체의 침투를 차단하는 역할을 수행한다27). 이 지질막은 세라마이드(ceramide), 유리지방산, 콜레스테롤이 약 1:1:1의 비율로 구성되며, 이 중 세라마이드는 구조적 안정성과 장벽 기능 유지에 핵심적인 역할을 한다27). 실제로, 건선 병변에서는 세라마이드 조성의 변화와 함께 세라마이드 생합성의 주요 효소인 serine palmitoyl transferase(SPT)의 발현이 감소되어 있으며28), 세라마이드의 합성 저하는 건선 증상의 중증도와도 밀접하게 관련된다29).
澤瀉는 한의학적으로는 이소변(利小便), 청습열(淸濕熱)의 효능을 가지며, 고지혈증(高脂血症), 담음현훈(痰飮眩暈), 설사뇨소(泄瀉尿少), 소변불리(小便不利), 수종창만(水腫脹滿), 열림삽통(熱淋澁痛) 등의 증상에 활용되어 왔다30). 실험적 연구를 통해 고지혈증 개선31), 항비만효과32) 등이 보고되었으며, 최근 澤瀉의 지질 대사 조절 작용에 주목한 약리학적 연구들도 활발히 이루어지고 있다. 澤瀉는 Alisol A 24-acetate와 Alisol B 23-acetate 등의 주요 성분을 통해 AMPK, SREBP1c, FXR 경로를 조절하고, 항지방간, 항염증, 지질강하, 항비만 등 다양한 약리 활성을 나타내며 대사증후군과 비알코올성 지방간의 치료에 기여할 수 있다33). 또한, 澤瀉의 에탄올 추출물은 혈청 총콜레스테롤과 LDL 콜레스테롤을 유의하게 감소시키고, 장내 미생물군의 조성과 콜레스테롤 대사 관련 유전자, 특히 Insig1의 발현을 조절함으로써 지질 대사를 개선하는 효과를 보였다34). 네트워크 약리학과 대사체학, 지질체학을 통합한 최근 연구에서는 澤瀉가 고지혈증 생쥐 모델에서 PPAR 신호전달, 인지질 및 스핑고지질 대사, TNF와 IL1B 같은 염증 유전자, 그리고 PPARA, PPARG 등의 지질 대사 관련 유전자 발현을 조절함으로써 지질 대사 이상을 개선하는 기전을 밝힌 바 있다35).
본 연구의 네트워크 분석에서 지질 대사 관련 경로들이 상위에 도출된 것은, 澤瀉가 면역 반응뿐 아니라 지질 대사를 통해서도 건선의 병태생리에 영향을 미칠 수 있음을 시사한다. 이는 건선이 단순한 면역질환을 넘어, 전신 대사 이상과 피부 장벽 지질 변화가 복합적으로 작용하는 질환이라는 점과도 부합한다23). 따라서 澤瀉의 면역 및 지질 대사 경로 조절 특성은 건선 치료에서 유의미한 치료 전략으로 사료된다.
2017년에 발표된 국내 다기관 단면 연구에 따르면, 국내에서 건선 치료에 가장 흔히 사용되는 약물은 전신 또는 국소 스테로이드 제제(82.3%)였으며, 그 뒤를 이어 국소 칼시포트리올 제제(78.3%), 전신 사이클로스포린(29.1%), 전신 아시트레틴(23.8%), 전신 메토트렉세이트(22.2%), 생물학적 제제(5.7%) 순으로 사용 빈도가 높았다36).
澤瀉와 대표적인 양약인 Prednisolone 및 Calcipotriol이 건선 치료에 작용하는 기전 차이를 비교하기 위해 추가 분석을 수행하였다. 분석 결과, Prednisolone에서는 Positive Regulation of Macromolecule Biosynthetic Process, Cytokine-Mediated Signaling Pathway, Inflammatory Response 등 면역 반응과 염증 억제에 관련된 경로들이 주로 활성화되어, 강력한 항염 작용을 통해 건선을 조절하는 것으로 나타났다. 코르티코스테로이드는 염증 완화에 효과적인 치료제이지만, 각질층의 지질 합성과 세포간 이중층 형성을 방해함으로써 피부 장벽의 구조적․기능적 완전성에 부정적인 영향을 미칠 수 있다37,38). 단기간의 국소 스테로이드 도포만으로도 지질 생성이 억제되어 장벽 회복이 지연되고 각질층이 손상되며39), 이는 피부 장벽 기능 저하의 주요 기전으로 지목되고 있다. 이러한 점에서 스테로이드 치료는 각질층 지질에 영향을 주어 장벽 항상성 유지에 악영향을 미치는 것으로 사료된다.
한편 Calcipotriol은 비타민 D 유도체로, 본 연구의 분석에서는 miRNA Transcription 및 Metabolic Process, Positive Regulation of Gene Expression 등 세포 증식 및 유전자 발현 조절과 관련된 경로들이 상위에 도출되었다. Calcipotriol은 비타민 D3 유사체로, 표피 각질형성세포의 증식 억제와 염증 반응 조절을 통해 건선 치료에 효과를 나타낸다. 이러한 효과는 STAT1 및 STAT3 신호 전달을 억제함으로써 각질형성세포의 비정상적인 증식을 조절하는 기전과 관련된다40).
이와 비교하여 澤瀉의 핵심 유전자 분석에서는 C-type lectin receptor signaling pathway와 lipid and atherosclerosis 경로가 상위에 도출되었으며, 이는 면역 반응 조절뿐만 아니라 지질 대사 및 피부 장벽 유지에 관여할 수 있는 차별화된 작용 기전을 시사한다. Prednisolone과 같은 스테로이드 제제는 강력한 항염 효과를 보이지만, 지질 합성 억제와 각질층 손상 등의 부작용으로 인해 피부 장벽 기능을 저해할 수 있는 한계가 있다. 이에 반해 澤瀉는 직접적인 소염 효과는 제한적일 수 있으나, 지질 대사와 피부 장벽 관련 경로의 활성화를 통해 대사성 염증 환경을 완화하는 데 기여할 수 있다. 이러한 특성을 바탕으로, 澤瀉는 스테로이드 제제와 병행하여 치료 효과를 보완하고 부작용을 줄이는 데 활용 가능성이 있다.
본 연구는 in silico 기반의 분석으로, 실제 생체 내에서의 약물 작용을 직접적으로 입증할 수 없다는 한계가 있다. 또한 다양한 데이터베이스를 활용하는 과정에서 정보가 일부 생략되거나 누락되었을 가능성이 있으며, 검색 기준 설정이나 데이터 선별 과정에서 연구자의 주관이 개입되었을 여지도 존재한다. 더불어, 한의약 임상에서는 대부분 복합 처방을 중심으로 치료가 이루어지기 때문에, 단일 약재만을 분석한 본 연구의 결과를 실제 임상에 그대로 적용하는 데에는 제한이 있다. 따라서 본 연구의 결과는 기전 탐색의 기초 자료로 활용될 수 있으며, 향후 in vitro, in vivo 실험과 임상 연구를 통해 그 타당성을 입증할 필요가 있다.
본 연구는 네트워크 약리학적 분석을 통해 澤瀉가 심상성 건선에 대해 면역 조절 및 지질 대사 경로를 매개로 작용할 가능성을 제시하였으며, 이는 澤瀉가 건선의 복합적인 병태 생리에 기여할 수 있는 약재임을 시사한다. 특히 본 연구는 기존 건선 치료제와는 차별화된 작용 기전을 탐색하였다는 점에서, 새로운 치료 전략의 가능성을 제시하는 접근으로 평가될 수 있다. 본 결과는 향후 실험적 검증 및 임상 적용을 위한 기초자료로 활용될 수 있을 것으로 기대된다.
Ⅴ. 결 론
-
본 연구에서는 네트워크 약리학 기반 분석을 통해 澤瀉(Alismatis Rhizoma)의 유효 성분 9개로부터 총 302개의 표적 단백질을 예측하였으며, 이 중 143개는 심상성 건선 관련 유전자와의 교집합으로 확인되었다.
-
활성성분 중 1-Monolinolein은 리놀레산 전달체로서 피부 장벽 강화와 염증 조절에, alisol 유도체는 지질 대사 및 항염증 경로 조절에 기여할 수 있다.
-
핵심 유전자 18개에 대한 분석 결과, C-type lectin receptor signaling pathway와 lipid and atherosclerosis 경로가 상위에 도출되었고, 이를 통해 澤瀉가 면역 조절 및 지질 대사에 관여하여 심상성 건선을 치료할 가능성이 있음을 확인하였다.
-
비교약인 Prednisolone은 항염 경로, Calcipotriol은 유전자 발현 조절 경로 중심으로 작용하였다. 반면, 澤瀉는 면역 조절, 지질 대사 및 피부 장벽 유지 경로에 복합적으로 관여하며, prednisolone의 지질 합성 억제로 인한 피부 장벽 기능 저하를 보완할 수 있다.
-
본 연구는 in silico 기반의 탐색적 연구로, 향후 실험과 임상 연구를 통해 기전과 치료 효과를 검증할 필요가 있다.






