Ⅰ. 서 론
2019년 12월, 중국의 우한에서 원인이 밝혀지지 않은 여러 폐렴 환자가 발생하였고, 며칠 뒤 중국 당국은 신종 코로나바이러스가 해당 질환의 병원체임을 밝혀냈다1,2). 세계보건기구는 이 질환의 명칭으로 코로나 바이러스 감염증 2019의 약어인 ‘Covid-19’를 제안하였고, 세계적인 유행병을 선포하고 각국 정부에 긴급한 통제 및 예방조치를 취할 것을 촉구하였다3,4).
한의학에서 Covid-19는 疫病에 속하고, 疫癘之氣에 의해 발생한다5). Covid-19의 경증 초기는 발열이 중심이 된 表熱證과 설사가 중심이 된 濕證으로 분류하며, 表熱證에는 荊防敗毒散, 銀翹散, 九味羌活湯 등의 처방이, 濕證에는 藿朴夏苓湯, 藿香正氣散 등의 처방이 권고된다5). 경증 중기는 인후통, 발열, 숨참 위주의 裏熱證과 지속적인 설사를 중심으로 하는 濕重證으로 분류하며, 裏熱證에는 淸金降火湯, 導赤降氣湯 등의 처방이, 濕重證에는 경증 초기에 이뤄지는 진료에 준하는 치료를 권고한다5).
권고된 처방 중 銀翹散은 辛凉透表, 淸熱解讀 효능으로 病邪가 肺衛를 침범하였을 때 사용하는 처방이며, 溫病初期에 발열 증상은 있는데 땀이 나지 않거나, 땀이 미약하게 나면서 오한 증상이 있거나, 기침, 인후통, 두통, 목마름 증상이 있을 때 쓰인다6,7).
최근 Covid-19 환자들에게 銀翹散을 투여해 두통, 인후통, 기침, 발열 등의 증상에 개선이 있었음을 밝힌 연구가 있고8) 2023년 발표된 논문에 의하면 銀翹散이 Covid-19 감염으로 인한 염증 사이토카인 수치 상승을 효과적으로 완화할 수 있음이 밝혀졌다9).
이에 저자는 銀翹散이 염증 매개 물질들을 억제하여 염증성 질환을 치료할 수 있을 것으로 생각되어 본 실험을 진행하였다.
본 연구에서는 in vitro에서 銀翹散의 열수추출 동결건조물(EunGyoSan water extract, EGS)을 Raw 264.7 cell에 전처리 한 후 lipopolysaccharide (LPS)를 비롯한 다수의 toll-like receptor (TLR) ligand로 자극하여 활성화시켰을 때, 염증 매개 물질들의 발현에 끼치는 영향과 이 과정에서의 주요 기전을 알아보았다.
Ⅱ. 재료 및 실험방법
銀翹散의 구성 약재인 金銀花, 連翹, 薄荷, 牛蒡子, 桔梗, 荊芥穗, 香豉, 竹葉, 甘草는 대원약업사 (대구, 한국)에서 구매하였다. 銀翹散 1첩 분량인 173.5g을 물 1.7ℓ에 넣은 후, 30분 수침 후 2시간 20분간 대기압 상태로 전기 탕전기로 가열하여 추출하였다(Table 1). 구성 약재 중 荊芥穗, 薄荷는 후하(後下)하여 20분간 추출을 진행하였다. 이후에 추출물을 NO.2 Filter paper (Advantec. 300mm. Japan)로 여과한 후, 이 여과액을 회전증발농축기(Buchl, Swiss)로 농축하였다. 銀翹散 농축액은 24시간 이상을 초저온냉동기 (Operon, Korea)에서 냉동시킨 후, 그 동결된 샘플을 동결건조기 (LABCONCO, Kansas, MO, USA)에서 동결건조 하고 실험에 사용하기 전까지 냉장고에서 4℃로 보관하였다. EGS의 수율은 26.70%였으며, DMEM에 녹인 후 농도에 맞도록 하여 in vitro 처치에서 사용하였다.
5-diphenyl-tetrazolium bromide)와 MTT(3-(4,5-dimethylthiazol-2-yl)-2, 와 LPS(Escherichia coli 055:B5, Difco, Detroit, MI, USA)는 Sigma-Aldrich(St. Louis, MI, USA)에서 구입하였다. Streptomycin, penicillin, FBS(Fetal bovine serum)와 Dulbecco's modified Eagle's medium (DMEM)는 Gibco/BRL(Eggenstein, Germany)에서 구입하였다. 그리고 ㈜純粹化學(Junsei Chemical Co., Ltd. Tokyo, Japan)에서 Dimethylsul-foxide(DMSO)를 구입하였다. BD Bioscience(San Jose, CA, USA)에서 Anti-inducible nitric oxide synthase (iNOS)를 구매하였고, anti-inhibitory κBα(IκBα)는 Santa Cruz Biotechnology(Santa cruz, CA, USA)에서 구매, anti-nuclear factor-κB(NF-κB), anti-phospho-IκBα(p-IκBα), anti-phospho-c-Jun N-terminal kinase(JNK), anti-phospho-extracellular signal-regulated kinase(ERK), mitogen-activated protein kinase(MAPK)s, anti-phospho-p38(p38), peroxidase-conjugated secondary antibody 및 anti-lamin A/C, anti-β-actin는 Cell Signaling(Danvers, MA, USA)에서 구매하였다. Griess reagent system은 Promega (Madison, WI, USA)에서 구매하였고, cytokine인 TNF(Tumor Necrosis Factor)-α와 IL(interleukin)-6 및 IL-1β는 ELISA Kit를 Pierce endogen (Rockford, IL, USA)에서 구입하였으며, PGE2 ELISA kit는 Thermo Scientific(Waltham, MA, USA)으로부터 구입하였고, Schleicher & Schuell (Dassel, Germany)에서는 NC(nitrocellulose) paper을 구입하였다.
Waters사의 ACQUITYTM ultra performance LC system(USA)인 고성능 액체크로마토그래피(UPLC) 및 Waters사의 ACQUITYTM photodiode array detector(PDA)를 사용하였으며, software는 Empower를 사용하였고, HPLC 컬럼으로는 Waters사의 ACQUITYTM BEH C18 column(1.7㎛, 2.1×100)을 사용하였다.
Branson사의 ultrasonic cleaner 8210R-DHT 추출기를 사용하여 UPLC에 필요한 시료를 추출하였다. 분석에 사용된 물(3차 증류수)과 아세토니트릴(HPLC용)은 JT Baker(Phillipsburg, NJ, USA), methanol (HPLC용)은 Junsei Chemical Co., Ltd. (Tokyo, Japan)을 사용하였다. 실험에 사용된 표준품 중 Forsythoside, Platycodin D, Luteolin 7-O-β-D-glucoside, Arctigenin, Isoliquiritin은 Chem Faces사(Wuhan, Hubei, China)에서 구입하였고, Baicalin, Decursin, Ferulic acid, Quercetin은 Sigma사(St. Louis, MO, USA)로부터 구입하여 사용하였다.
Raw 264.7 cell은 한국세포주연구재단(Seoul, Korea)으로부터 구매하였다. 세포배양액은 5% CO2, 37℃의 조건 하에, DMEM에 10%의 FBS와 100㎍/㎖의 streptomycin, 100U/㎖의 penicillin를 혼합하여 세포배양기(Sanyo, Japan)에서 배양하였다. 실험에 사용된 모든 세포는 세포배양 dish의 전체 면적에 80-90%를 초과하여 배양 되었을 경우, 계대배양 횟수가 20회를 넘기지 않을 경우에만 사용되었다. FBS가 미포함된 DMEM에서는 추가로 Raw 264.7 cell을 배양했고, 30-1000㎍/㎖ 농도의 EGS을 포함한 DMEM으로 교환하였다. EGS으로 처치한 후 각 실험에서 LPS 1㎍/㎖를 혼합하여 사용하였다.
銀翹散 시료의 정량에 사용된 표준품은 銀翹散 탕제를 구성하는 약재인 連翹에서 Forsythoside B, 金銀花에서 Luteolin 7-O-beta-D-glucoside, 甘草에서 Isoliquiritin, 牛蒡子에서 Arctigenin, 桔梗에서 Platycodin D를 지표로 선정하여 분석하였다.
위의 표준품들을 정밀하게 칭량하여, 각각 Methanol에서 녹인 후 ㎖당 1㎎을 포함하는 표준원액을 만들었다. 그 후 위 표준원액의 적정량을 취하여, Methanol이 ㎖ 당 12.5, 25, 50, 100㎍의 포함되도록 희석하여, 표준액을 만들었다. 해당 표준물질에서 얻어진 표준곡선의 결정계수(R²) 값은 모두 0.999 이상이었다.
정량용 검액은 추출 후 동결건조된 시료를 균질하게 혼합하여 0.1g을 정확히 칭량하고, 70% Methanol 10㎖을 혼합하여 2시간 동안 초음파로 추출했다. 위의 검액을 공경 0.22㎛의 멤브레인 필터를 이용해 여과한 후 검액으로 하였다.
고성능 액체크로마토그래피(UPLC)인 Waters사의 ACQUITYTM ultra performance LC system (USA)와 ACQUITYTM BEH C18 column(1.7 ㎛, 2.1× 100)을 이용하였으며, 실온에서 Column의 온도를 분석하였다. PDA의 분석 파장은 Forsythoside B 과 Platycodin D는 280 ㎚, Luteolin 7-O-β-D-glucoside와 Arctigenin는 330㎚, Isoliquiritin는 380㎚에서 분석하였다.
이동상으로는 0.1% Formic acid와 물을 포함한 아세토니트릴 혼합액을 사용하였으며, 아래의 조건으로 분석하였다. 시료 2㎕를 주입하였으며, 유속은 0.4㎖/min이었다. 분석결과를 위해, 머무름 시간에 의한 정성확인을 하였고, 피크 면적 법으로 정량 하였다(Table 2).
Raw 264.7 cell을 6 well plate에 5×105 cells/well로 분주하고 30, 100, 300, 1000 ㎍/㎖ 농도의 EGS으로 1시간 동안 처치한 후, LPS 1㎍/㎖을 처치하여 18시간 후 세포 배양액을 얻었다.
96 well plate에 50㎕의 Griess시약(1% sulfanilamide in 5% phosphoric acid + 1% α-naphthylamide in H2O)과 각 실험군의 세포배양 상등액 50㎕을 혼합한 후, 암실에서 10분 간 반응시켰다. 이후, microplate reader(Model; Infinite M200 pro, Tecan, Männedorf, Switzerland)를 이용하여 540㎚에서의 흡광도를 계측하였다. NO의 생성량은 control군에 대비한 각 실험군의 배수(fold)로 계산하였다.
Raw 264.7 cell을 5×104 cell/well로 24 well plate에서 분주한 후 EGS를 30, 100, 300, 1000㎍/㎖의 농도로 처치하였다. 그 후 LPS를 처치하고 5% CO2, 37℃의 조건 하에서 18시간 동안 배양기에서 배양하였다.
MTT assay를 측정하기 위해 세포배양액에 well당 MTT(0.1 ㎎/㎖) 200㎕를 4시간 동안 넣은 후 추가 배양하고 MTT 용액을 제거하였다. MTT가 작용한 생존세포의 미토콘드리아에 생성된 formazan crystal을 DMSO에 녹여 microplate reader(Model; Infinite M200 pro, Tecan, Männedorf, Switzerland)을 이용하여 570㎚에서 흡광도를 계측하였다. 세포생존율은 대조군에 대하여 각 실험군의 백분율로 계산하였다.
EGS와 LPS로 처치된 Raw 264.7 cell은 단백질 발현량을 측정하기 위해 핵 분획 추출물과 전세포 추출액을 다음과 같은 방법에 따라 분리하였다.
먼저, 전세포 추출액은 처치가 Raw 264.7 cell을 ice-cold PBS로 세척한 후 scrapper로 수집하여 microtube로 옮긴 후, 3,000×g로 원심 분리하여 상등액을 제거하였다. 150mM NaCl, 25mM Tris-HCl(pH 7.6), phosphatase inhibitor cocktail, 1% NP-40와 1% sodium deoxycholate, Halt protease, 0.1% SDS를 포함한 radioimmnoprecipitation buffer(Thermo Scientific, Rockford, IL, USA)를 추가하여 30분 동안 4℃에서 반응시킨 후 15,000×g에서 10분 동안 원심 분리하여 상등액을 전세포 추출액으로 취득하였다. 그 후 BCA protein assay kit를 사용하여 단백질 농도를 확인하였다.
핵 분획은 처치된 세포를 ice-cold PBS로 세척하고 scrapper를 사용하여 수집한 후 microtube에 옮기고 3,000×g로 원심 분리하여 상등액을 제거했다. KCl 10 mM 및 EDTA 0.1 mM, Hepes (pH 7.9) 10 mM, phenylmethylsulfonyl fluoride 0.5 mM, dithiothreitol 1 mM와 0.5% Noridet P-40을 포함한 완충액 100㎕를 넣어 vortex하고 ice에 10분간 방치한 후, 5분 동안 4℃에서 16,000×g로 원심 분리하였다. 원심 분리 후 세포 추출물이 포함된 상등액은 제거하고 핵이 포함되어 있는 침전물에 NaCl 400 mM, Hepes(pH 7.9) 20 mM, dithiothreitol 10 mM, EDTA 1 mM와 phenylmethylsulfonyl fluoride 1 mM로 이루어진 완충액 40㎕을 첨가하여 완전히 녹였다. 그 후 ice에서 1시간 방치한 후 10분간 4℃에서 16,000×g로 원심 분리한 후 상등액을 핵분획물로 취득하였다. BCA protein assay kit를 사용하여 핵 분획물의 단백질 함량을 측정하고, 실험에 사용되기 전까지 –70℃에서 보관하였다.
전세포 추출액 및 핵 분획으로부터 단백질 함량을 칭량하여 동일한 양의 단백질을 폴리아크릴아마이드 젤 전기 영동법을 이용하여 전기 영동시킨 후, 단백질을 Nitrocellulose(NC) membrane으로 전이시켰다. 단백질이 전이된 각각의 NC membrane iNOS, p-I-κBα, NF-κB, I-κBα, MAPKs, β-actin 및 Lamin A/C의 1차 항체와 반응시키고, blocking, washing 과정을 지난 후, 단백질 발현을 가시화할 수 있도록 horseradish peroxidase가 혼합된 2차 항체와 반응시킨 후 Amersham Biosciences사(Piscataway, NJ, USA)의 ECL detection reagents을 사용하여 발색을 진행하였다. 각 단백질의 발현량을 평가하기 위해서 Image analyzing system (Ultra-Violet Products Ltd., Upland, CA, USA)을 사용하였고, 각 단백질의 발현량은 대조군과 대비해 각 실험군의 fold로 나타내었다.
6 well plate에 5×105 cell/㎖로 분주하여 Raw 264.7 cell을 배양한 후, EGS을 300, 1000 (㎍/㎖)의 농도로 처치하여 Cytokine과 PGE2을 측정하기 위해 사용하였다. EGS이 처치된 cell은 1시간 후에 LPS 1㎍/㎖를 첨가하였으며, 18시간 동안 처리한 후 cytokine을 측정하였다.
IL-1β, IL-6, TNF-α는 Pierce endogen의 ELISA Kit를 이용하여 측정했다. PGE2 함량은 R&D Systems사에서 제공한 assay kit(Minneapolis, MN, USA)를 사용하여 평가하였다. PGE2 및 Cytokine의 표준품마다 7개의 농도를 계측하여 표준곡선을 얻었고, 발현량은 pg/㎖로 표준곡선에 대입하여 나타내었다.
Ⅲ. 결 과
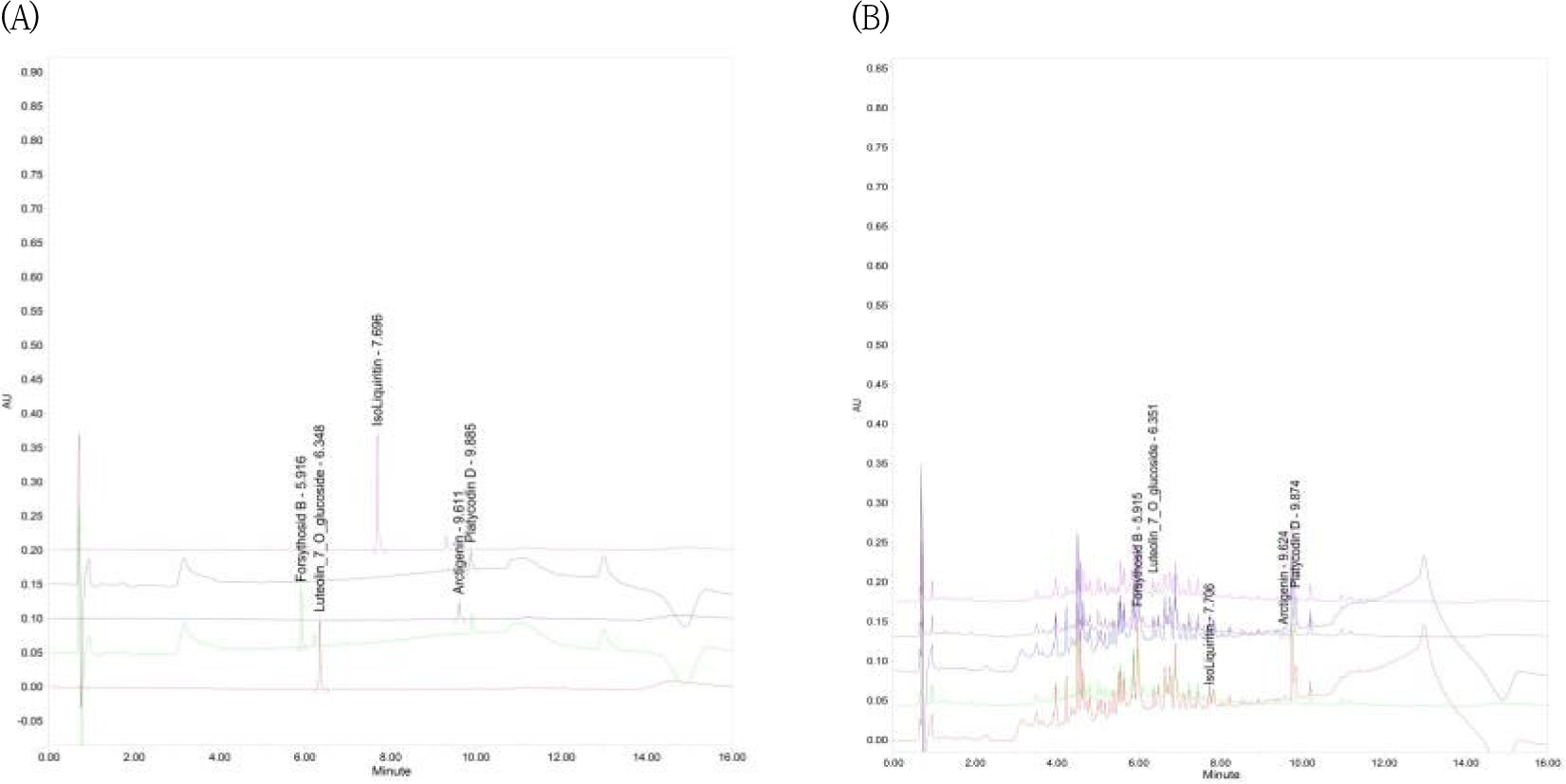
EGS 물 추출물의 표준화를 위해 EGS의 구성약재 중 連翹는 Forsythoside B, 金銀花은 Luteolin 7-O-β-D-glucoside, 甘草는 Isoliquiritin, 牛蒡子는 Arctigenin, 桔梗은 Platycodin D를 지표로 선정하여 분석을 진행하였다(Table 3).
분석결과 본 연구에 사용된 EGS에는 Forsythoside Brk 58.315±0.249, Luteolin 7-O-β-D-glucoside 6.427±0.127, Isoliquiritin이 2.214±0.057, Arctigenin이 100.275, Platycodin D가 14.983± 0.425(㎎/㎏)이 함유되어 있었다(Fig. 1).
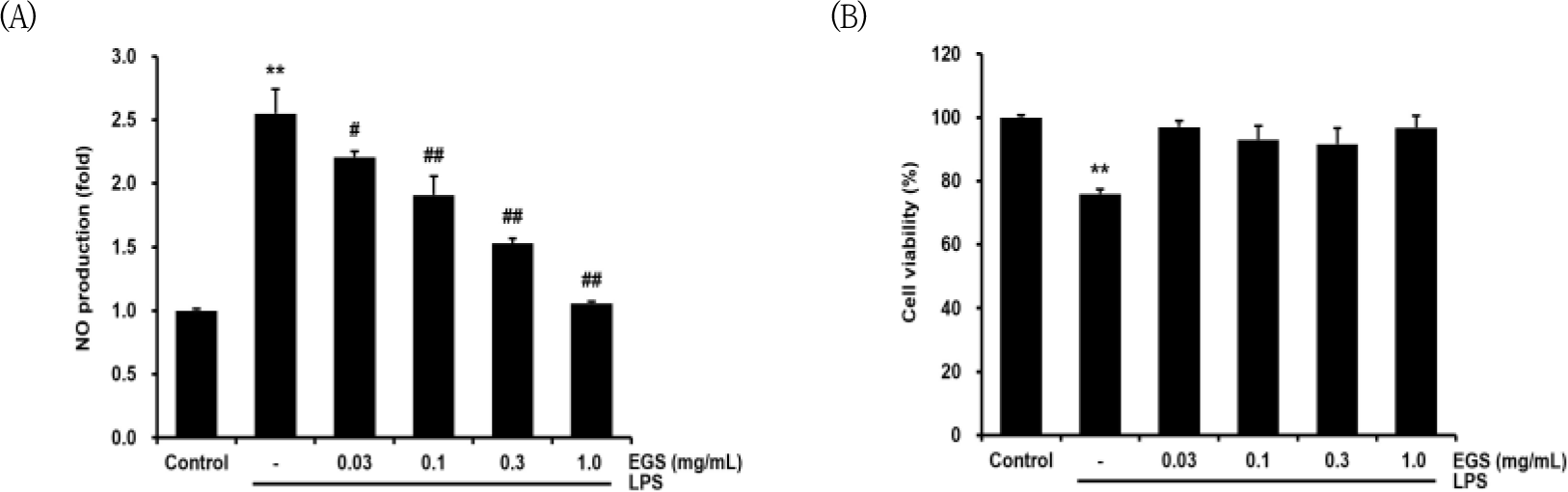
우선 LPS 단독 처치군에서는 대조군과 비교하여 NO의 생성량이 2.55±0.19배로 유의하게 (p<0.01) 증가하였다. EGS 30㎍/㎖로 처치한 군에서는 2.20±0.04배로 NO 생성을 유의성 있게 감소시키지 못하였으나, 100㎍/㎖에서는 1.90±0.14배로 NO의 생성을 유의미하게 감소시켰다. 300㎍/㎖에서는 1.52±0.04배, 1000㎍/㎖에서는 1.05±0.01배로 모두 유의미하게 (p<0.01) 감소하였다(Fig. 2A).
EGS이 LPS 처리 후의 NO 생성을 억제시킨 것이 EGS+LPS(1㎍/㎖)의 세포독성으로 인해 나타난 것인지를 판별하기 위하여, EGS+LPS를 처리하고 18시간 후에, MTT assay를 시행하여 세포생존율을 평가하였다.
LPS군에서는 control군에 비교하여 75.92±1.51%의 세포생존율을 보였으나(p<0.01), LPS와 EGS 30㎍/㎖를 처리한 군에서 96.98±1.90%, LPS와 EGS 100㎍/㎖를 처리한 군에서 93.06±4.37%, LPS와 EGS 300㎍/㎖를 처리한 군에서 91.58±4.99%로 LPS 단독 처치군과 비교하였을 때 세포 생존율의 저하는 나타나지 않았다(Fig. 2B).
따라서 EGS이 100과 300, 1000㎍/㎖의 농도에서 NO의 생성을 유의미하게 억제하고, 세포생존율에 영 향을 미치지 않았으므로 이후의 기전 연구는 EGS 300, 1000 ㎍/㎖의 농도에서 실험을 하였다.
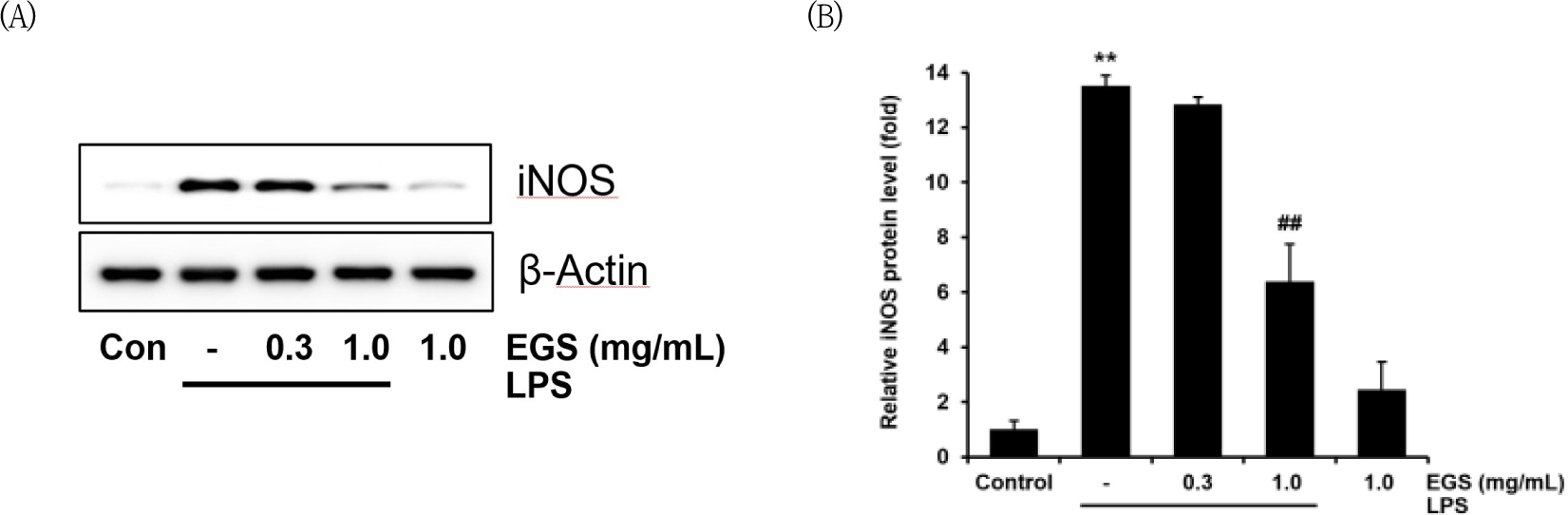
EGS 300, 1000㎍/㎖의 농도에서 NO의 생성을 억 제한 것이, iNOS 단백질 발현 조절 여부과 관련이 있는지 확인하기 위해, EGS 300, 1000㎍/㎖의 농도로 60분간 처치하고 Raw 264.7 cell에 LPS 1㎍/㎖를 처치하여 iNOS의 단백질 수준을 평가하였다.
LPS 단독 처치 결과 iNOS의 발현이 대조군 (1.00±0.32) 대비 13.51±0.37배로 유의미하게 증가하였다. EGS 300㎍/㎖의 농도에서는 LPS군에 비해 12.83±0.27배로 비슷한 수준이었고, EGS 1000㎍/㎖에서는 6.38±1.34배로 LPS군에 비하여 유의미하게 (p<0.01) 감소하였다(Fig. 3).
EGS이 대식세포에서 염증이 발현됐을 시 생성되는 cytokine 수치를 억제할 수 있는지 확인할 목적으로 TNF-α, IL-1β 및 IL-6의 생성량을 측정하였다.
그 결과, 무처치 대조군에서 TNF-α가 299.00± 24.12pg/㎖이었으나, LPS군에서는 3615.44±37.18 pg/㎖로서 대조군에 비해 유의미하게(p<0.01) 증가하였다. 이러한 LPS에 의한 TNF-α의 증가는 EGS 300㎍/㎖과 1000㎍/㎖에서 각각 2052.66±133.86, 1383.44±43.93pg/㎖로 모두 유의성 있게(p<0.01) 감소하였다(Fig. 4A).
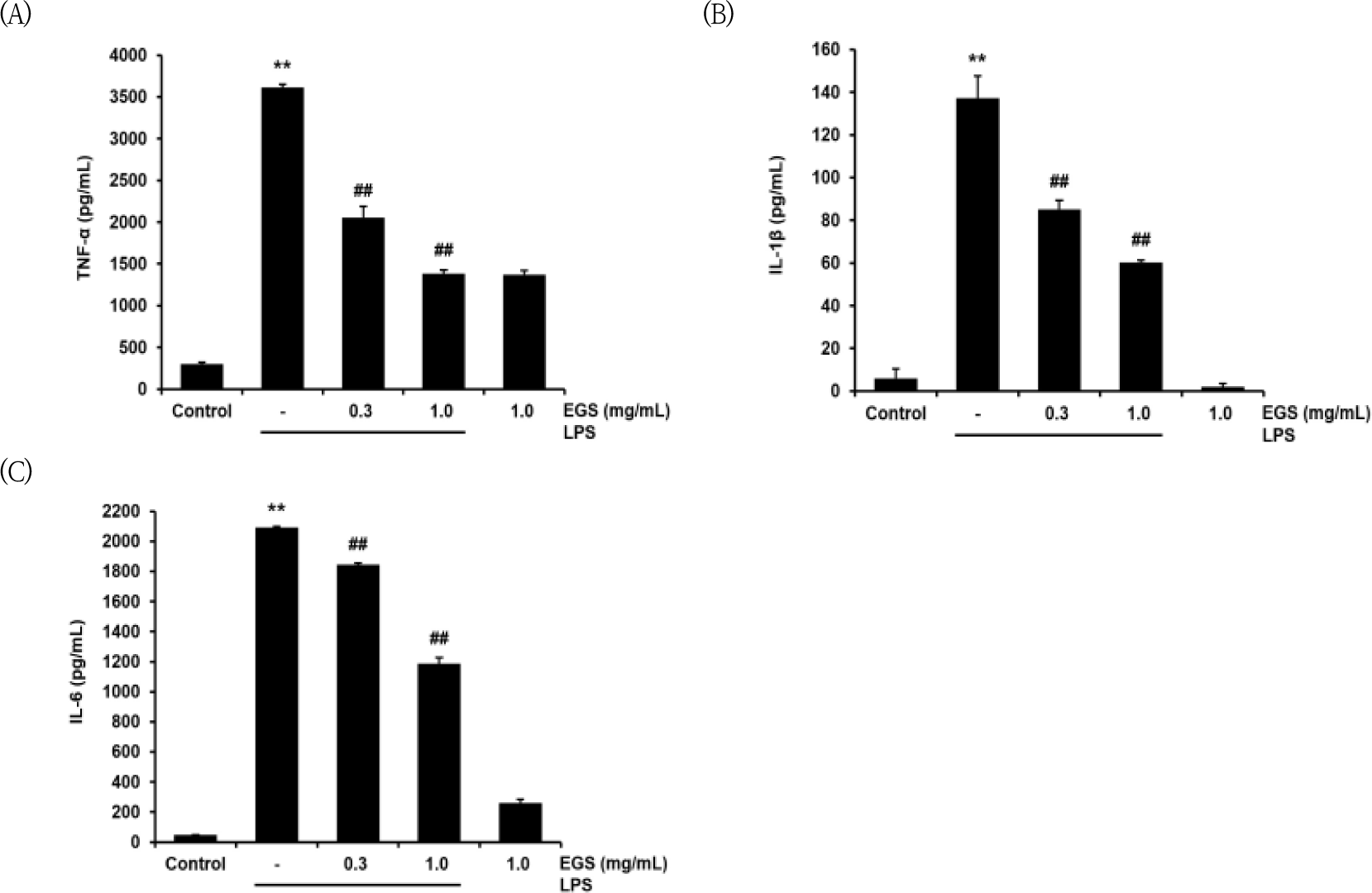
대조군에서는 IL-1β가 5.94±4.48pg/㎖이었으나, LPS군에서는 137.28±10.24pg/㎖로서 대조군에 비교하여 유의미하 (p<0.01) 증가하였다. 이러한 LPS에 의한 IL-1β의 증가는 EGS 300㎍/㎖에서는 85.07±4.29pg/㎖, 1000㎍/㎖에서는 60.37±1.04 pg/㎖로 유의미한(p<0.01) 감소를 보였다(Fig. 4B).
또한, IL-6는 대조군에서 46±1.44pg/㎖이었으나, LPS군에서는 2091.29±9.37pg/㎖로 대조군에 비하여 유의미하게(p<0.01) 증가하였다. 이러한 LPS에 의한 IL-6의 증가는 EGS 300㎍/㎖과 1000㎍/㎖에서 각각 1847.11±7.14, 1185.48±40.95pg/㎖로 유의미하게(p<0.01) 감소하였다(Fig. 4C).
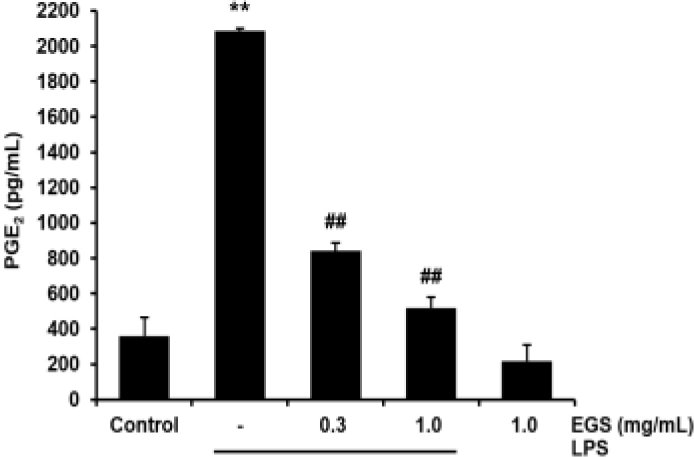
EGS이 PGE2의 생성에 영향을 끼쳐 염증반응을 억제할 수 있는지 확인하기 위해 PGE2 생성량을 측정하였다.
PGE2는 대조군에서는 360.10±106.04pg/㎖이었으나, LPS 단독 처치군에서는 2086.85±15.01pg/㎖로 대조군과 비교하여 유의하게(p<0.01) 증가하였다. 이러한 LPS에 의한 PGE2의 증가는 EGS 300㎍/㎖에서는 841.06±44.98pg/㎖, 1000㎍/㎖에서는 518.39 ±60.05pg/㎖로 모두 유의미한(p<0.01) 감소를 보였다(Fig. 5).
본 연구에서는 EGS이 NF-κB signaling pathway의 활성을 억제하여 염증반응을 억제하는 것인지 확인하기 위해서 세포질에서의 p-IκBα, IκBα의 발현량을 측정하고, 핵분획에서는 NF-κB 단백질의 발현량을 확인하였다.
IκBα는 LPS 처치군에서 대조군 대비 0.34±0.01배로서 대조군에 비해 유의하게(p<0.01) 감소하였다. 그러나 이러한 LPS로 인한 IκBα 발현량의 감소는 EGS 1000㎍/㎖에서는 0.55±0.02배로 유의미하게(p<0.01) 증가하였다(Fig. 6A).
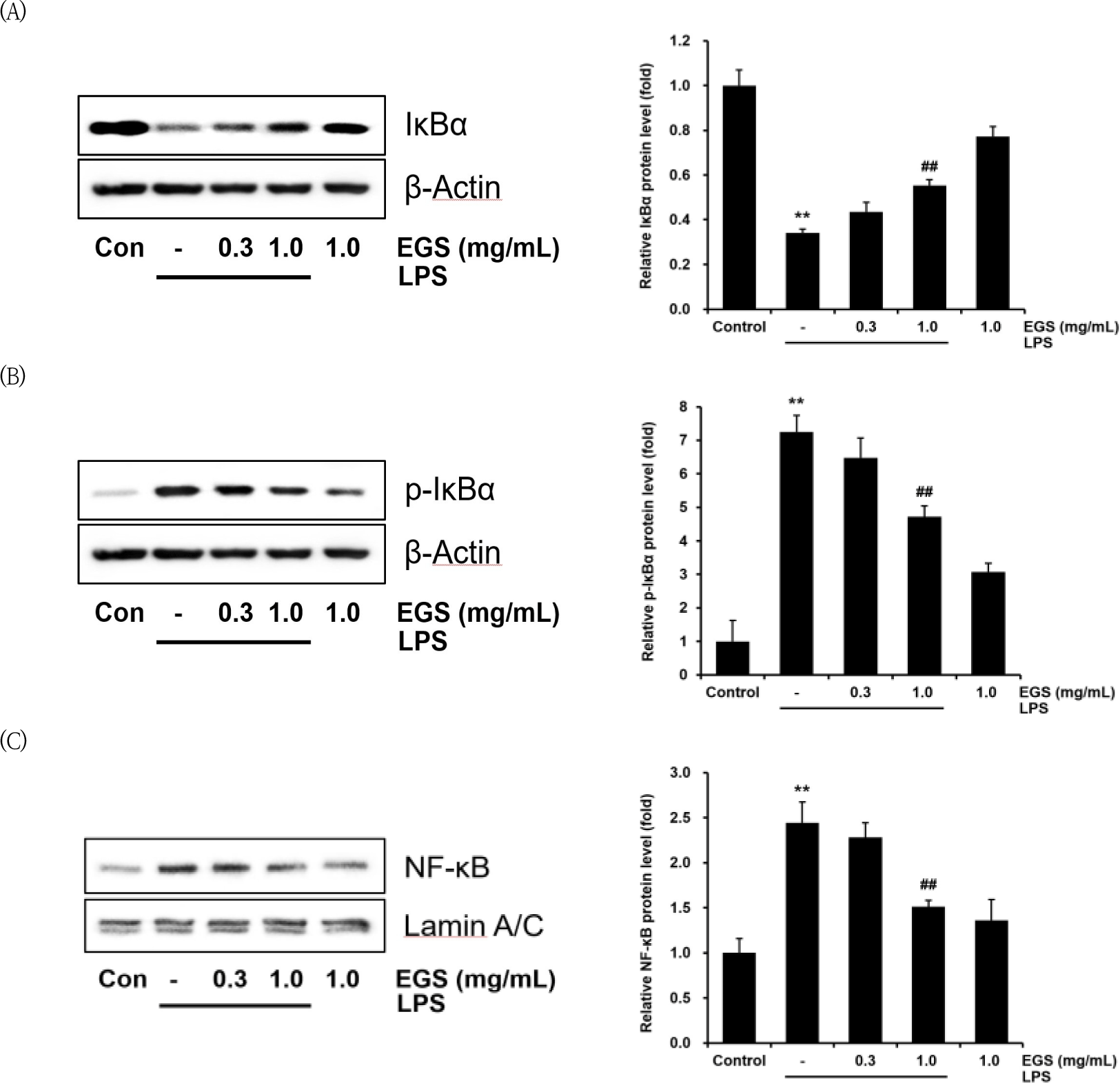
p-IκBα는 LPS 처치군에서 대조군 대비 7.25±0.49배로 유의미하게 (p<0.01) 증가하였으나, EGS 1000㎍/㎖에서는 증가된 p-IκBα가 4.71±0.33배로 LPS 처치군에 비교하여 유의미하게(p<0.01) 감소하였다(Fig. 6B).
핵분획에서 NF-κB는 LPS 처치로 의해 대조군 대 비 2.44±0.23배로 유의미하게(p<0.01) 증가하였으나, EGS 1000㎍/㎖에서는 NF-κB가 1.50±0.07배로 LPS 처치군에 비해 유의미하게(p<0.01) 감소하였다(Fig. 6C).
EGS이 NF-κB pathway외에 MAPK pathway에 영향을 끼치는지 확인해보았다. p38와 ERK의 인산화는 LPS군에서는 대조군과 비교하여 각각 4.49±0.35배, 5.03±0.55배로 유의미하게(p<0.01) 증가하였다. 하지만 p38와 ERK의 인산화는 EGS을 처치한 군에서 유의미한 결과를 보여주지 못하였다(Fig. 7A, B and C).
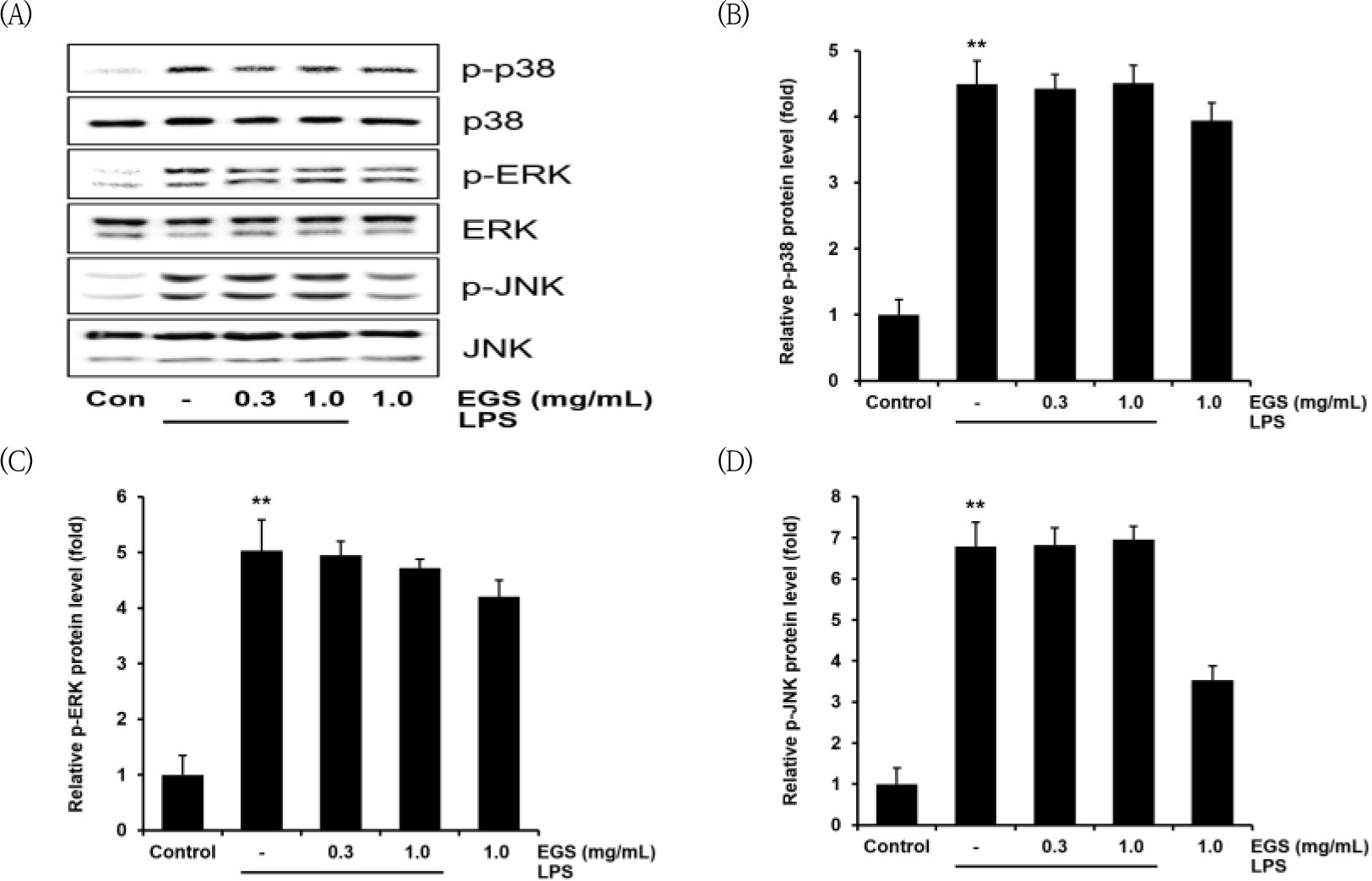
JNK의 인산화 역시는 대조군과 비교하여 LPS군에서는 6.78±0.59배로 유의미하게 (p<0.01) 증가하였으나, EGS 300, 1000㎍/㎖의 농도에서 LPS군에 비교하여 유의미한 수치를 나타내지 못했다(Fig. 7A and D).
Ⅳ. 고 찰
銀翹散은 1798년에 청대의 오국통(吳鞠通)이 저술한 온병조변(溫病條辨)에 처음 수록된 처방으로 金銀花, 牛蒡子, 連翹, 桔梗, 薄荷, 荊芥穗, 香豉, 竹葉, 甘草로 구성된다1). 辛凉透表, 淸熱解毒하는 효능이 강한 약으로 상기도감염, 기관지염 등의 호흡기계 감염과 각종 염증 매개성 질환에 사용되며18), 감기, 다래끼, 피부질환 등에도 상용되고 있다10).
銀翹散의 구성약물 중 金銀花는 전통적으로 廱腫疔瘡, 丹毒, 喉痺, 溫病發熱, 熱毒血痢, 風熱感冒 등을 치료하는 것으로 알려져 있다11). 또한 連翹는 멜라닌 생성 억제 효과가 있고 항균활성, 항산화, 항염증, 미백효과가 있다12-5). 牛蒡子는 除風宣肺氣, 祛痰止咳, 疎散 風熱, 淸熱解毒 등의 효능이 있고, 약리작용으로 혈당강하, 항균, 항암, 작용 등이 보고되었다16,17).
銀翹散과 銀翹散의 구성 약물에 대한 연구는 다양하게 이루어졌는데, 최근 2021년에 Lin 등 이 발표한 논문에 의하면 金銀花는 항염 효과를 가진다고 보고되었고18) 2015년에 Li 등은 金銀花의 항균, 항바이러스, 항염, 항산화, 해열, 면역조절 효과에 대해 보고한 바가 있다19). 牛蒡子에 대한 선행 연구를 살펴보면 아토피 피부염 개선 작용, 혈관 이완 작용, 알러지 염증반응 억제, 안면 피부 개선 효과 등이 보고되었으며, 牛蒡子로부터 추출한 arctigenin에는 미백 효과가 있음이 보고되었다20-3).
銀翹散에 관한 최근 연구로는 급성 세기관지염에 은교산을 활용하여 치료한 3례의 증례 보고와24), 金銀花과 시프로플록사신(ciprofloxacin)을 같이 투여했을 때 폐렴연쇄상구균에 미치는 영향에 대한 실험 연구25) 등 세균성 질환에서의 항균 효과에 대해 주로 보고되어 있다.
Covid-19는 2019년 출현 이후 전 세계로 급속도로 확산되었고26,27). 오미크론 변종의 출현 과 더불어 Covid-19의 환자 수는 급격히 증가하였으며 이는 전 세계 의료체계에 큰 부담을 안겨주었다28,29). 한국 정부는 팬데믹 초기부터 Covid-19에 대한 한의학 원격진료를 허용하였고, 靑肺排毒湯을 비롯한 瓊玉膏, 資蔭補肺湯, 銀翹散 등이 처방되었다30). 2023년 원 등8)의 연구에 의하면, 2022년 1월부터 3월까지 자가격리 중이던 COVID-19 확진 환자들을 대상으로 7일간 은교산을 투여한 결과 두통, 인후통, 발열, 기침 등의 증상이 모두 소실되었다.
이에 銀翹散의 효능과 구성 약물들의 기존 연구 결과 및 최근 Covid-19 치료에 효과가 있음을 밝힌 연구에 근거하여 임상에서 항염증 효과가 있을 것으로 사료되어 銀翹散에 대한 연구를 진행하였다.
염증 반응은 외부 인자의 공격으로부터 인체를 방어하고 손상을 국소화하기 위해 조직에서 일어나는 가장 중요한 생체 방어보호 기전이다. 주로 외부 요인에 의한 감염 또는 손상, 수술, 화학 물질 등에 의해 조직이 손상되면 주변에서 염증 반응이 시작되는데, 주변의 대식세포와 비만세포에서 chemokine, cytokine 등과 같은 염증 매개 물질들이 활발하게 분비된다. 염증 매개 물질들은 염증이 발생한 조직으로 백혈구를 유인하는 역할을 하게 된다. 호중구가 조직의 혈관 내피세포를 통과하여 조직 내로 들어가게 되면, 면역과정이 활성화 되어 병원균을 제거하고 감염을 막게된다31-4). 또한 단핵 백혈구, 대식세포, 수지상세포와 같은 면역 세포들을 유도하는 chemokine (CHEMOtactic cytoKINES)을 분비함으로써 염증 반응이 더욱 증폭되도록 한다. 이러한 염증 반응이 과도하게 나타날 경우에는 면역 세포들이 병원균과 정상적인 조직을 구별할 수 없기 때문에 정상 조직까지 손상시키게 된다. 이후 손상된 조직은 염증 반응이 계속 이뤄지면서 발적, 붓기, 통증, 열과 함께 조직변성이 일어나게 된다35,36).
본 연구에서는 銀翹散 열수 추출물이 in vitro 모델에서 염증 매개성 물질의 발현, NF-κB, MAPK의 신호전달을 억제하여 항염증 효과를 나타낼 수 있는지 LPS를 이용하여 활성화시킨 대식세포 주인 Raw 264.7 cell를 사용하여 알아보았다.
Lipopolysaccharide(LPS)는 그람 음성균의 외막을 구성하고 있는 다당류로, 지질과 O-항원(O-antigen)으로 구성되어 있다37). 따라서 숙주 대식세포에 LPS를 처치하게 되면, 대식세포가 반응하여 내재 면역과 관련된 신호전달 수용체인 toll-likereceptor4(TLR4)를 통해 면역 반응을 일으킨다38).
저자는 항염증 실험을 시작하기 전에, 실험에 이용된 추출물의 핵심 표지성분의 농도를 확인하였다. EGS에서 連翹의 주요 지표성분인 Forsythoside B이 58.315±0.249, 金銀花의 주요 지표성분인 Luteolin 7-O-β-D-glucoside가 6.427±0.127, 甘草의 주요 지표성분인 Isoliquiritin이 2.214±0.057, 牛蒡子의 주요 지표성분인 Arctigenin이 100.275, 桔梗의 주요 지표성분인 Platycodin D가 14.983±0.425(㎎/kg) 함유되어 있음을 확인한 후 실험에 사용하였다.
NO는 염증 반응 중 생성되는 물질로, LPS에 의해 대식세포가 활성화되면 iNOS가 발현되고 NO가 생성되어 세포 매개성 면역에 관여하게 된다. 이렇게 반응성 높은 염증 매개성 물질이 과도하게 생성되면 필요 이상의 과한 염증 반응이 나타나 인체를 손상시킬 수 있으므로 적절하게 조절되어야 한다39).
먼저 EGS의 항염증효과를 알아보기 위해서 NO 생성량을 측정하였고, NO의 생성량 저하가 EGS 처치 후 세포가 손상되어 나타난 것이 아님을 확인하기 위해 세포 생존율도 함께 측정하였다. EGS을 처치한 후 세포 생존율은 줄어들지 않았으며, EGS을 30, 100, 300, 1000 ㎍/㎖의 농도로 전처치 하였을 때 100, 300, 1000㎍㎖의 농도로 전처치한 경우에 LPS 단독 처치군에 비하여 NO 생성량이 유의하게 감소하였다.
또한 NO의 생성량 감소가 iNOS 단백질의 억제에 의한 것인지 확인하기 위해 iNOS를 측정하였다. EGS을 300, 1000 ㎍/㎖의 농도로 전처치 후 비교하였을 때, 300 ㎍/㎖ 농도에서는 iNOS를 유의하게 감소시키지 못하였고, 1000 ㎍/㎖의 농도에서 유의하게 감소시킨 것을 확인하였다. 따라서 EGS은 iNOS를 감소시킴으로써 NO의 생성을 억제한다는 것을 확인할 수 있다.
LPS는 대식세포의 TLR4을 통해 신호를 전달하고, NF-κB와 MAPK의 활성화를 일으킨다. NF-κB가 활성화 되게 되면 전 염증 cytokine TNF-α, IL-6, IL-1β가 생성되어 면역 반응이 더욱 강하게 나타나도록 이끈다40).
본 연구에서는 EGS이 cytokine을 억제하여 항염증 효과를 나타내는지 확인하기 위해 TNF-α, IL-1β, IL-6의 생성량을 분석하였다. EGS은 300, 1000 ㎍/㎖의 농도에서 모두 유의하게 TNF-α, IL-6, IL-1β의 생성량을 감소시켰다. 또한 혈관에서 염증 매개성 손상이 발생하면 chemokine인 PGE2가 발현되어 혈관벽에 대식세포와 단핵구가 침윤되도록 하고, 혈관벽의 경화와 섬유화를 일으킨다. 이러한 PGE2은 염증 반응에 의해 IL-1β가 증가하면 활성화된 NF-κB를 통하여 증가한다41).
본 연구에서 PGE2의 생성량을 분석하였을 때 IL-1β와 같이 300, 1000㎍/㎖의 농도에서 유의하게 생성량이 감소한 것을 확인할 수 있었는데, IL-1β을 억제함으로써 PGE2의 생성량을 감소시켰음을 알 수 있다(Figure 5).
TLR4 수용체에 LPS가 결합하게 되면 구조적으로 변화가 나타나 adaptor protein인 Myeloid differentiation primary responsegene88(MyD88)을 모으게 되며, MyD88 단백질 하위의 일련의 kinase cascade를 통해서 NF-κB의 억제제인 IκBα의 인산화가 일어나 활성화된 NF-κB가 핵 내로 이동하면서 전사인자로써 작용하게 된다40).
따라서 본 연구에서는 EGS이 IκBα와 p-IκBα, NF-κB 단백질 생성량에 끼치는 영향을 분석하였다. EGS은 1000㎍/㎖의 농도에서 IκBα의 농도를 유의하게 감소시켰고, 1000 ㎍/㎖의 농도에서 p-IκBα의 농도를 유의하게 감소시켰다. NF-κB 단백질 생성량 또한 1000㎍/㎖의 농도에서 유의하게 감소시키는 것을 확인하였다.
그러므로 EGS은 NF-κB 신호전달회로를 억제함으로써 TNF-α, IL-1β, IL-6과 같은 cytokine과 PGE2 생성량을 감소시킨다는 것을 확인할 수 있다.
LPS가 TLR4에 결합하게 되면 NF-κB 신호전달회로 뿐만 아니라 MAPK 신호전달 또한 활성화하게 되는데, MAPK 신호전달회로가 활성화되면 activator-protein1(AP-1)과 같은 전사인자도 같이 활성화되어 전 염증성 cytokine 생성에 영향을 미치게 된다33).
따라서 본 연구에서 p38, ERK 그리고 JNK의 인산화 정도를 분석한 결과 1000㎍/㎖의 농도에서만 JNK의 인산화를 유의하게 감소시켰으므로 EGS은 MAPK 신호전달회로에 비해 NF-κB pathway를 더 효과적으로 억제하여 염증반응을 줄인다는 것을 알 수 있다.
따라서 위의 결과들을 바탕으로 in vitro 연구에서 EGS의 항염증 효과는 NF-κB의 신호 전달 체계를 통하여 cytokine의 생성을 억제함으로써 나타난다는 것을 확인하였다.
銀翹散의 군약인 金銀花, 連翹 등은 항염 효과가 입증된 약재로12-8), 金銀花가 군약인 金銀花散과 連翹가 군약인 荊芥連翹湯 또한 항염증 효과를 가진다고 보고된 바 있다42,43). 본 연구에서 銀翹散은 동일한 염증성 cytokine 지표(TNF-α, IL-6)에서 유의미한 억제 효과를 보였으며, 이는 기존 처방과 비교하여 최소한 동등하거나 일부 지표에서는 더 뛰어난 조절 능력을 나타낼 가능성을 시사한다. 향후 직접 비교 연구를 통해 은교산의 상대적 우수성을 검증할 필요가 있다.
COVID-19 환자에서는 과도한 염증 반응, 이른바 cytokine storm이 질병 악화와 사망률 증가의 주요 원인 중 하나로 지목되고 있으며44), 특히 TNF-α, IL-1β, IL-6와 같은 염증성 사이토카인의 혈중 농도 상승이 심각한 예후와 밀접한 관련이 있음이 보고되었다45). 또한, SARS-CoV-2 감염에 의해 대식세포가 항염 전환에 실패하고 지속적으로 IL-6를 과다 생성하는 병태가 유발되어 염증성 반응이 장기화될 수 있음이 제시되었다46). 이는 COVID-19에서 면역 반응 조절 실패가 다른 바이러스성 질환보다 더욱 두드러지게 나타나는 특징적 병리 소견임을 시사한다. 본 연구에서 銀翹散 열수 추출물은 TNF-α, IL-1β, IL-6의 발현을 유의미하게 억제하고, NF-κB 경로를 조절하여 염증 반응을 완화시키는 효과를 보였다. 따라서 은교산은 COVID-19와 같이 과도한 염증성 사이토카인 생성이 문제되는 감염성 질환의 치료제로 활용 가능성이 있을 것으로 판단된다.
그러나 본 연구는 직접적인 항바이러스 활성에 대한 평가를 수행하지 않았으므로, 향후 SARS-CoV-2에 대한 항바이러스 효과를 규명하는 추가 연구가 필요하다. 더불어 위 연구에서 언급한 NF-κB pathway, MAPK 외에도 염증 매개인자를 생성하는 다른 경로가 있으므로, EGS의 염증 기전을 밝혀내기 위해서는 추가적인 연구가 필요하며, 항염증 효과에서 EGS의 각 약물 간 최적의 혼합비율은 무엇일지 알아보는 추가적인 연구 또한 필요할 것으로 사료된다.
Ⅴ. 결 론
본 연구는 대식세포주 Raw 264.7 cell을 LPS를 이용하여 활성화시킨 후 염증 반응을 유도하여 EGS의 항염증 효과와 기전을 연구하였고 다음과 같은 결론을 얻었다.
-
LPS는 NO의 생성량을 현저하게 증가시켰고, EGS 100, 300, 1000㎍/㎖ 농도에서는 증가된 NO의 양을 유의미하게 억제하였다. 또한, EGS+LPS 처리군은 LPS 단독 처리군에 비해 세포 독성을 보이지 않았다.
-
LPS는 iNOS의 생성을 유의하게 증가시켰으며, EGS은 1000㎍/㎖에서 증가된 iNOS 단백질의 발현량을 유의미하게 억제하였다.
-
LPS는 TNF-α, IL-1β, IL-6의 전염증성 cytokine을 유의미하게 증가시켰으며, EGS 300, 100㎍/㎖에서 증가된 TNF-α, IL-1β, IL-6의 농도를 모두 유의하게 감소시켰다.
-
LPS는 PGE2의 생성량을 유의하게 증가시켰고, EGS 300, 100㎍/㎖의 농도에서 증가된 PGE2의 생성량을 유의하게 감소시켰다.
-
LPS는 p-IκBα 단백질의 발현량을 유의하게 증가시켰고, EGS는 1000㎍/㎖에서 증가된 p-IκBα 단백질의 발현을 유의미하게 감소시켰다. 또한 LPS에 의해 NF-κB 발현이 증가되었는데, EGS 1000㎍/㎖의 농도에서 증가된 NF-κB의 발현을 유의하게 감소시켰다.
-
LPS는 p38과 ERK의 인산화를 대조군에 유의하게 증가시켰으나, EGS를 처치한 군에서는 유의미한 감소를 보여주지 못했다. JNK 인산화 역시 LPS 군에서는 대조군에 비해 유의하게 증가시켰으나, EGS 처치군에서는 유의미한 감소를 나타내지 못했다.
이로써 EGS은 세포 독성 없이 NO의 생성과 염증성 cytokine의 발현을 억제하고, MAPK pathway보다 NF-κB pathway의 활성을 억제하여 항염증 효과를 보인다는 것을 알 수 있다.






