Ⅰ. 서 론
피부 노화는 시간의 경과와 함께 발생하는 퇴행성 변화에 따른 내인성 노화와 주로 광노화로 인해 발생하는 외인성 노화로 나눌 수 있고, 내인성 노화보다는 외인성 노화가 더 결정적인 역할을 한다고 알려져 있다. 자외선은 외인성 노화의 주된 원인으로 활성산소 및 염증성 사이토카인의 발현을 증가시켜 교원질 및 탄력섬유 등 기질 단백질이 손상되어 피부 내 교원질의 양이 부족해지고 탄력섬유가 변성되어 피부 건조, 위축, 탄력 감소, 주름 등 피부노화를 일으킨다1-4). 한의학에서 피부노화는 장부의 기능, 경락, 기혈과의 관계에서 설명하고 있고, 그 원인으로 火, 熱, 痰, 瘀血 등이 중요한 역할을 하고 있다1). 최근 피부 노화와 관련하여 한방 처방이나 개별 한약재를 이용한 연구가 활발히 진행되고 있다5-8).
平肝開鬱止血湯은 《傅靑主男女科》에 수록된 처방으로 白芍藥, 白朮, 當歸, 牧丹皮, 生地黃, 甘草, 三七根, 荊芥穗, 柴胡로 구성되어 과도한 스트레스로 발생한 肝氣鬱結 증상과 그로 인한 血崩에 사용하는 처방이다9). 본 저자는 肝의 정상적인 생리기능인 肝藏血, 肝主疏泄 기능의 장애로 기혈순환이 제대로 이루어지지 않아 발생한 瘀血과 火熱이 피부를 건조시키고 피부노화를 촉진시킨다고 생각하였다. 이에 본 연구에서는 補血, 凉血, 淸熱의 효능이 있는 平肝開鬱止血湯이 항염증, 항산화 및 항노화 효과가 있을 것으로 판단하여 실험을 진행하였다. 平肝開鬱止血湯에 대한 최근 연구로는 간기능 장애10), 간조직 손상 방지11), 瘀血12) 등에 대해 보고되었으나 항염증, 항산화 및 항노화에 대한 연구는 없었다.
본 연구에서는 RAW 264.7 대식세포를 lipopolysaccharide(LPS)로 자극시킨 후 平肝開鬱止血湯 추출물의 항염증 활성과 항산화 활성 및 항노화 활성을 관찰하여 유의성 있는 결과를 얻었기에 보고하는 바이다.
Ⅱ. 실험방법
平肝開鬱止血湯에 사용되는 약재는 ㈜옴니허브(대구, Korea)에서 구매하여 사용하였으며, 구입한 약재들은 다음과 같다(Table 1).
平肝開鬱止血湯 한약재 1첩 분량을 혼합하여 3차 증류수 1,000㎖와 함께 넣은 뒤 heating mantle (MS-DM607, M-TOPS, Korea)을 이용하여 4시간 동안 가열하고 6시간 동안 냉각시켜 추출하였다. 추출물은 거즈로 1차 여과한 후 여과지로 2차 여과를 하였고, 여과액을 감압농축(CH-9230 Flawil 1, BUCHI Switzerland)하여 100㎖ 농축액을 얻었다. 농축액은 –80℃ 냉동고(MDF-U52V, Sanyo, Japan)에 얼린 후 동결건조기(#77520-03, LABCCONCO, USA)를 이용하여 건조분말(21.5g, 회수율 13.0%)을 얻어 시료로 사용하였다.
본 연구에서 사용한 세포주인 RAW 264.7 macrophage cells는 ATCC(American Type Culture Collection)에서 구입하여 사용하였다. 배양시 배지는 10% fetal bovine serum(FBS; GenDEPOT, USA)과 1% penicillin/streptomycin(GenDEPOT, USA)이 첨가된 Dulbecco’s modified eagle’s medium(DMEM; GenDEPOT, USA)을 사용하였으며 37℃, 5% CO₂ incubator(MCO-17AIC, Sanyo, JAPAN)에서 배양하였다.
平肝開鬱止血湯 추출물에 의한 세포독성과 생존율을 알아보기 위하여 MTT assay를 실행하였다14). 96 well plate에 1×10⁵ cells/well의 cell을 100㎕씩 넣고 37℃, 5% CO₂가 공급되는 배양기에서 24시간 동안 배양한 후 배지를 버리고 배양세포 표면을 1×PBS 용액으로 씻어주었다. 같은 양의 배지와 PBS에 녹인 시료를 농도별(각각 62.5, 125, 250 및 500㎍/㎖)로 각 well에 처리하고 24시간 배양하였다. 배양이 끝난 후 PBS에 녹인 1㎍/㎖ MTT(Sigma, USA)를 100㎕씩 각 well에서 처리하여 알루미늄 호일로 차광시킨 뒤 2시간 동안 같은 조건에서 배양하였다. 배양액을 모두 제거한 후 DMSO를 100㎕ 처리하고 37℃에서 2시간 방치한 다음 microplate reader를 이용하여 570㎚에서 흡광도를 측정하였다. 세포 생존률은 다음과 같은 공식으로 계산되었다.
AT: absorbance of tested extract solution
AC: absorbance of control
Lipopolysaccharide(LPS, Sigma, USA)로 염증이 유도된 RAW 264.7 macrophage cells를 사용하여 NO의 생성능을 측정하였다15). RAW 264.7 macrophage cells를 96 well plate에 1×10⁵ cells/well로 분주한 후 24시간 동안 37℃, 5% CO₂ incubator에 보관하여 안정화 시켰다. 상층액 제거 후 각각 62.5, 125, 250, 500 및 1,000㎍/㎖의 平肝開鬱止血湯과 LPS 1㎍/㎖를 동시에 처리하여 배양하였다. 24시간 뒤 상층액 100㎕을 다른 96 well plate에 옮겨준 뒤 Griess 시약 100㎕를 혼합해 주었다. 상온에서 30min 동안 반응 후 색차계(Spectrophotometer CM-2600d, Minolta, Japan)를 이용하여 540㎚에서 흡광도를 측정하였다.
PGE₂ assay kit(Amersham Bioscience, USA)를 이용하여 PGE₂ 함량을 측정하였다16). 96 well plate에 검액과 표준액을 50㎕씩 넣고 working antibody와 working conjugate를 순서대로 50㎕/well로 넣은 다음 상온에서 1시간 반응시켰다. 이어서 상층액을 버리고 wash buffer로 4회 세척한 다음 TMB substrate를 150㎕/well로 넣고 10분간 반응시켜 ELISA reader를 이용하여 630㎚에서 흡광도를 측정하였다.
RAW 264.7 macrophage cells에서 平肝開鬱止血湯 추출물의 iNOS, COX-2 및 IL-6의 발현억제 효과를 확인하기 위해서 qRT-PCR 분석을 진행하였다17). 6 well plate에 5×10⁵ cells/well로 분주한 뒤 24시간 동안 37℃, 5% CO₂ incubator에서 안정화시켰다. 24시간 뒤 각각 62.5, 125, 250 및 500㎍/㎖의 平肝開鬱止血湯과 LPS 1㎍/㎖를 동시에 처리하여 배양하였다. 24시간 뒤 Trizol reagent(Ambion, USA)를 사용하여 RNA를 추출하였다. 추출된 RNA는 diethyl pyrocarbonate (DEPC treated-water; Sigma, USA)로 용해하여 사용하였고, total RNA를 정량 후 cDNA 합성 kit(Revetra ACE-α-; Toyobo, Japan)를 통해 cDNA를 합성하였다. cDNA 합성 후 tagman master mix(Thermo fisher, USA) 10㎕, 멸균수 4㎕, cDNA 5㎕를 혼합하여 준비하였다. 실험에 사용된 primer의 sequence는 Table 2와 같다.
2, 2-diphenyl-1-picrylhydrazyl(DPPH, Sigma, USA) 용액으로 平肝開鬱止血湯 추출물의 radical 소거 능력을 실험하였다18). 각 시료 0.5㎖에 100mM DPPH 3㎖를 넣고 vortex한 후 15분 동안 실온의 명반응 조건에서 반응시킨 후 517㎚에서 흡광도를 측정하였다. DPPH radical 소거능은 다음 식으로 나타내었다.
ABTS radical을 이용한 항산화능의 측정은 potassium persulfate와의 반응에 의해 생성된 ABTS 유리 radical이 추출물 내의 항산화물질에 의해 제거되어 radical 특유의 색인 청록색이 탈색되는 것을 이용하여 측정하였다19). 7mM ABTS 용액에 potassium persulfate를 2.4mM이 되도록 용해시킨 다음 어두운 곳에서 14-16시간 동안 반응시켰다. 이를 414㎚에서 흡광도가 1.5가 되도록 증류수로 조정한 후 추출물 1.0㎖를 가하여 실온에서 10분간 반응시켜 414㎚에서 흡광도를 측정하였다.
Collagenase 저해 효과 측정은 Wünsch와 Heidrich의 방법20)을 이용하여 측정하였다. 0.1M Tris-HCl buffer(pH 7.5)에 4mM CaCl₂를 첨가형 제조한 용액과 시료 추출물 0.1㎖, 4-phenylazobenzyl oxycarbonyl-Pro-Leu-Gly-Pro-D-Arg(0.3㎎/㎖) 농도의 기질용액 0.25㎖를 혼합한 후 0.2㎎/㎖ collagenase(Sigma-Aldrich Co. Louis, MO, USA) 농도의 효소 용액 0.15㎖를 첨가하였다. 시약 반응은 실온에서 20분간 반응시킨 후 0.5㎖의 6% citiric acid 종료 시약을 넣어 반응을 정지시키고 ethyl acetate 2㎖를 첨가하여 320㎚의 파장에서 흡광도를 측정하였다.
Elastase 활성은 Kranusoe 등의 방법21)을 이용하여 측정하였다. Elastase 활성 억제를 평가하기 위하여 추출물 0.1㎖와 1㎖의 0.2M Tris-HCl buffer(pH 8.0), 0.1㎖의 0.8mM N-succinyl-(Ala)3-p-nitroanilide 기질 용액을 혼합하고, 1.0U/㎖ porcine pancreatic elastase(Sigma-Aldrich Co. Louis, MO, USA) 농도의 효소 0.1㎖을 첨가하여 37℃의 water bath에서 20분간 반응을 시켜 p-nitroaniline 생성량을 410㎚의 파장에서 흡광도를 측정하였다.
Tyrosinase 활성 측정은 Vanni 등의 방법22)을 이용하여 측정하였다. 추출물 0.2㎖와 0.1 M Sodium phosphate buffer(pH 6.8) 용액 2.3㎖, 1.5mM L-tyrosine 농도의 기질 용액 0.4㎖를 혼합하고, Mushroom tyrosinase(Sigma-Aldrich Co, Louism MO, USA, 250U/㎖) 0.1㎖를 넣고 37℃의 water bath에서 20분간 반응을 시킨 후 475㎚의 파장에서 흡광도를 측정하였다.
L-Dopa oxidation 측정은 Joshi 등의 방법23)을 이용하여 측정하였다. 96-well plate에 추출물 50㎖씩 넣은 후, Mushroom tyrosinase 333U/㎖ 30㎕ 넣고 0.1 M potassium phosphate buffer(pH 6.8) 60㎕를 첨가하고 5분간 반응시킨다. 반응시킨 추출물에 12mM L-DOPA solution 100㎕를 첨가 후 492㎚에서 흡광도 값을 측정하였다.
Ⅲ. 실험 결과
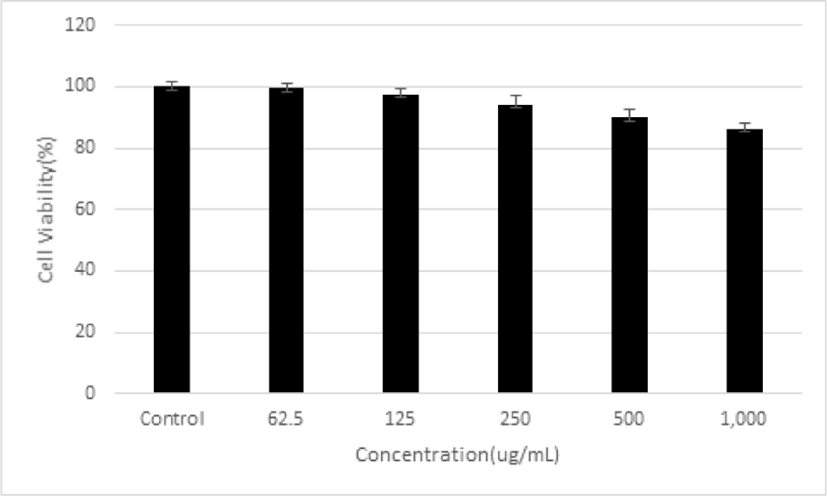
平肝開鬱止血湯 추출물을 안전하게 이용할 수 있는 농도 범위를 확인하기 위하여 세포독성 연구를 수행하였다. 平肝開鬱止血湯 추출물을 62.5, 125, 250, 500 및 1,000㎍/㎖로 처리하였을 때, 세포 생존율은 대조군에 비해서 99.39±1.70%, 97.32±2.00%, 94.07±3.06%, 89.85±2.53% 및 86.29±1.64%로 세포 생존율을 나타냈다. 이러한 결과로 平肝開鬱止血湯 추출물은 62.5, 125, 250, 500 및 1,000㎍/㎖ 농도까지 20% 이상의 세포 생존율 감소가 없음을 확인하였다(Fig. 1).
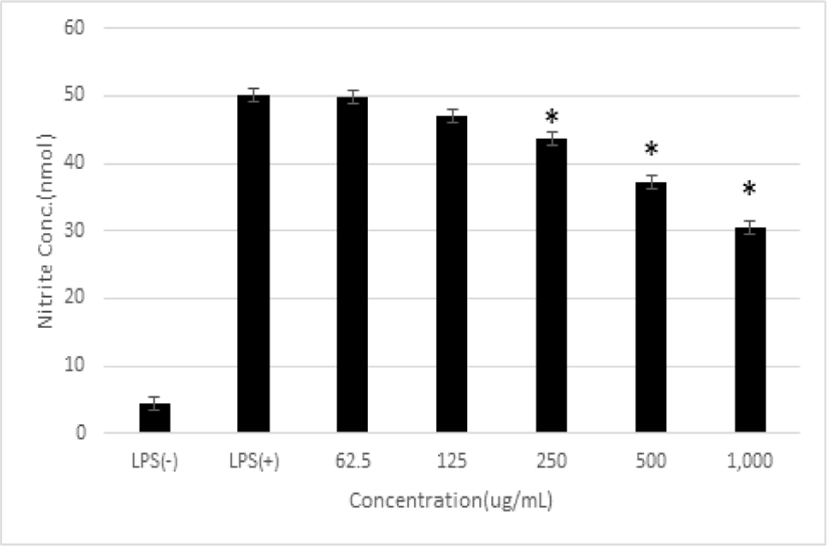
RAW 264.7 macrophage cells에서의 NO 생성에 대한 平肝開鬱止血湯 추출물의 저해 효과를 측정하였다. 平肝開鬱止血湯 추출물을 62.5, 125, 250, 500 및 1,000㎍/㎖로 처리하였을 때 NO 생성율은 49.7± 1.6%, 47.1±3.0%, 43.7±1.8%, 37.3±2.9% 및 30.5±2.6%로 나타났다. 平肝開鬱止血湯 추출물 250, 500 및 1,000㎍/㎖ 농도의 경우 통계학적으로 유의한 수준으로 NO 생성이 감소함을 확인하였다(p<0.05) (Fig. 2).
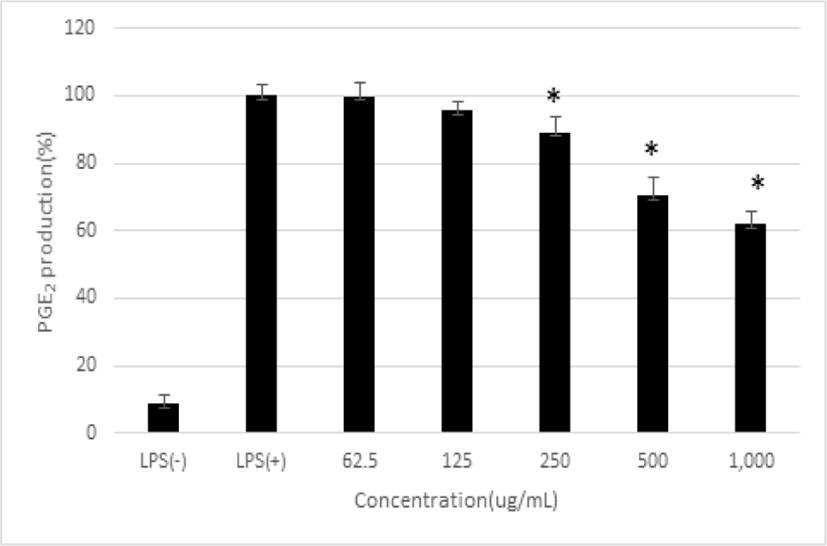
RAW 264.7 macrophage cells에서의 NO 생성에 대한 平肝開鬱止血湯 추출물의 저해 효과를 측정하였다. 平肝開鬱止血湯 추출물을 62.5, 125, 250, 500 및 1,000㎍/㎖로 처리하였을 때 PGE₂ 생성율은 99.84± 3.98%, 95.49±2.94%, 89.05±4.59%, 70.24± 5.71% 및 61.88±3.90%로 나타났다. 平肝開鬱止血湯 추출물의 농도가 250, 500 및 1,000㎍/㎖ 농도의 경우 통계학적으로 유의한 수준으로 PGE₂ 생성이 감소함을 확인하였다(p<0.05)(Fig. 3).
平肝開鬱止血湯 추출물의 항염증 효능을 연구하기 위하여, RAW 264.7 macrophage cells에 LPS를 처리하여 염증을 유발시키고 平肝開鬱止血湯 추출물을 농도별로 각각 처리한 후, 염증성 사이토카인들의 분비량을 측정하였다.
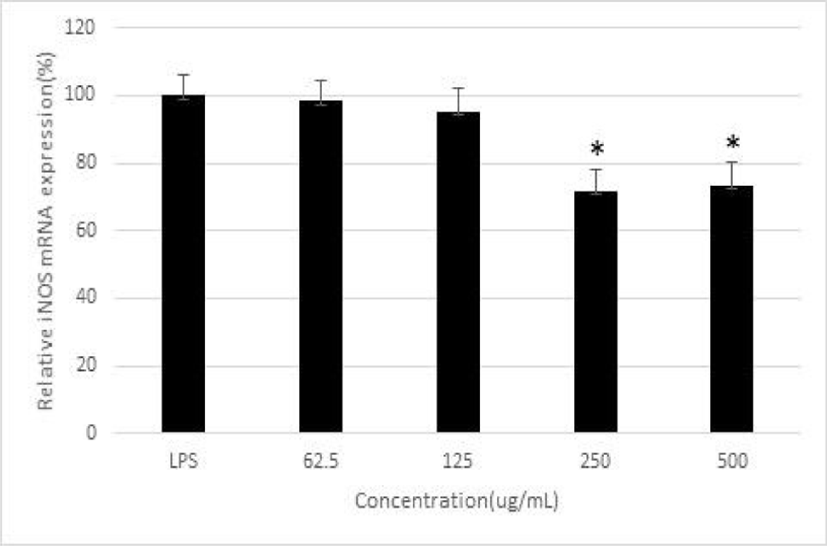
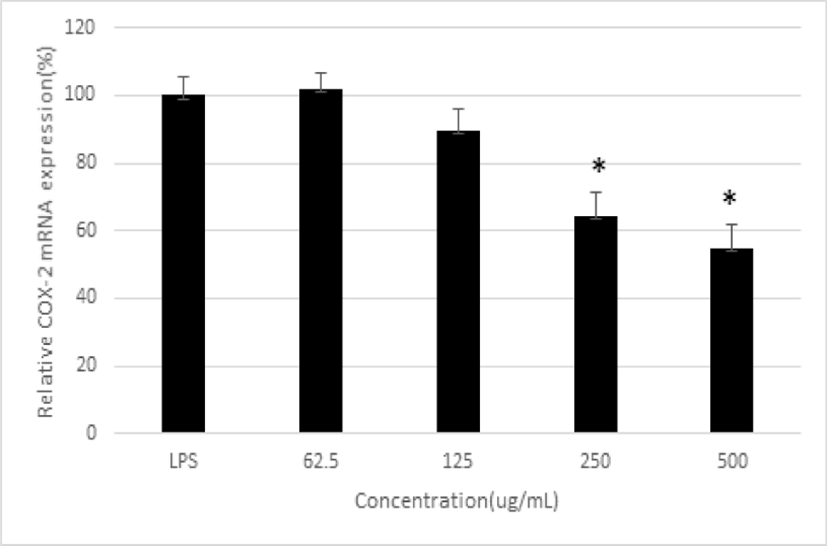
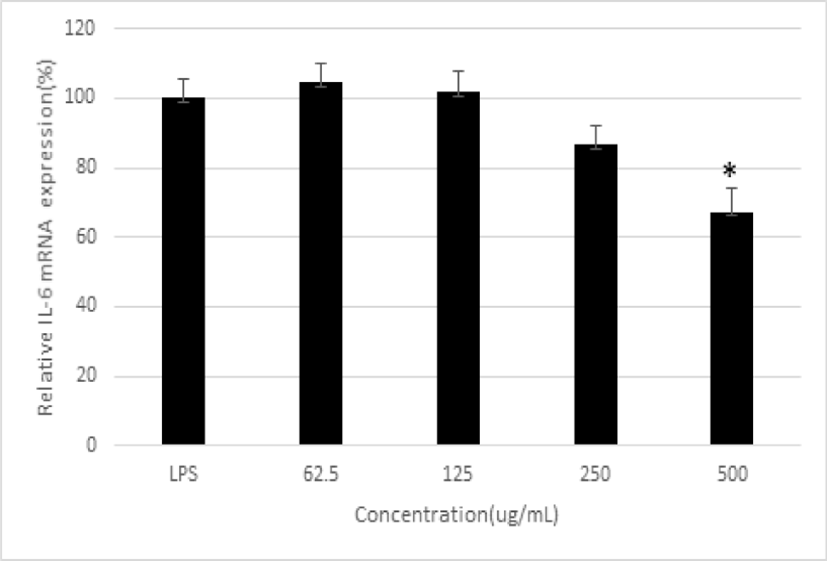
LPS로 자극하여 생성된 iNOS mRNA 발현은 平肝開鬱止血湯 추출물 250 및 500㎍/㎖ 농도에서 유의하게 감소하였고, COX-2 mRNA의 발현은 平肝開鬱止血湯 추출물 250 및 500㎍/㎖ 농도에서 유의하게 감소하였다. 그리고, IL-6 mRNA 발현은 平肝開鬱止血湯 추출물 500㎍/㎖ 농도에서 유의하게 감소하였다(p<0.05)(Fig. 4-6).
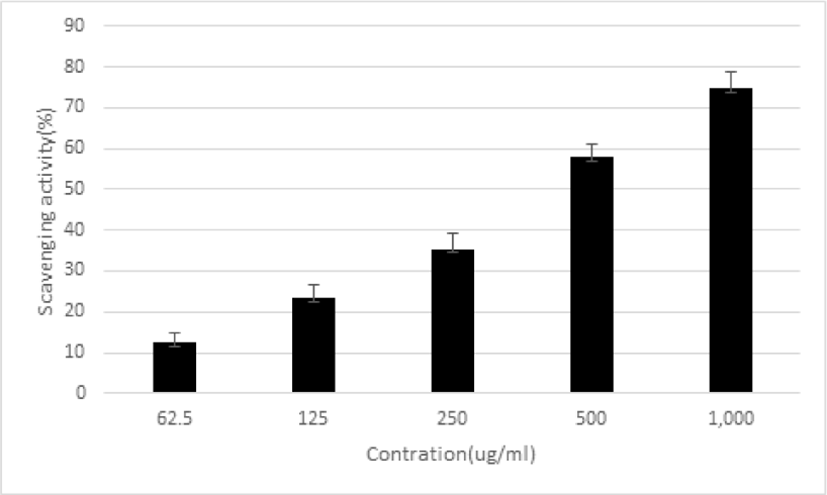
平肝開鬱止血湯 추출물의 항산화 작용을 확인하기 위해 DPPH를 사용하여 raidcal 소거율을 측정하였다. 平肝開鬱止血湯 추출물을 농도별로 62.5, 125, 250, 500 및 1,000㎍/㎖로 처리한 결과 radical 소거율이 12.56±2.47%, 23.58±3.05%, 35.39±3.98%, 57.74 ±3.16% 및 74.84±4.01%로 농도 의존적으로 증가함을 나타냈다(Fig. 7).
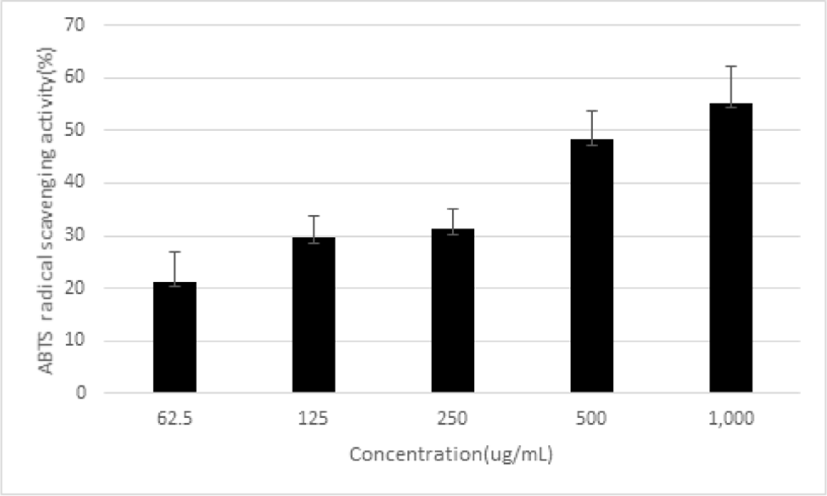
ABTS를 사용하여 radical 소거율을 측정하였다. 平肝開鬱止血湯 추출물을 농도별로 62.5, 125, 250, 500 및 1,000㎍/㎖로 처리한 결과, radical 소거율이 21.28±3.54%, 29.67±4.12%, 31.28±3.88%, 48.24 ±5.59% 및 55.32±6.98%로 농도 의존적으로 증가함을 나타냈다(Fig. 8).
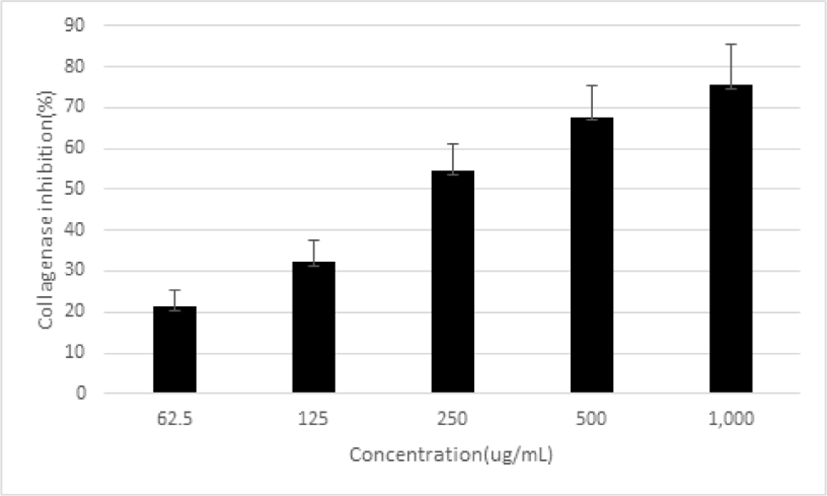
피부노화 억제 효과를 확인하기 위하여 collagenase 억제율을 측정하였다. 平肝開鬱止血湯 추출물을 농도별로 62.5, 125, 250, 500 및 1,000㎍/㎖로 처리한 결과, 억제율이 21.25±4.24%, 32.18±5.32%, 54.39 ±6.67%, 67.75±7.57% 및 75.44±9.92%로 농도 의존적으로 증가함을 나타냈다(Fig. 9).
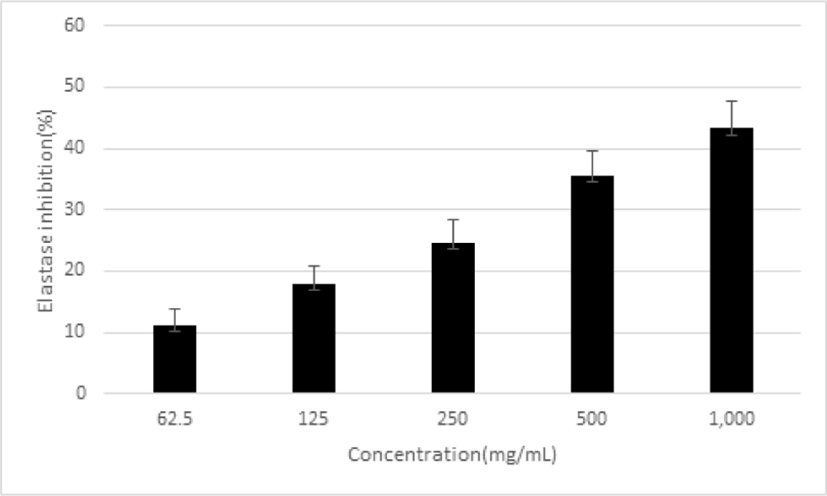
피부노화, 특히 주름에 대한 개선 효과를 확인하기 위하여 elastase 억제율을 측정하였다. 平肝開鬱止血湯 추출물을 농도별로 62.5, 125, 250, 500 및 1,000㎍/㎖로 처리한 결과, 억제율이 11.18±2.64%, 11.89± 2.97%, 24.48±3.85%, 35.54±4.09% 및 43.25± 4.48%로 농도 의존적으로 증가함을 나타냈다(Fig. 10).
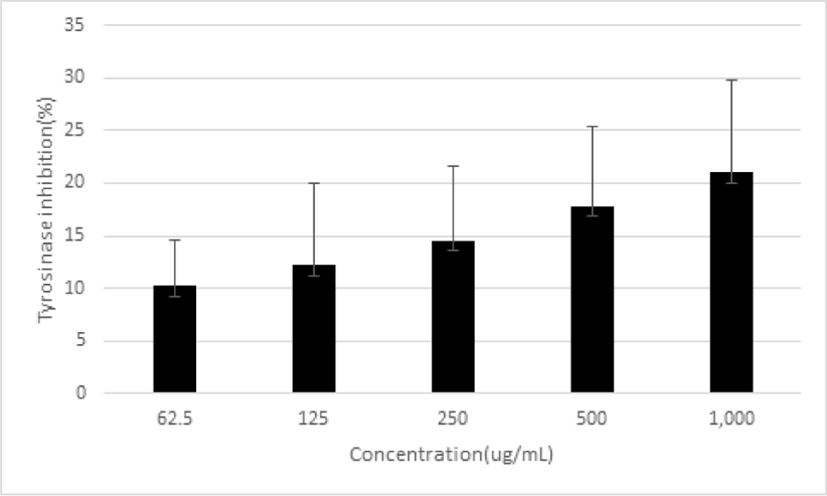
피부에 대한 미백 효과를 확인하기 위하여 tyrosinase 억제율을 측정하였다. 平肝開鬱止血湯 추출물을 농도별로 62.5, 125, 250, 500 및 1,000㎍/㎖로 처리한 결과, 억제율이 10.21±4.35%, 12.21±7.78%, 14.57±6.99%, 17.86±7.52%, 20.99±8.87%로 농도 의존적으로 증가함을 나타냈다(Fig. 11).
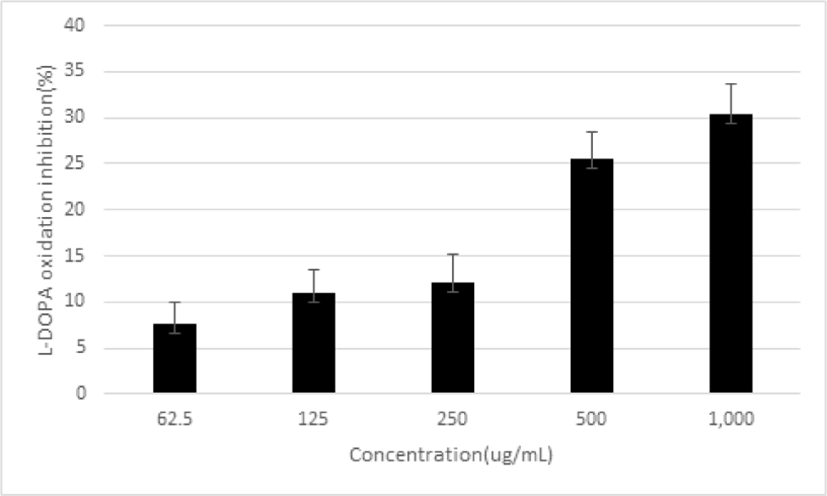
L-DOPA oxidation 억제율을 측정하였다. 平肝開鬱止血湯 추출물을 농도별로 62.5, 125, 250, 500 및 1,000㎍/㎖로 처리한 결과, 억제율이 7.64±2.25%, 10.98±2.45%, 12.12±3.01%, 25.57±2.88% 및 30.36±3.36%로 농도 의존적으로 증가함을 나타냈다(Fig. 12).
Ⅳ. 고 찰
현대인들은 과학기술의 발달로 인해 사회적, 경제적으로 풍요로운 삶을 누리고 있으며, 이로 인해 건강뿐만 아니라 외적 아름다움에 대한 관심이 증가하면서 피부노화에 대한 관심이 높아지고 있다. 피부노화는 시간의 경과에 따라 체내 단백질 특성 변화 및 생합성 감소 등이 발생하는 내인성 노화와 환경적 요인, 자외선 등 인체 외부 요인으로 인한 외인성 노화로 나눌 수 있다. 자외선은 외인성 노화에서 가장 많은 비중을 차지한다. 자외선은 활성산소종과 염증성 사이토카인의 발현을 증가시켜 MMP의 생성을 증가시켜 콜라겐, 엘라스틴의 분해를 증가시킨다. 분해된 콜라겐과 엘라스틴은 분절화되고 탄력성을 잃어 피부노화 증상들이 발생하게 된다1-4).
한의학에서 피부노화는 장부의 기능, 경락, 기혈과의 관계에서 설명하고 있고, 그 원인으로 火, 熱, 痰, 瘀血 등이 중요한 역할을 하고 있다1). 활성산소종과 염증성 사이토카인은 한의학적으로 瘀血 혹은 痰飮으로 볼 수 있다. 瘀血, 痰飮은 氣, 血, 津液, 精과 같은 인체 구성 물질의 대사과정 중 발생한 노폐물로 볼 수 있는데, 이러한 노폐물이 쌓이면 염증반응을 일으키게 된다. 자외선과 활성산소 및 염증성 사이토카인 등이 피부노화의 중요한 원인으로 알려지면서 활성산소를 제거하고 염증을 억제하여 피부노화를 예방하고 지연시킬 수 있는 항염증, 항산화 및 항노화 효과를 갖는 한방 처방이나 개별 한약재를 이용한 연구5-8)가 활발히 진행되고 있고, 천연 한방소재 기능성 제품 개발에 대한 관심이 고조되고 있다.
平肝開鬱止血湯은 ≪傅靑主男女科≫에 수록된 처방으로 白芍藥, 白朮, 當歸, 牧丹皮, 生地黃, 甘草, 三七根, 荊芥穗, 柴胡로 구성되어 과도한 스트레스로 발생한 肝氣鬱結 증상과 그로 인한 血崩에 사용하는 처방이다9). 平肝開鬱止血湯의 구성약물 중 白芍藥은 養血柔肝하고 斂陰하는 효능이 있어 피부에 영양을 滋養하며 陰에 해당하는 津液을 수렴시키는 역할을 하고, 白朮은 生津, 化濁하는 효능이 있어 津液을 자양하고 탁한 瘀血이나 痰飮을 삭히는 역할을 하고, 當歸는 補血和血하고 潤操하는 효능이 있어 血을 補하고 血이 과도하거나 부족한 인체 대사 기능을 和하며 潤하는 역할을 하고, 牧丹皮는 潤操, 消瘀, 活血散瘀하는 효능이 있어 滋潤하고 血의 운행을 활발히 하여 瘀血을 삭히거나 없애는 역할을 하고, 生地黃은 生津, 滋陰, 淸熱하는 효능이 있어 津液을 滋養하고 염증성 반응이나 물질인 熱을 제거하는 역할을 하고, 三七根은 消腫하는 효능이 있어 瘀血이나 痰飮을 삭히는 역할을 한다. 본 연구에서는 肝의 정상적인 생리기능인 肝藏血, 肝主疏泄 기능의 장애로 기혈순환이 제대로 이루어지지 않아 발생한 瘀血과 火熱이 피부를 건조시키고 피부노화를 촉진시킨다고 생각하고 영양 기능을 담당하는 血과 자윤 기능을 담당하는 津液 補하고 염증성 반응인 熱을 淸하는 平肝開鬱止血湯을 선택하여 항염증, 항산화 및 항노화 효과에 대한 실험을 진행하였다.
연구에서 사용한 RAW 264.7 대식세포주는 항염증 약물의 효능을 확인하고 염증 매개물질의 합성과 이를 매개하는 신호전달경로의 억제효능을 가진 약물을 평가하기 위해 많이 사용되는 실험 모델이다24). 平肝開鬱止血湯 추출물의 세포독성과 생존율을 알아보기 위하여 MTT assay를 실행하였다. LPS로 염증반응을 유도한 RAW 264.7 cell에서 농도별로 平肝開鬱止血湯 추출물을 처리하여 세포 생존율에 미치는 영향을 살펴본 결과, 62.5, 125, 250, 500 및 1,000㎍/㎖ 농도까지 20% 이상의 세포 생존율 감소가 없었다. 따라서 이 범위 내의 平肝開鬱止血湯 추출물을 이용하여 나머지 실험을 진행하였다.
平肝開鬱止血湯 추출물의 항염증 활성을 알아보기 위해 NO 생성, PGE₂ 생성 및 염증성 사이토카인들의 분비량을 측정하였다. NO는 L-arginine에서 합성되는 free radical로서 활성화된 대식세포에서 iNOS에 의해 과도하게 생성된 NO는 활성산소종을 생성하여 정상세포의 손상을 초래하는 염증 매개 물질로서 작용한다25,26). NO 생성에 대한 저해 효과를 측정한 결과, 平肝開鬱止血湯 추출물은 250, 500 및 1,000㎍/㎖ 농도에서 통계학적으로 유의하게 NO의 생성을 억제하였고, 250 및 500㎍/㎖ 농도에서 iNOS mRNA 발현을 감소시켰다. 이는 平肝開鬱止血湯 추출물이 iNOS mRNA 발현을 억제함으로써 NO의 생성을 억제하였음을 나타낸다.
PGE₂는 COX-2에 의해 arachidonic acid로부터 혈관 투과성의 증가를 유발해 염증으로 인한 주요 증상인 부종, 발열, 통증 등을 발생시킨다27,28). PGE₂ 생성에 대한 저해 효과를 측정한 결과, 平肝開鬱止血湯 추출물은 250, 500, 1,000㎍/㎖ 농도에서 통계학적으로 유의하게 PGE₂ 생성을 억제시켰고, 250 및 500㎍/㎖ 농도에서 COX-2 mRNA 발현을 감소시켰다. 이는 平肝開鬱止血湯 추출물이 COX-2 mRNA 발현을 억제함으로써 PGE₂의 생성을 억제하였음을 나타낸다.
IL-6는 대표적인 염증성 사이토카인의 한 종류이며, 주로 대식세포와 T 세포에 의해 생산되어 감염 또는 조직의 손상과 같은 자극에 조기 반응하는 사이토카인으로 초기 면역반응과 급·만성 염증의 핵심 매개 인자의 하나이다29). 본 연구에서 平肝開鬱止血湯 추출물은 500㎍/㎖에서 IL-6 mRNA의 발현을 감소시켰다. 이는 平肝開鬱止血湯 추출물이 IL-6 mRNA의 발현을 억제하여 염증을 조절할 수 있음을 의미한다.
平肝開鬱止血湯 추출물의 항산화 활성을 알아보기 위해 DPPH와 ABTS를 이용하여 radical 소거 활성을 평가하였다. DPPH는 매우 안정화된 자색의 free radical로서 항산화 물질에 의해 노란색으로 탈색되는 것을 육안으로 쉽게 관찰할 수 있어 항산화력을 평가하는데 자주 사용된다30). DPPH를 사용하여 radical 소거율을 측정한 결과, 平肝開鬱止血湯 추출물은 농도 의존적으로 높은 경향의 DPPH radical 소거능이 있음을 확인하였다. ABTS를 이용한 측정법은 양이온 radical을 소거하는 것으로 투명에 가까운 시약이 청록색으로 탈색되는 것을 흡광도 측정으로 쉽게 관찰할 수 있어 항산화력을 평가하는데 자주 사용된다31). ABTS를 사용하여 radical 소거율을 측정한 결과, 平肝開鬱止血湯 추출물은 농도 의존적으로 높은 경향의 ABTS radical 소거능이 있음을 확인하였다.
平肝開鬱止血湯 추출물의 항노화 활성을 알아보기 위해 collagenase 저해 활성, elastase 저해 활성, tyrosinase 저해 활성, L-DOPA oxidation 억제 활성을 평가하였다. 콜라겐은 세포외 기질(extracellular matrix, ECM)의 주요 구성 성분으로 피부에 결함성과 탄력을 부여하여 외부의 자극으로부터 피부를 보호하는 역할을 한다. 피부 구조 중 진피층의 90%를 차지하고 있어 콜라겐의 감소는 피부의 노화와 밀접한 관계를 가진다32). Collagenase는 collagen의 펩타이드 결합을 끊는 효소로 平肝開鬱止血湯 추출물은 농도 의존적으로 높은 경향의 collagenase 생성 억제 효능이 있음을 확인하였다.
Elastase는 피부 탄력을 유지하는 세포외 기질 구성 단백질 중 하나인 elastin을 분해하며, collagen을 포함한 다양한 단백질을 분해할 수 있는 비특이적 가수분해 효소이다33). 그러므로 피부노화의 주원인 중의 하나인 elastin 분해효소인 elastase 활성을 저해시킴으로써 피부 결합 조직을 유지시켜, 탄력을 유지하고 피부가 처지는 것을 예방할 수 있는 것으로 알려져 있다34). 본 연구에서 平肝開鬱止血湯 추출물은 농도 의존적으로 높은 경향의 elastase 생성 억제 효능이 있음을 확인하였다.
Tyrosinase는 L-tyrosine의 수산화 반응을 촉매하여 L-DOPA로의 전환 및 L-DOPA를 L-DOPA- quinone으로 산화시켜 멜라닌 합성을 조절한다35). 따라서 tyrosinase 활성을 억제하는 것은 피부 미백과 피부노화에 매우 중요하다. 이에 平肝開鬱止血湯 추출물은 tyrosinase 생성과 L-DOPA oxidation을 농도 의존적으로 억제 효능이 있음을 확인하였다.
이상의 실험 결과 平肝開鬱止血湯 추출물은 전반적으로 우수한 항염증 효과와 항산화 및 항노화 관련 효소의 활성 억제효과를 보였다. 그러나 임상이나 한방 소재 기능성 제품으로 활용하기 위해서는 동물 모델에서의 추가적인 연구와 자세한 기전 연구 및 平肝開鬱止血湯을 구성하는 개별 약물들의 효능과 복합 처방의 효능의 비교가 필요할 것으로 생각된다.
Ⅴ. 결 론
LPS로 유도된 RAW 264.7 대식세포에서 平肝開鬱止血湯 추출물의 항염증 활성과 항산화 활성 및 항노화 활성을 평가한 결과, 다음과 같은 결론을 얻었다.
-
平肝開鬱止血湯 추출물은 250 및 500㎍/㎖ 농도에서 LPS에 의해 증가한 iNOS mRNA의 발현을 유의하게 감소시켰고, 250, 500 및 1,000㎍/㎖ 농도에서 NO 생성을 유의하게 억제하였다.
-
平肝開鬱止血湯 추출물은 250 및 500㎍/㎖ 농도에서 LPS에 의해 증가한 COX-2 mRNA의 발현을 유의하게 감소시켰고, 250, 500 및 1,000㎍/㎖ 농도에서 PGE₂ 생성을 유의하게 억제하였다.
-
平肝開鬱止血湯 추출물은 500㎍/㎖ 농도에서 LPS에 의해 증가한 IL-6 mRNA의 발현을 유의하게 감소시켰다.
-
平肝開鬱止血湯 추출물은 DPPH radical 소거능 및 ABTS radical 소거능을 농도 의존적으로 증가시켰다.
-
平肝開鬱止血湯 추출물은 농도 의존적으로 collagenase, elastase, tyrosinase와 L-DOPA oxidation 생성을 억제하였다.
본 논문은 2023년도 세명대학교 박사학위 졸업논문입니다.