Ⅰ. 서 론
피부 진피 내 망상층의 교원섬유를 구성하는 Ⅰ형 콜라겐의 감소는 피부노화의 주된 원인으로 알려져 있다1). 이러한 피부 콜라겐은 80대가 되면 20대의 65%로 감소되어 내인성 피부노화의 원인이 되고 있다. 또한 세포간 지질(ceramide)의 감소는 표피와 진피의 결합을 완화함으로써 피부탄력저하의 원인이 되며, 유극세포의 감소는 표피세포의 회전율(turn over)을 줄여 기미 등의 원인이 되기도 한다2). 내인적 원인과 더불어 자외선 등 외인적 요인은 피부노화를 촉진하게 된다. UVA(320-400㎚)와 UVB(290-320㎚)의 경우 산화적 손상3)과 섬유아세포의 matrix metalloproteinase(MMP) 생성을 유도하고 세포외 기질을 분해하여 주름을 생성한다4). 노화의 주원인인 산화적 손상을 억제할 수 있는 활성물질로는 수용성으로 vitamin C와 B12등이 알려져 있고 지용성으로는 천연성분인 라이코펜(lycopene), 베타-카로틴(beta- carotene) 등이 잘 알려져 있다5). 또한 피부노화의 억제를 위해 에스트로젠의 투여는 피부의 콜라겐 증가뿐만 아니라 히아루론산(hyaluronic acid) 합성을 높여 보습성을 향상시킨다는 보고가 있다6). 본 연구에서는 고령자의 항노화 기능성 제품 수요 증가에 따른 피부노화억제 기능성소재 개발의 일환으로 전통 한의학 소재를 문헌적으로 탐색하고, 한의학적 원리가 잘 반영되는 처방을 연구의 소재로 선정하였다. 瓊玉膏는 “補百損, 除百病, 萬神俱足, 五臟盈溢, 髮白復黑, 齒落更生”로 백가지 부족함을 보하고, 백병을 치료하며, 온갖 신(神)이 모두 충족되고 오장의 기가 차고 넘쳐 백발이 검게 되고 치아가 튼튼해진다고 東醫寶鑑 內徑 身形에 기록되어 있다7). 瓊玉膏는 보혈강장 및 허약체질 개선, 항노화 등 한의약 임상에서 널리 사용되고 있을 뿐만 아니라, 건강기능식품으로도 선호도가 높아 다양한 제품이 출시되고 있다. 한 등8)은 瓊玉膏의 임상효능에 관한 체계적 문헌 고찰연구를 통해 7개의 데이터베이스에서 308편의 논문을 검색하였고 그중 세포나 동물실험연구, 가미방등을 제외하고 순수한 瓊玉膏의 인간 대상 임상연구 최종 5편을 선정하여 문헌 분석을 실시하였다. 이에 따르면 경옥고 투여군에서 심폐지구력을 향상9), 피로 회복능력을 증가10), 노화 억제11,12), 결핵 환자의 면역능 향상13) 등의 임상적 의의를 체계적 문헌 분석을 통해 확인하였다. 이와 같이 한의약 처방과 기능성식품으로 이용가치가 높은 瓊玉膏의 피부노화 억제 활성에 관한 과학적 기전을 밝히기 위해 본 연구를 수행하게 되었다. 먼저 인간피부아세포를 활용하여 세포독성과 콜라겐 합성능을 평가하고, MMP-1 활성저해 효과를 실험하였다. 이와 더불어 예쁜꼬마선충(C. elegans)을 이용한 열적 스트레스 저항성 실험과 산화적 스트레스 저항성 실험을 실시하여 유의한 결과를 얻었다. 또한 UV를 조사한 무모쥐(Hairless mouse, SKH-1)의 주름형성 억제 효과와 이의 기전을 확인하기 위하여, 콜라겐 분해를 증가시키는 mmp-1, mmp-9 유전자의 억제 여부와, 콜라겐 생성을 유도하는 procollagen-1, procollagen-3 유전자의 증가여부를 확인하여 瓊玉膏의 피부 노화를 억제 기전을 탐색하였다.
Ⅱ. 재료 및 방법
실험에 사용된 人蔘(Ginseng Radix, Panax ginseng, 두릅나무과 Araliaceae), 地黃(Rehmanniae Radix Recens, Rehmannia glutinosa, 현삼과, Scrophulariaceae), 茯苓(Poria Sclerotium, Poria cocos, 잔나비걸상과, Polyporaceae), 蜂蜜(Mel)은 동우당제약 장흥한약재연구소에서 대한약전에 근거하여 실험한 원료의약품을 소재로 사용하였다.
瓊玉膏(KOK)는 人蔘 9g, 地黃 48g, 茯苓 18g, 白蜜 30g의 비율로 사용하였으며, 먼저 분쇄된 人蔘과 茯苓을 혼합한 후, 地黃汁을 첨가하고, 이후 연밀한 꿀을 혼합하였다. 상기 人蔘, 茯苓, 地黃汁, 꿀의 혼합물을 용기에 담아 밀봉하고, 99℃에서 72시간 동안 중탕 가열한 후, 24시간 동안 상온에 방치하여 냉각시켰다. 냉각 후, 밀봉된 상태로 다시 99℃에서 24시간 동안 중탕 가열한 후, 90일 동안 숙성하여 瓊玉膏를 제조하였다. 제조된 瓊玉膏는 10배수의 정제수에 넣고 3시간 동안 끓인 후 수득된 추출액을 회전식 감압농축기(N-1110, EYELA, JAPAN)를 이용하여 감압농축하여 추출물을 얻었으며, 이를 동결건조(PVTFD20R, KOREA)하여 분말로 제조하여 실험용 시료로 사용하였다.
실험에 사용된 시약으로 procollagen type Ⅰ C-peptide(PICP) EIA kit 는 TAKART(Japan)사의 제품을 사용하였고, M106배지, fetal bovine serum(FBS), streptomycin, penicillin등은 Gibco BRL(USA) 제품을 사용하였으며, 3-(4,5-dimethylthiazol-2-yl)-2-5-diphenyltetrazolium bromide(MTT), dimethyl sulfoxide(DMSO) 등은 Sigma(USA)제품을 그리고 일반시약은 실험용 특급시약을 사용하였다.
사람의 피부아세포(HDFn, human Dermal fibroblast, neonatal) 세포는 한국 세포주 은행으로부터 구입하여 사용하였다. 세포는 37℃, 5% CO2에서 10% FBS혈청, penicillin(100 units/㎖)과 streptomycin (100㎍/㎖) 그리고 2%의 LSGS (Low Serum Growth Supplement)가 첨가된 M106에 배지에서 배양하였다. 세포배양용기의 세포밀도가 80% 이상일 때 subculture를 실시하였으며 Serum Free Media(SFM)으로 일회세척하고 Trypsin/EDTA (0.05% trypsin, 0.53 mM EDTA)처리하여 37℃에서 세포를 탈리하였다. 이를 원심분리(1,300 rpm, 4℃)하여 포들을 회수하고 1×105cells로 계대하여 2-3일 간격으로 배지를 교체하면서 배양하였다.
실험 시료의 안전성을 확인하기 위하여 瓊玉膏의 피부세포에 미치는 독성을 평가하였다. 세포 독성은 3-(4,5-dimethylthiazol-2-yl)-2-5-diphenyltetrazolium bromide(MTT) 시약을 이용하여 세포 생존율을 측정하는 Mosmann의 방법14)을 변형하여 실시하였다. 인간 피부아 세포(human dermal fibroblast, HDF)를 96-well plate에 1×105cells/well의 농도로 분주하여 37℃, 5% CO2 에서 24시간 동안 배양하였다. 배양 배지를 제거하고 시료를 농도별로 처리한 배지에 24h 동안 배양한 후 배지를 제거하고 Phosphate buffered saline(PBS) 두 번씩 세척하였다. MTT 를 300㎍/㎖ 로 PBS에 녹여 100㎕ 첨가하고 37℃, 5%의 CO2 에서 4시간 동안 배양하였다. DMSO를 한 well 당 150㎕ 넣고 30분 동안 교반한 후 570㎚에서 흡광도를 측정하였다.
콜라겐 합성능 평가는 콜라겐 전구체(procollagen type Ⅰ C-peptide, PIP)의 C-말단을 인식하는 항체 이용법을 활용하였다. 瓊玉膏를 농도별로 각각 세포에 처리하여 배양한 후 배양액을 모아서 enzymes-linked immunoassay kit (PIP-kit, Takara사)를 이용하여 콜라겐 전구체의 C-말단의 양을 측정하였다.
피부의 광노화에 있어 중요한 역할을 담당하고 있는 MMP-1의 발현은 UVA에 의해 세포에서 JNK/p38 활성도가 증가하고 전사인자인 AP-1의 활성도가 증가되는 신호 전달경로를 통해 MMP-1 발현을 증가시켜 피부에서 교원질의 결핍을 초래한다고 알려져 있다. 시료의 MMP-1 활성저해효과측정은 Gao 등이 사용한 방법15)을 변형하여 실시하였다. 즉, 반응완충액 100㎕에 형광물질이 표지된 DQ collagen(0.25㎎/㎖, Molecular Probe, USA) 20㎕, 시료 40㎕와 collagenase(0.5 unit) 40㎕를 첨가하였다. 암소, 실온에서 20분 경과 후 형광분광광도계(PERKIN ELMER, USA)를 이용하여 흡수파장 495㎚, 방출파장 515㎚로 형광값을 측정하였고, 대조그룹으로서 효소액 대신 반응완충액을 효소와 동량 첨가하여 형광값을 측정하였다. 시료 자체의 형광값도 측정하여 효소활성 계산 시 보정하였다. 양성대조군으로 1,10-PT를 사용하여 측정한 MMP-1 활성 억제 시험은 시료를 농도별로 처리하여 MMP-1 활성을 비교하였다.
실험에 사용한 예쁜꼬마선충(C. elegans)은 야생형으로(Bristol N2, Caenorhabditis Genetics Center, University of Minnesota, Minneapolis, MN, USA) 조선대학교 조정훈 교수로 부터 분양받아 계대하여 균주를 보관하여 사용하였다. Brenner의 방법16)에 따라 고체배지에 OP50 균주를 배양하여 lawn을 만들고 그 위에 C. elegans를 3-4일 간격으로 옮겨주며 배양하였다. 동일한 연령의 개체를 확보하기 위하여 Synchronized L1 stage의 예쁜꼬마선충 100마리 정도를 NGM agar plate 옮겨서 72시간 동안 배양하여 L4 stage Lavae가 되도록 하였다. 10마리의 adult worm을 약물이 처리된 6㎝ plate와 약물이 처리되지 않은 plate에 각각 옮겨 3시간 정도 egg laying을 하고 plate에서 adult worm을 제거하였다. Reproductive 기간 동안에 매일 약물이 처리된 새로운 배지로 옮겨주고 6일째 되는 날 35℃ 인큐베이터에서 8시간 동안 열 스트레스(Thermal stress)를 주었다. 그리고 죽은 꼬마선충의 수를 세어 대조군과 비교하였다.
약물투여군의 산화적 스트레스 저항성과 노화억제와의 관련성을 밝히기 위해 과산화수소에서의 생존력 실험을 실시하였다. Syncronized L1 stage의 예쁜꼬마선충 100마리 정도를 NGM agar plate 옮겨서 65시간 동안 배양하여 L4 stage Lavae가 되도록 하였다. Syncronized L4 stage의 선충을 10-15마리씩 약물이 처리된 6㎝ plate와 약물이 처리되지 않은 plate에 각각 옮겨 3시간 정도 egg laying을 하고 plate에서 adult worm을 제거하였다. Reproductive 기간 동안에 매일 약물이 처리된 새로운 배지로 옮겨주고 6일째 되는 날 0.8mM hydrogen peroxide가 포함된 M9 buffer에 옮겨 8시간 동안 처치하여 산화적 스트레스를 측정하였다.
실험 동물은 SKH-1 hairless female 마우스(20-25g)로 6주령을 오리엔트 바이오로부터 구입하여 1주 동안 고형사료와 물을 자유롭게 섭취시키면서 55±5%의 습도와 22±2℃의 온도 및 12시간 주기로 명암이 조절되는 실험 환경에 1주간 적응시켰고, 한 군에 5마리씩 5군으로 나누었다. 자외선 조사는 XL-1500 Spectrolinker™ UV crosslinker(Spectronics Corporation Westbury, NY, USA)을 이용하여 최소 홍반량(minimal erythromal dose, MED)을 100mJ/㎠으로 하여 1주일에 3회씩 mouse의 등 부위에 조사하였으며, 1주는 1MED(100 mJ/㎠), 2주는 2MED(200 mJ/㎠), 3주는 3MED(300 mJ/㎠), 4주째는 4MED(400 mJ/㎠)로 조사하여 주름살을 유도하였다. 시험하고자 하는 시료의 경구투여는 자외선 조사 후 4주간 하루 1회씩 투여한다. 시험 종료 직전에 silicon rubber로 등 부위에서 replica를 뜬다. 실체현미경으로 replica를 분석하여 주름 정도를 비교한다. 그 후 각 군의 시험동물을 희생시켜 피부 조직을 얻었다.
실험종료 후 희생시킨 마우스 피부조직으로부터 Trizol(Life Technologies Inc., Rockville, MD, USA)의 제조사에서 제공하는 방법을 이용하여 추출하였다. cDNA 합성은 각 시료에 대하여 1μL의 RNA를 이용하여 cDNA Synthesis kit (Applied Biosystems, Foster City, CA, USA)로 합성하였다. 유전자들의 발현을 측정하기 위하여 RT-PCR(Veriti™ thermal cyclers, Applied Biosystems, Foster City, CA, USA)을 실시하였다. 각각의 유전자에 대한 PCR primer의 염기서열은 다음과 같다. Procollagen 1 forward primer 5'-CTT TGC TTC CCA GAT GTC CTA T-3', reverse primer 5'-CGG TGT CCC TTC ATT CCA G-3'; Procollagen 3 forward primer 5'-CCA CCC CGA ACT CAA GAG TGG-3', reverse primer 5'-CCA TCC TCT AGA ACT GTG TAA GTG-3'; MMP-1 forward primer 5'-TGG GTG GAA ATT CAG AAG GTG-3', reverse primer 5'-ATC TAC TTG CTG GAC ATC AGG GGG-3'; MMP-9 forward primer 5'-TGC GAC CAC ATC GAA CTT CG-3', reverse primer 5'-CCA GAG AAG AAG AAA ACC CTC TTG G-3'. b-Actin forward primer 5'-CTC GTA ACT CTT CTC CAA GGA GGA-3', reverse primer 5'-TTC TAC AAT GAG CTG CGT GTG GC-3'. 모든 유전자에 대하여 PCR 증폭단계는 다음과 같고 증폭 Cycle은 총 30회 실시하였다. 95℃에서 10분 증폭단계의 denaturation을 95℃에서 15초, annealing을 55℃에서 15초, extension을 72℃에서 10초간 반복하였다. 그 후 PCR 산물을 LabChip GXII (Caliper LIfe Sciences) 자동전기영동 장치에 넣고 PCR 결과를 확인하였다.
MMP-1 억제 활성, thermal stress, oxidative stress 실험은 모두 one-way anova 분석을 실시한 후 사후검정으로 Bonferroni의 방법에 따라 대조군과 약물투여군의 차이를 검정하였다. 분산분석을 위해 Kolmogorov-Smirnov과 Shapiro-Wilk 정규성가정을 검정하였고, Levene의 분산의 동질성을 검정을 Levene의 방법에 따라 확인하였으며, 등분산 가정이 되지 않는 경우는 Welch의 평균의 동질성 검정을 확인하였다. 통계분석용 프로그램은 SPSS 20.0과 prism 5.2를 사용하였다.
Ⅲ. 결 과
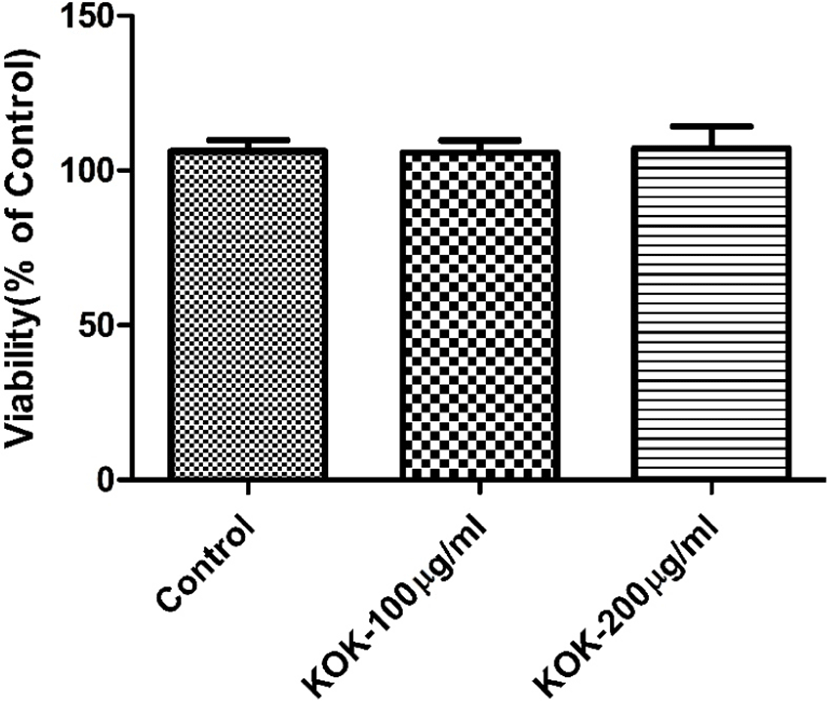
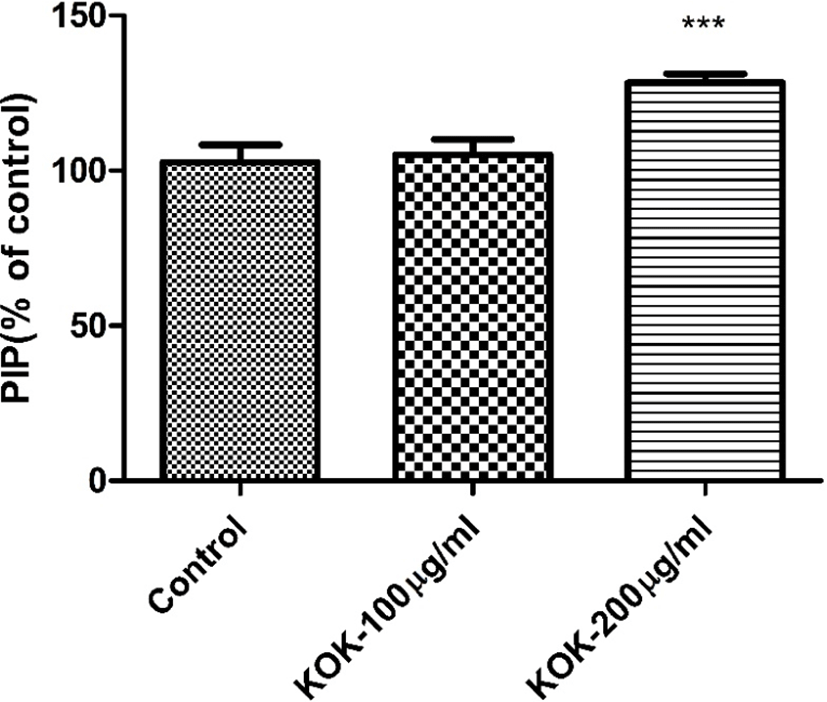
콜라겐 합성능 평가는 콜라겐 전구체(PIP)의 C-말단을 인식하는 항체 이용법을 활용하였다. 콜라겐 합성능 평가에 앞서 약물이 농도에 따른 세포의 독성이나 증식에 영향을 미치는지 확인하기 위하여 세포 독성 시험을 실시하였다. 그 결과 瓊玉膏 추출물에서 100-200㎍/㎖의 약물을 처치한 군이 약물을 처치하지 않은 군과의 비교에서 독성과 증식에 있어서 통계적으로 유의한 차이가 관찰되지 않아 실험에 적절한 조건이 수립되었음을 확인하였다(Fig. 1). 콜라겐 합성능 실험은 瓊玉膏 100-, 200㎍/㎖을 각각 세포에 처치하여 배양한 후 배양액을 모아서 PIP-kit를 이용하여 콜라겐 전구체의 C-말단의 양을 측정하였다. 시료의 용매는 두 가지 추출물에 대한 비교를 위하여 동일하게 50% DMSO로 하였으며, 처리 농도는 용매에 녹인 후 용매를 대조군으로 하여, 최종 100, 200㎍/㎖의 농도로 처리하였다. 그 결과 瓊玉膏 200㎍/㎖ 처리군에서 대조군에 비해 약 28.3% 유의미한 증가 효과가 관찰되었다(Fig. 2).
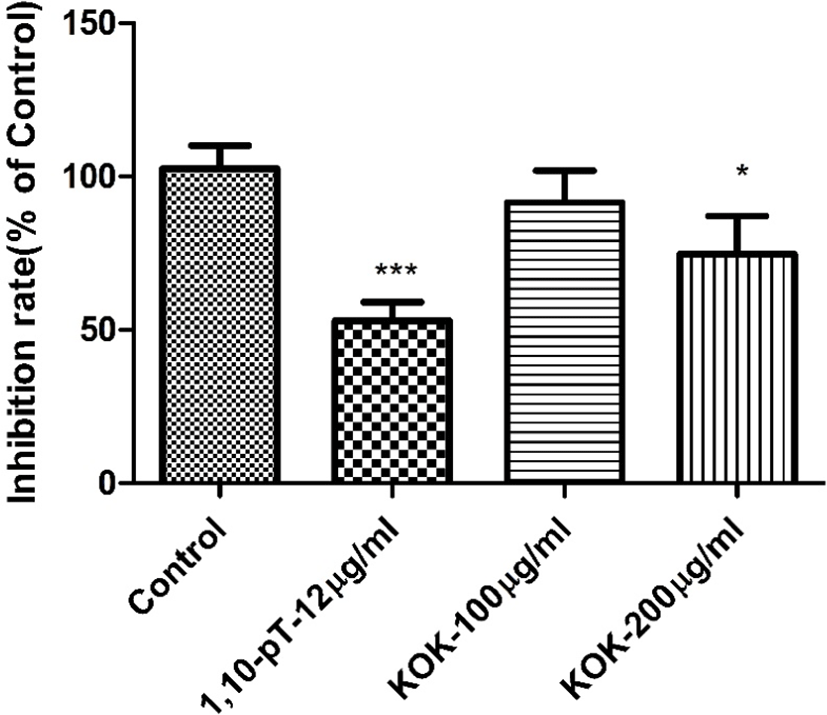
피부의 광노화에 있어 중요한 역할을 담당하고 있는 MMP-1의 발현은 UVA에 의해 세포에서 JNK/p38 활성도가 증가하고 전사인자인 AP-1의 활성도가 증가되는 신호 전달경로를 통해 MMP-1 발현을 증가시켜 피부에서 교원질의 결핍을 초래한다고 알려져 있다17). 양성대조군으로 1,10-PT를 사용하여 측정한 MMP-1 활성 억제 시험은 瓊玉膏를 농도별로 처리하여 MMP-1 활성
을 대조군과 비교하였다. 그 결과 Fig. 3에서 보는 바와 같이 瓊玉膏 200㎍/㎖ 처리군이 대조군에 비해 통계적으로 유의미한 억제 활성이 관찰되었다(Fig. 3).
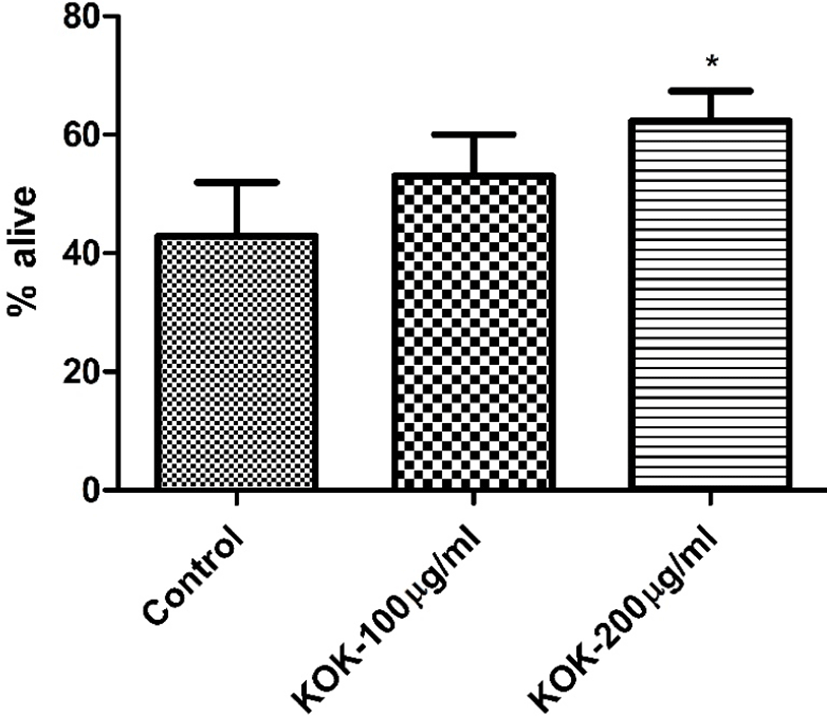
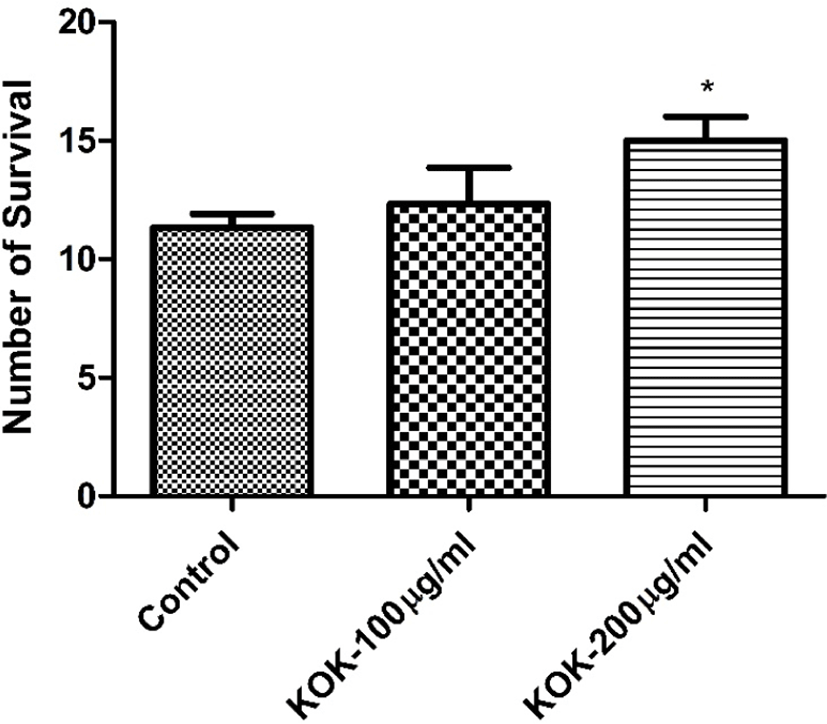
Synchronized L1 stage의 예쁜꼬마선충 100마리 정도를 NGM agar plate 옮겨서 72시간 동안 배양하여 L4 stage Lavae가 되도록 하였다. 10마리의 adult worm을 약물이 처리된 6㎝ plate와 약물이 처리되지 않은 plate에 각각 옮겨 3시간정도 egg laying을 하고 plate에서 adult worm을 제거하였다. Reproductive 기간 동안에 매일 약물이 처리된 새로운 배지로 옮겨주고 6일째 되는 날 35℃ 인큐베이터에서 8시간동안 Thermal stress를 주었다. 그리고 죽은 꼬마선충의 수를 세어 대조군과 비교하였다. 그 결과 Fig. 4에서 보는 바와 같이 瓊玉膏 200㎍/㎖ 처리군에서 열 스트레스 저항성에 유의적 활성이 관찰되었다(Fig. 4).
C. elegans는 노화에 따라 과산화수소 관련 활성산소가 증가되는 경향이 있음이 알려져 있다. 약물투여군의 산화적 스트레스 저항성과 노화억제와의 관련성을 밝히기 위해 과산화수소에서의 생존력 실험을 실시하였다. Synchronized L1 stage의 예쁜꼬마선충 100 마리 정도를 NGM agar plate 옮겨서 65시간 동안 배양하여 L4 stage Lavae가 되도록 하였다. Synchronized L4 stage의 선충을 10-15마리씩 약물이 처리된 6㎝ plate와 약물이 처리되지 않은 plate에 각각 옮겨 3시간정도 egg laying을 하고 plate에서 adult worm을 제거하였다. Reproductive 기간 동안에 매일 약물이 처리된 새로운 배지로 옮겨주고 6일째 되는 날 0.8mM hydrogen peroxide가 포함된 M9 buffer에 옮겨 8시간동안 처치하여 산화적 스트레스를 측정하였다. 그 결과 Fig. 5에서 보는 바와 같이 瓊玉膏 100-, 200㎍/㎖ 처리군에서 대조군에 비해 유의미한 산화적 스트레스 저항성이 관찰되었다(Fig. 5).
콜라겐 합성 유도에 효과적이었던 瓊玉膏를 동물에 투여하여 주름개선 효과에 대해 평가하였다. 무모쥐(Hairless mouse, SKH-1)를 이용하여 기존연구18)를 토대로 MED를 100mJ/㎠로 설정하고 1주일간 3회씩 UV 조사량을 올려가며 총 4주간 주름 형성을 유도하며 그 기간 동안 瓊玉膏를 물에 현탁시켜 100㎎/㎏, 500㎎/㎏ 2가지 농도로 투여하였다. 4주간 실험이 종료된 뒤 실험동물을 희생시키기 전에 DETAX System II와 Double-Stick Disk를 사용하여 피부주름을 본뜬 뒤에 실체현미경으로 측정하였다. 투여군 모두에서 농도의존적인 주름 개선 효과를 확인할 수 있었다(Fig. 6).

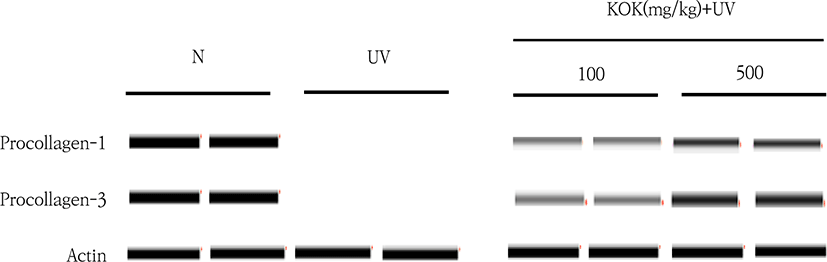
피부주름의 발생 원인으로 주로 알려진 피부교원질(콜라겐) 결핍은 주로 나이가 들어 갈수록 생성은 감소하고 분해속도가 증가하게 된다. Fig. 7에서 보는 바와 같이 瓊玉膏 투여 쥐 피부조직에서 콜라겐 생성 유도를 위한 전구 유전자(procollagen-1, -3) 발현을 확인한 결과 정상 쥐에서는 유전자 발현이 많이 일어나며 UV를 조사한 쥐 피부조직에서는 유전자 발현이 줄어들게 된다. 하지만 瓊玉膏를 농도별로 투여한 쥐에서는 이 유전자 발현이 농도의존적으로 유도되고 있음을 확인할 수 있었다(Fig. 7).
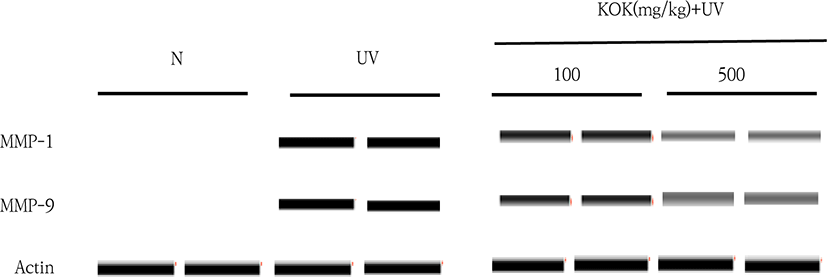
주름생성에 직접적으로 관여하는 콜라겐 분해 효소인 MMP-1, MMP-9의 瓊玉膏 투여 쥐 피부조직에서 유전자 발현 억제 효과를 확인하였다. UV를 조사한 피부의 경우 MMP-1, -9의 유전자 발현이 현저하게 증가하였으며, Fig. 8에서 보는 바와 같이 瓊玉膏 투여 쥐 피부조직에서는 유전자 발현을 농도의존적으로 억제함을 확인할 수 있었다(Fig. 8).
Ⅳ. 고 찰
건강의 외형적 자기표현은 무엇보다도 젊고 생기있는 피부라고 생각할 수 있다. 주름개선, 미백 등 노년층에 특화된 기능성화장품 시장은 지속적으로 성장하고 있다19). 瓊玉膏는 한의약과 건강기능성식품 소재로 널리 활용되고 있으며, 東醫寶鑑 內徑 身形편에 瓊玉膏는 三精丸, 延年益壽不老丹, 五老還童丹, 延齡固本丹, 斑龍丸, 二黃元, 玄菟固本丸, 固本酒와 함께 모두 수명을 연장하는 약으로 기록하고 있다7). 특히 瓊玉膏에 관해서는 “塡精補髓, 調眞養性, 返老還童, 補百損, 除百病. 萬神俱足, 五藏盈溢, 髮白復黑, 齒落更生, 行如奔馬. 日進數服, 終日不飢渴, 功效不可盡述. 一料分五劑, 可救癱瘓五人” 와 같이 그 효능 기록되어 있다. 한의학 고전 DB7)에서는 그 의미를 “정을 채우고 수(髓)를 보하며 진기(眞氣)를 고르게 하고 성(性)을 기르고, 노인을 아이로 돌아오게 하고 모든 허손을 보하고 온갖 병을 없앤다. 온갖 신(神)이 모두 충족되고 오장의 기가 차고 넘쳐 백발이 검게 되고 빠진 치아가 다시 나며 걸음걸이가 달리는 말처럼 빠르게 된다. 하루에 몇 차례 먹으면 하루 종일 배고프거나 갈증나지 않으니 그 효과를 이루 다 말할 수 없다.”고 서술하고 있다. 瓊玉膏에 대한 실험적 생리활성 연구로는 간암에 대한 효능20), 폐선암 세포주(GLC-82 cell)에 대한 억제 효과21), 瓊玉膏의 발모, 양모효과22), 피로회복 효과23), 지구력에 미치는 효과24)등 다양한 효능이 밝혀져 있다. 瓊玉膏에 麥門冬과 天門冬을 가미한 처방에 발효처리를 한 加味瓊玉膏 피부노화에 미치는 영향이 연구되어 있다25). 또한 이화학적 연구로 瓊玉膏의 탄수화물, 조지방, 조단백의 함량과 유리아미노산, 구성아미노산 조성을 정량적으로 연구한 결과가 있다26). 그리고 瓊玉膏의 구성약재인 人蔘의 조사포닌, 지황의 catapol과 5-HMF를 HPLC로 정량한 연구 보고27)와 국내 시판 瓊玉膏의 품질 특성을 연구한 결과가 알려져 있다28).
본 연구에서는 이러한 瓊玉膏의 노화에 따른 주름개선 억제 효과를 실험적으로 검증하고자 하였다. 瓊玉膏의 피부노화 억제 활성에 관한 과학적 기전을 밝히기 위해 인간피부아세포, 예쁜꼬마선충(C. elegans), 무모쥐(Hairless mouse) 등 in vitro, in vivo 연구를 수행하였다. 피부의 주름은 진피층의 붕괴에서 발생하는 것으로 알려져 있다. 진피층은 교원섬유(콜라겐)과 탄성섬유(엘라스틴), 기질(히아루론산), 섬유아세포 등으로 구성되어 있다. 이중 콜라겐은 진피층의 70%를 구성하고 있다29). 瓊玉膏를 처치한 인간피부아세포 배양액에서 procollagen type Ⅰ 양을 측정한 결과 대조군에 비해 유의미한 증가가 나타났으며 이는 瓊玉膏가 콜라겐 생성에 영향을 미치는 것으로 추정할 수 있었다. 또한 교원섬유의 결핍을 초래하는 MMP-1의 억제 활성 실험에서 瓊玉膏 처치군이 대조군에 비해 통계적으로 유의미한 억제 활성을 나타내었다. 자외선, 과음, 뜨거운 불 등의 열성(熱性)인자들이 콜라겐 분해효소와 MMP의 증가시키고 교원섬유와 탄력섬유를 붕괴하여 피부노화를 촉진하는 것으로 알려져 있다4). UVA나 UVB 모두 체내에서 활성산소를 발생시켜 노화를 촉진시키는 것으로 알려져 있다3). 세포 스트레스 유발인자로는 과산화물(superoxide), 히드록실 라디칼(hydroxyl radical), 과산화수소(H2O2) 등 reactive oxygen species(ROS)라 불리우는 활성산소종이 있다30). 이외에도 산화질소(nitric oxide), 페록시나이트 라이트(peroxynitrite) 등 RNS(reactive nitrogen species)와 지질과산화물(lipid peroxyl radical)이 산화 스트레스 유발인자로 알려져 있다31). 이러한 산화물들은 DNA염기인 구아닌(guanine)에 결합하여 돌연변이를 유발하여 노화나 암 등을 유발하는 것으로 알려져 있다.
본 연구에서는 예쁜꼬마선충(C. elegans)을 이용한 열 스트레스 저항성 실험과 산화적 스트레스 저항성 실험을 실시하였으며, 瓊玉膏 처치군의 유의미한 억제 활성을 관찰하였다. 피부의 열적 손상을 좀더 구체적으로 확인하기 위하여 UV를 조사한 무모쥐(Hairless mouse, SKH-1)에 瓊玉膏 100㎎/㎏과 500㎎/㎏ 농도를 처리한 결과 농도의존적인 주름형성 억제 효과를 나타내었다. 또한 UV를 조사한 무모쥐에 瓊玉膏를 투여한 결과 procollagen -1, -3 유전자의 증가가 관찰되었으며, 콜라겐 분해를 증가시키는 mmp-1, mmp-9 유전자는 瓊玉膏 투여에 따라 감소하는 결과를 나타내었다.
본 연구에서는 瓊玉膏의 피부주름과 노화 억제 활성을 in vitro, in vivo 실험을 통해 확인하였으며, 瓊玉膏의 피부노화 억제 기전은 열스트레스와 산화적 스트레스를 억제하고, mmp-1, mmp-9 유전자의 억제와, procollagen-1, procollagen-3 증가를 통해 피부노화를 억제하는 것으로 그 기전을 추정해 볼 수 있었다. 이로써 한의약에서 다빈도로 처방되고 건강기능식품으로도 널리 알려져 있는 瓊玉膏의 피부노화 억제 기전의 검증을 통해 향후 산업화에 중요한 토대로 활용될 수 있을 것으로 사료된다.
Ⅴ. 결 론
瓊玉膏의 피부노화 억제 활성에 대한 in vitro, in vivo 연구를 수행하여 다음과 같은 결과를 얻었다.
-
瓊玉膏를 처리한 인간피부아세포 배양액에서 procollagen type Ⅰ증가가 관찰되었다.
-
MMP-1의 억제 활성 실험에서 瓊玉膏 투여군이 대조군에 비해 억제 활성을 나타내었다.
-
瓊玉膏는 예쁜꼬마선충(C. elegans)을 이용한 열 스트레스 저항성 실험과 산화적 스트레스 저항성 실험에서 유의미한 억제 활성을 나타내었다.
-
UV를 조사한 무모쥐(Hairless mouse, SKH-1)에 瓊玉膏를 처리한 결과 농도의존적인 주름형성 억제 효과를 나타내었다. 또한 procollagen -1, -3 유전자의 증가가 관찰되었으며, 콜라겐 분해를 증가시키는 mmp-1, mmp-9 유전자는 감소하는 결과를 나타내었다.
-
瓊玉膏는 열스트레스와 산화적 스트레스를 억제하고, mmp-1, mmp-9 유전자의 억제와, procollagen-1, procollagen-3 증가를 통해 피부노화를 억제하는 것으로 실험적으로 검증되었다.