Ⅰ. 서 론
피부암은 전 세계적으로 발생률과 사망률이 지속해서 증가하고 있고 상피세포에서 유래한 비흑색종 피부암(non-melanoma)과 멜라닌 세포에서 유래한 흑색종 피부암(melanoma)으로 크게 나눌 수 있다1-6). 비흑색종 피부암에는 기저층이나 모낭을 구성하는 세포에서 유래한 기저세포암(basal cell carcinoma)과 표피의 각질형성세포가 악성화한 편평상피세포암(squamous cell carcinoma)이 있고 흑색종은 전체 피부암의 5% 정도이지만 5년 생존율이 20% 미만으로 치료가 어려운 악성종양이다2-6).
피부암 치료법은 외과적 절제술이 주로 시행되고 그 외에도 방사선 치료, 약물치료 및 항암 화학요법 등이 사용되고 있다. 절제 수술은 조기에 치료할 경우 완치가 가능하지만 이미 전이되어 있거나 재발한 경우에는 한계가 있고 또한 기존의 항암 치료 약물은 부작용이 있으며 약물 내성을 유발할 수 있다7). 그러므로 기존 피부암의 치료 약물에 비해 상대적으로 안전한 생약에 대한 관심이 증가하고 있다.
土茯笭(Smilacis Rhizoma)은 백합과에 속하며 국내에서 자생하는 청미래덩굴(Smilax china Linné, SCL) 또는 중국에서 자생하는 光葉菝葜(Smilax glabra Roxburgh)의 뿌리줄기로 본 연구에서는 SCL을 사용하였다. 性은 平하고 味는 甘淡하며 除濕, 解毒, 通利關節하는 효능이 있어 關節疼痛, 근육마비, 설사, 水腫, 痳病, 瘰癧, 腫毒, 만성 피부질환 등에 사용되고 있다8,9). 현재까지 土茯笭의 실험적 연구로는 항염증10-2), 항산화13), 항비만14,15) 그리고 항암16-9) 효과에 대해서 보고된 바 있다.
그러나 土茯笭의 피부암에 관한 연구는 접하지 못했기에, 본 연구에서는 土茯笭 에탄올 추출물(SCL-EtOH)이 피부암 세포주인 A431, SK-MEL-5, SK-MEL-28의 성장에 미치는 영향을 확인하여 유의한 결과를 얻었기에 이에 보고하는 바이다.
Ⅱ. 재료 및 방법
본 연구에서 사용된 SCL-EtOH는 한국한의약연구원의 한약자원연구센터 한약표준자원은행(Herbal Medicine Resources Research Center, Korea Institute of Oriental Medicine, Naju, Korea)으로부터 분양받아 사용하였다. 분양받은 SCL-EtOH는 dimethylsulfoxide(DMSO)에 녹여 100㎎/㎖의 농도로 stock solution을 제조한 후 –20℃에 보관하였다. 표본 관능감정과 유전자분석은 한약표준자원은행에서 발급되어진 확인서와 같이 규명되었다(Fig. 1, 2).


본 연구의 세포 배양에 필요한 Dulbecco’s modified Eagle medium(DMEM), minimum essential medium(MEM), fetal bovine serum(FBS), penicillin/streptomycin(P/S), sodium pyruvate (SP), minimum essential medium non-essential amino acid(MEM NEAA), trypsin-EDTA는 Gibco (Grand Island, NY, USA)에서 구입하였으며, DMSO, epidermal growth factor(EGF), phorbol 12- myristate 13-acetate(TPA), 5-fluorouracil(5-FU), basal medium eagle(BME)은 Sigma-Aldrich, Inc.(St. Louis, MO, USA)에서 구입하였다. 항체 p27, Cyclin B1, caspase-7은 Santa Cruz(Santa Cruz Biotechnology, CA, USA)에서 구입하였다. COX-2(human)는 Cayman(Ann Arbor, MI, USA)으로부터 구입하였으며, actin은 Invitrogen(Beverly, MA, USA)에서 구입하여 사용하였다.
인간 유래 피부 각질 형성 세포주 HaCaT cells와 인간 피부암(비흑색종) 세포주 A431, 쥐의 상피 세포주인 JB6 Cl41은 American Type Culture Collection (ATCC, Manassas, VA, USA)에서 구입하였으며, 인간 피부암(흑색종) 세포주 SK-MEL-5와 SK-MEL-28은 한국세포주은행(Korean Cell Line Bank, KCLB, Seoul, Korea)으로부터 구입하였다. HaCaT cells와 A431 cells는 10% FBS, 100U/㎖ P/S를 첨가한 DMEM에서 배양하였으며, SK-MEL-5와 SK-MEL-28 cells는 10% FBS, 100U/㎖ P/S, 1X SP, 1X MEM NEAA를 포함하는 MEM 배지를 이용하여 배양하였다. JB6 Cl41은 5% FBS, 100U/㎖ P/S, X SP, 1X MEM NEAA를 포함하는 MEM에서 배양하였다. 모든 세포주는 37℃, 5% CO2의 배양기에서 각각 배양하였으며, 2일마다 새로운 배지로 교체해 주었다.
SCL-EtOH가 정상 세포에 독성을 나타내는지 알아보기 위하여 WST-8 분석을 수행하였다. HaCaT cells를 96-well plate에 7×103cells/well이 되도록 분주하고 24시간 동안 안정화시켰다. SCL-EtOH를 다양한 농도(0, 5, 10, 20, 40㎍/㎖)로 처리한 후, 각각 24시간 및 48시간 동안 반응시키고 Quanti-MAX WST-8 Cell viability Assay Kit reagent(Biomax, Seoul, Republic of Korea)를 각 well에 10μL씩 첨가하였다. 37℃에서 2시간 배양하고, Multiskan SkyHigh spectrophotometer(ThermoScientific, Vantaa, Finland)를 사용하여 450㎚에서 흡광도를 측정하였다.
SCL-EtOH가 HaCaT cells에 미치는 영향을 알아보기 위하여 96-well plate에 A431(2.5×103cells/well), SK-MEL-5(1×103cells/well) 및 SK-MEL-28 (1×103cells/well) cells를 18시간 동안 배양하고, SCL-EtOH를 농도별로 처리한 후 각각 24시간, 48시간 및 72시간 동안 반응시켰다. 10μL의 WST-8를 각 well에 첨가하고 37℃에서 1.5시간 동안 반응시킨 후 Spectrophotometer를 사용하여 450㎚에서 흡광도를 측정하였다. 이때 SCL-EtOH의 효과를 비교하기 위하여 똑같은 조건에서 항암제인 5-FU를 농도별(0, 1.25, 2.5, 5, 10μM)로 처리하였다.
흑색종 피부암 세포주에 대한 SCL-EtOH 처리에 따른 세포 형태의 변화를 확인하기 위하여, SK-MEL-5 및 SK-MEL-28 cells를 6-well plate에 각 1.5×105cells/well로 seeding 한 후, 18시간 동안 배양하였다. 기존의 배지를 제거하고 1X PBS로 세척한 후, SCL-EtOH를 농도별(0, 10, 20, 40㎍/㎖)로 처리하였다. 각각 72시간 동안 반응시킨 후 광학현미경(Leica Microsystems, Wetzlar, Germany)을 통해 세포의 형태를 관찰하고 이미지를 저장하였다.
성장인자인 EGF에 의해 유도된 JB6 Cl41 cells와 염증인자 TPA에 의해 유도된 JB6 Cl41 cells의 cell transformation 및 colony 형성 변화를 확인하기 위하여 anchorage-independent cell growth 분석을 실시하였다20). Soft agar는 두 층으로 이루어지며, 바닥층을 만들기 위해 BME, 10% FBS, 10% PBS, 2mM L-glutamine, 5㎍/㎖ gentamicin이 포함된 0.5% agar mix에 -/+ 10ng/㎖ EGF 또는 -/+ 10ng/㎖ TPA와 다양한 농도의 SCL-EtOH(10, 20, 40㎍/㎖)를 첨가하여 6-well plate에 well당 3㎖씩 분주하고 상온에서 30분 정도 굳혔다. JB6 세포는 10% BME 배지로 resuspend하여 준비하였다. 상기의 BME 혼합배지에 0.3% agar, -/+ 10ng/㎖ EGF 또는 -/+ 10ng/㎖ TPA와 다양한 농도의 SCL-EtOH(10, 20, 40㎍/㎖), 그리고 8×103cells/well이 되도록 JB6 세포를 혼합하여 바닥층 위로 1㎖씩 분주하여 상온에서 30분 동안 굳힌 다음 5% CO2, 37℃ 배양기에서 약 2주간 배양하였다. 형성된 colony는 광학현미경을 통해 관찰하였으며, 저장된 이미지는 Image-Pro Plus software(v.6.0) program(Media Cybernetics, Silver Spring, MD, USA)을 이용하여 colony를 계수하였다.
SCL-EtOH가 흑색종 세포주 SK-MEL-5와 SK-MEL-28의 세포주기에 미치는 영향을 살펴보기 위하여, 6-well plate에 1.5×105cells/well이 되도록 세포를 분주한 후, 18시간 동안 안정화하였다. SCL-EtOH를 다양한 농도(10, 20, 40㎍/㎖)로 처리하고 48시간 동안 배양한 다음, 배지와 1X cold-PBS로 1회 세척한 세척수를 모두 모아주었다. Trypsin-EDTA를 처리하여 세포들을 회수하고 1,000rpm, 4℃에서 5분간 원심분리하였다. 상층액을 제거하고, 1X cold-PBS로 1회 세척한 다음, 70% 에탄올을 가하여 –20℃에서 24시간 이상 고정해주었다. 이후에 13,000rpm, 4℃에서 3분간 원심분리하여 70% 에탄올을 모두 제거하고, 1X cold-PBS로 세척하였다. FxCycle™ PI/RNase Staining Solution(ThermoFisher Scientific, Rockford, Illinois)의 프로토콜을 따라 염색한 다음 유세포분석기 CytoFLEX(Beckman Coulter, CA, USA)를 사용하여 분석하였다.
SCL-EtOH가 SK-MEL-5와 SK-MEL-28 cells의 세포사멸에 어떤 영향을 미치는지 확인하기 위하여, 6-well plate에 1.5×105cells/well의 세포를 seeding하고, 18시간 동안 배양하였다. 기존 배지를 제거해주고, 다양한 농도의 SCL-EtOH를 처리하고 72시간 동안 배양한 배지와 1X cold-PBS로 1회 세척한 세척수를 모두 회수하였다. Trypsin-EDTA를 처리하여 세포들을 모으고, 4℃에서 1,000rpm으로 5분간 원심분리하였다. 1X cold-PBS로 1회 세척한 다음, 제조사의 프로토콜을 따라 Annexin V Alexa Fluor™ 488/Propidium Iodide Dead Cell Apoptosis Kits(ThermoFisher Scientific, Illinois, USA)를 사용해 세포를 염색시키고 CytoFLEX(Beckman Coulter)를 사용하여 분석하였다.
SCL-EtOH의 세포 성장 억제 효과를 나타내는 분자 기전을 알아보기 위하여, 100㎜ dish에 0.8× 106cells/well의 SK-MEL-5와 SK-MEL-28 cells를 분주하고, 18시간 동안 배양하였다. 기존 배지를 제거하고, 0, 10, 20, 40㎍/㎖의 다양한 SCL-EtOH를 처리한 다음, 48시간 또는 72시간 동안 배양하였다. 배지와 1X cold-PBS 세척수를 포함하여 trypsin-EDTA를 처리하여 회수한 세포들을 4℃에서 1000rpm으로 5분간 원심분리하였다. 1X cold-PBS로 1회 세척한 후, PRO-PREP Protein Extraction Solution(iNtRON Biotechnology, Seongnam, Korea)과 Pierce BCA Protein Assay Kit(ThermoFisher Scientific, Illinois, USA)를 이용하여 단백질을 추출하고 정량하였다. Mini-PROTEAN Tetra Cell System(Bio-Rad, CA, USA)을 이용하여 SDS-PAGE를 진행하고, iBlot 3 Transfer System(ThermoFisher Scientific, Vantaa, Finland)을 이용하여 분리된 단백질을 polyvinylidene fluoride(PVDF) membrane으로 이동시켰다. 실온에서 1시간 동안 5% skim milk를 이용하여 blocking 후, 1X tris-buffered saline with Tween-20(TBS-T)를 이용하여 5분씩 2회 세척하고, 1차 항체와 충분히 반응시켜주기 위하여 4℃에서 12시간 이상 shaking 해주었다. 이후에는 실온에서 1X TBS-T로 10분씩 3회 세척하고 2차 항체를 1시간 반응시켰다. 1X TBS-T를 이용하여 10분씩 3회 세척하고 enhanced chemiluminescent(ECL) horseradish peroxidase(HRP) substrate(ThermoFisher Scientific, Illinois, USA)로 반응시켜 LAS-Amersham Imager 600(GE Healthcare, Uppsala, Sweden)를 사용하여 단백질 발현을 확인하였다.
Ⅲ. 결 과
HaCaT에 대한 독성을 확인한 결과, SCL-EtOH는 40㎍/㎖까지 처리한 경우에도 48시간 후 세포생존율이 86.3±0.3%로 독성을 나타내지 않았다(Fig. 3).
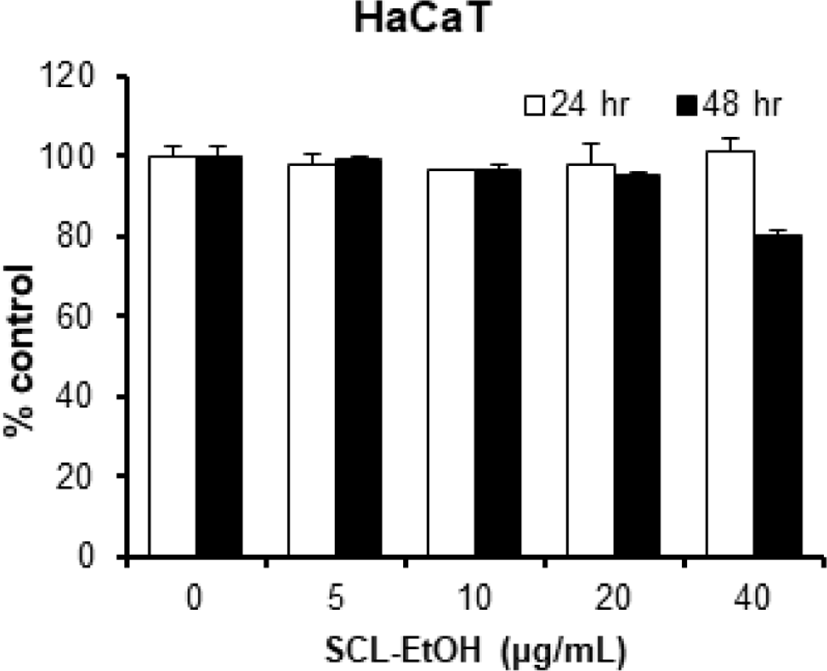
Cells were treated with different concentration of SCL-EtOH for 24 and 48hr. The experimental data were expressed in mean ± standard deviation of three replicates. No significant difference between the control and treated groups. SCL-EtOH: Smilax china Linné 70% ethanol extract.
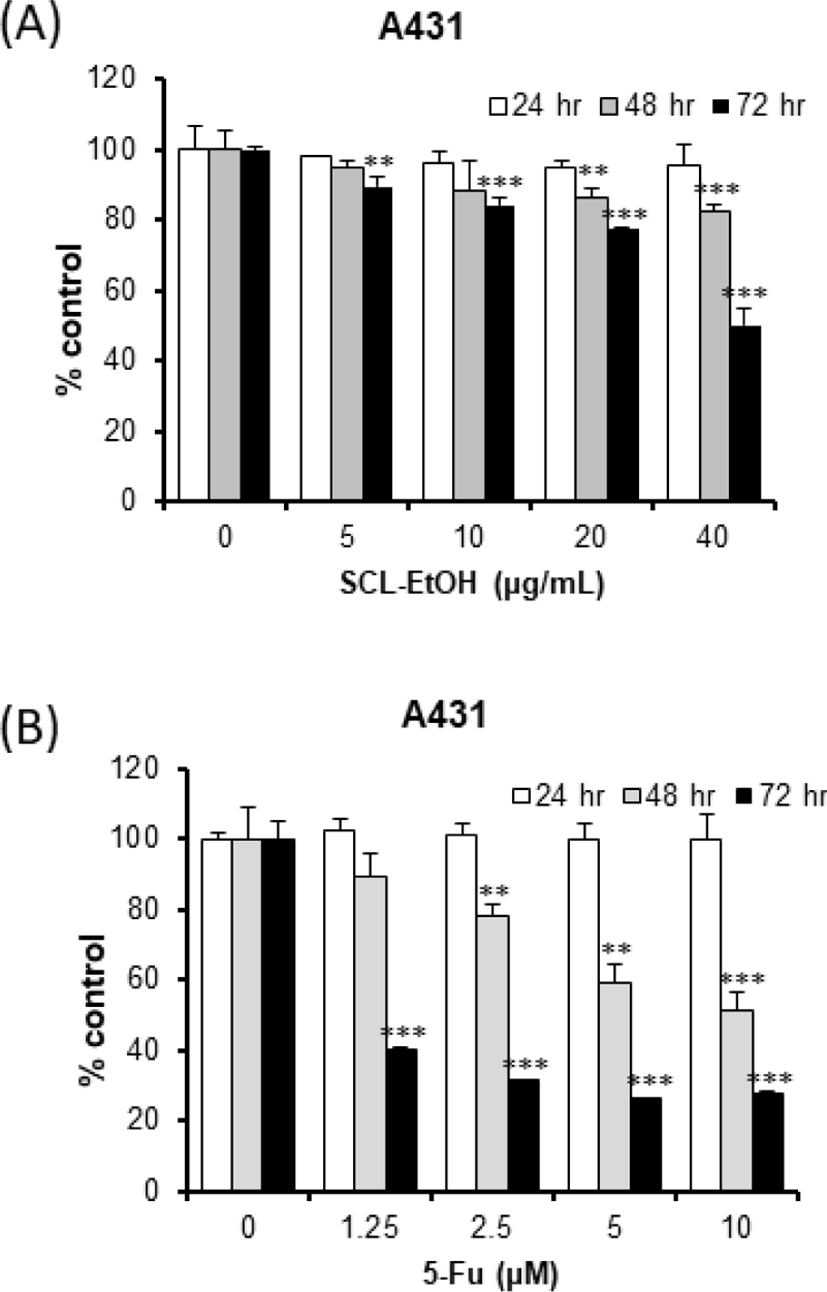
비흑색종 세포주 A431의 생존율을 관찰한 결과, SCL-EtOH는 농도 및 시간 의존적으로 유의성 있게 감소하여 40㎍/㎖의 농도에서 72시간 후 49.8±4.3%의 세포 성장 억제를 보였다. 그러나 대조군인 5-FU는 같은 조건에서 72.4±0.9%의 세포 성장 억제를 보여서 SCL-EtOH보다 높게 나타났다(Fig. 4).
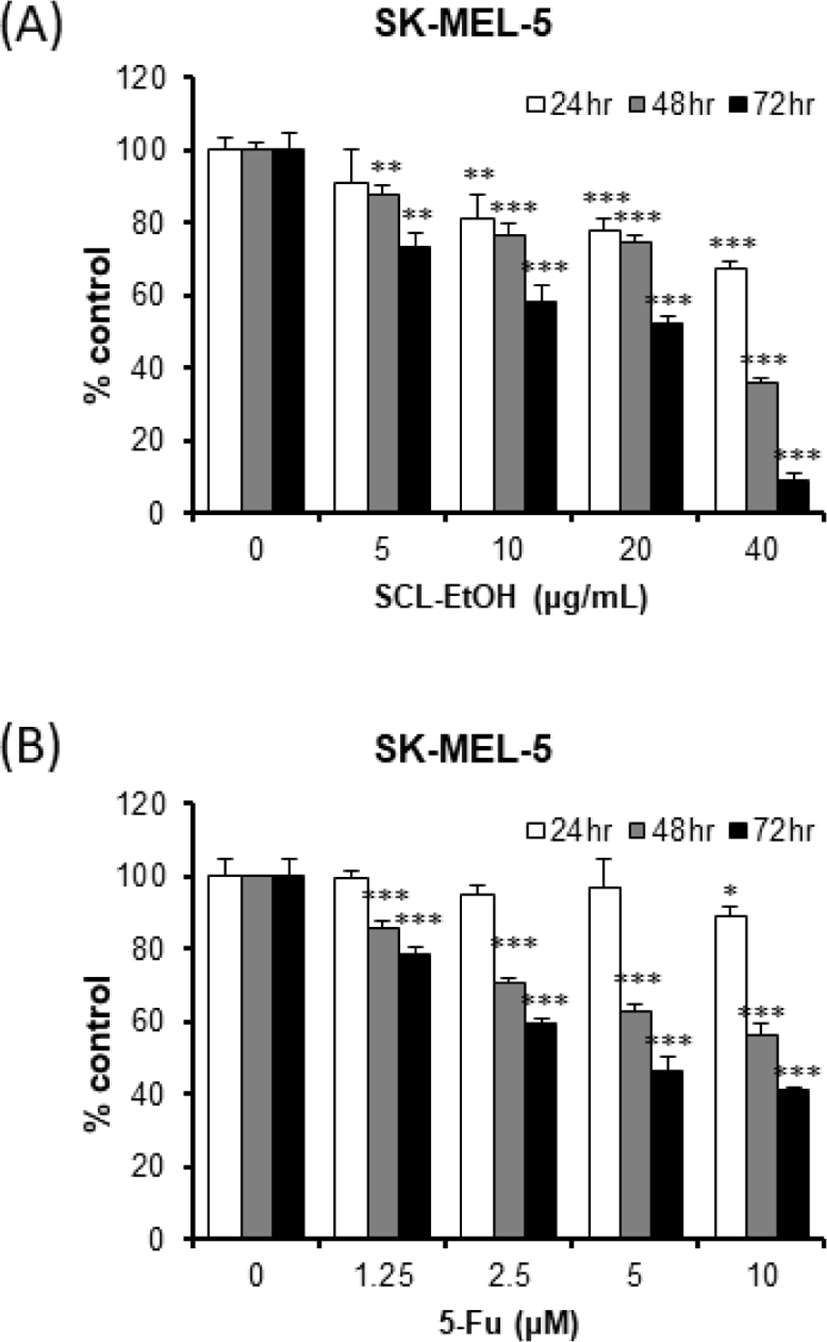
흑색종 세포주 SK-MEL-5에 대한 SCL-EtOH 40㎍/㎖의 항증식 효과는 24시간, 48시간 및 72시간 후에 각각 32.5±1.9%, 64.1±1.5%, 90.9±1.7%로 유의성 있는 세포 성장 억제를 보였다. 5-FU는 각각 11.1±2.8%, 43.6±3.4%, 58.8±0.8%로 SCL-EtOH가 억제 효과가 더 높게 나타났다(Fig. 5).
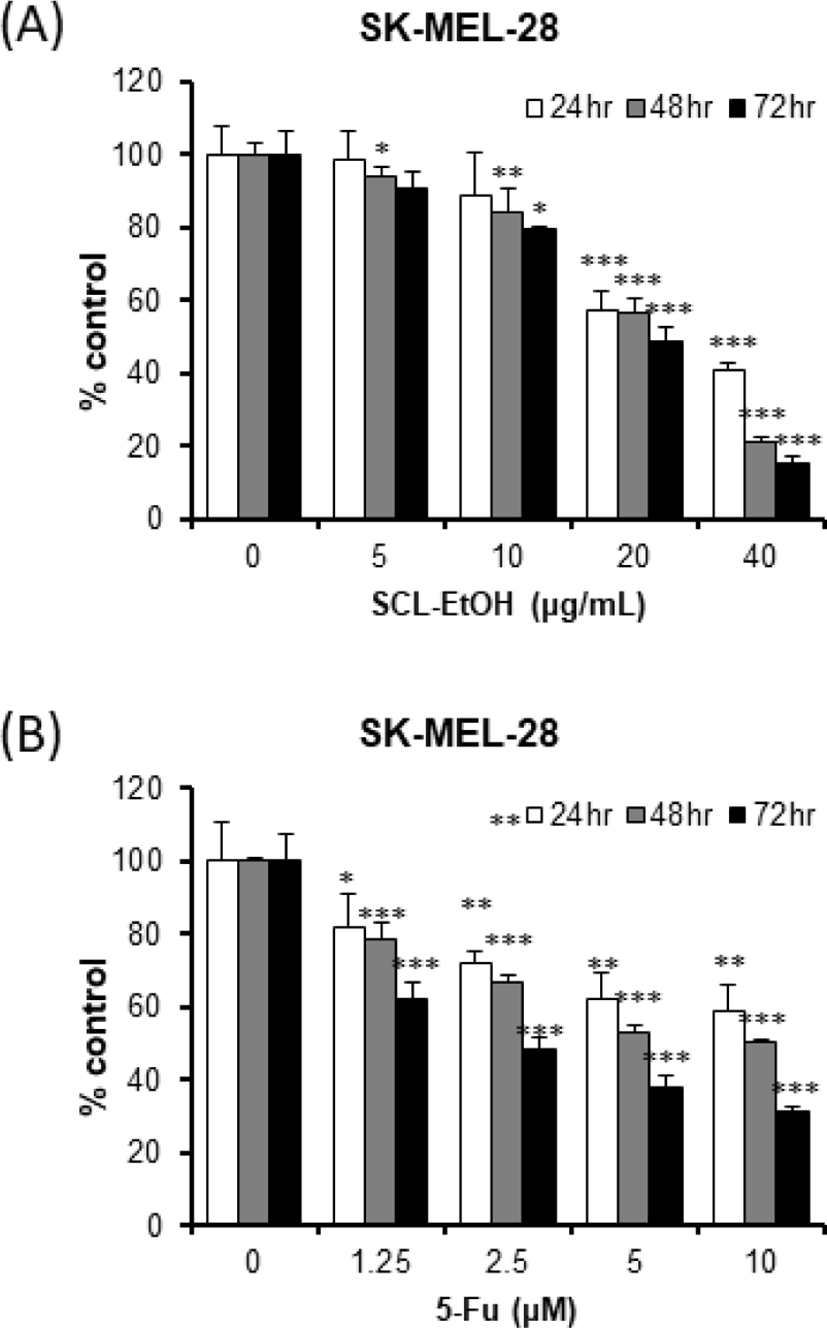
SK-MEL-28에 대한 SCL-EtOH 40㎍/㎖의 항증식 효과는 24시간, 48시간 및 72시간 후에 각각 59.2±2.0%, 79.1±1.7%, 84.4±1.5%로 유의성 있는 세포의 성장 억제를 보였다. 5-FU는 각각 41.0±7.3%, 49.7±1.0%, 68.3±0.9%로 SCL-EtOH가 억제 효과가 더 높게 나타났다(Fig. 6).
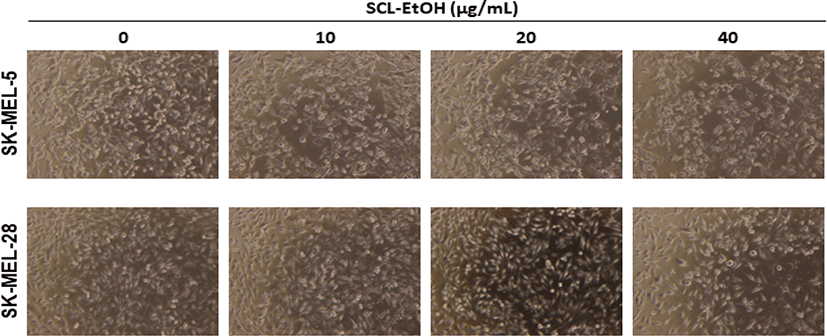
SK-MEL-5, SK-MEL-28 cells에서 SCL-EtOH의 농도가 증가할수록 세포의 형태가 변화하였으며, dish에 부착하지 않고 부유 상태인 세포가 증가하였다(Fig. 7).
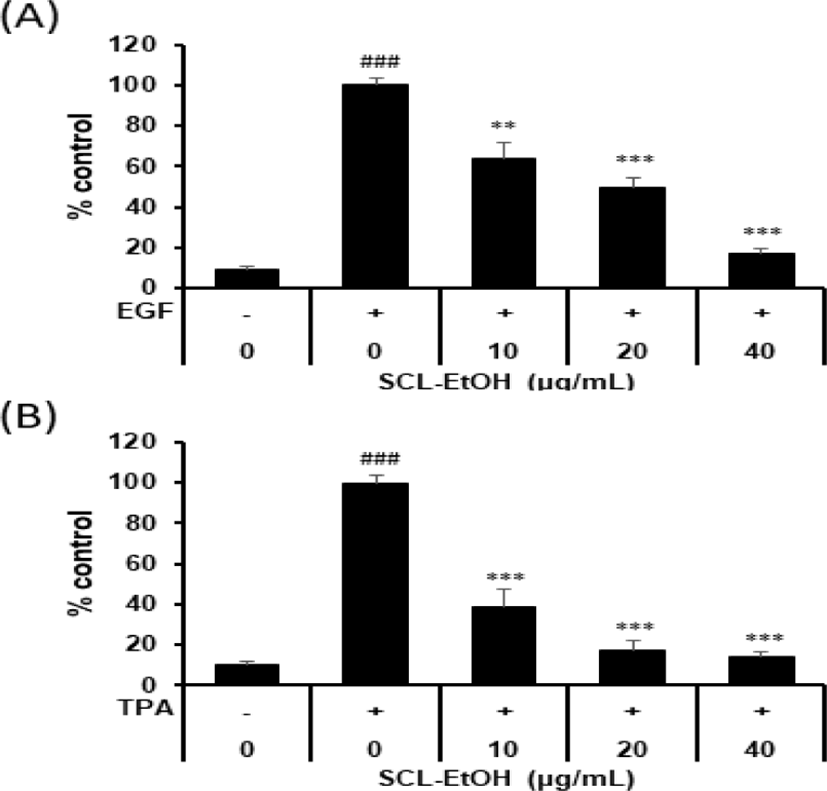
40㎍/㎖의 SCL-EtOH는 EGF 유도 발암 모델에서 EGF 단독 처리군에 비해 82.6±2.5%의 유의성 있는 억제율을 보였고, colony의 크기도 현저히 줄어드는 것을 확인하였다(Fig. 8, 9).

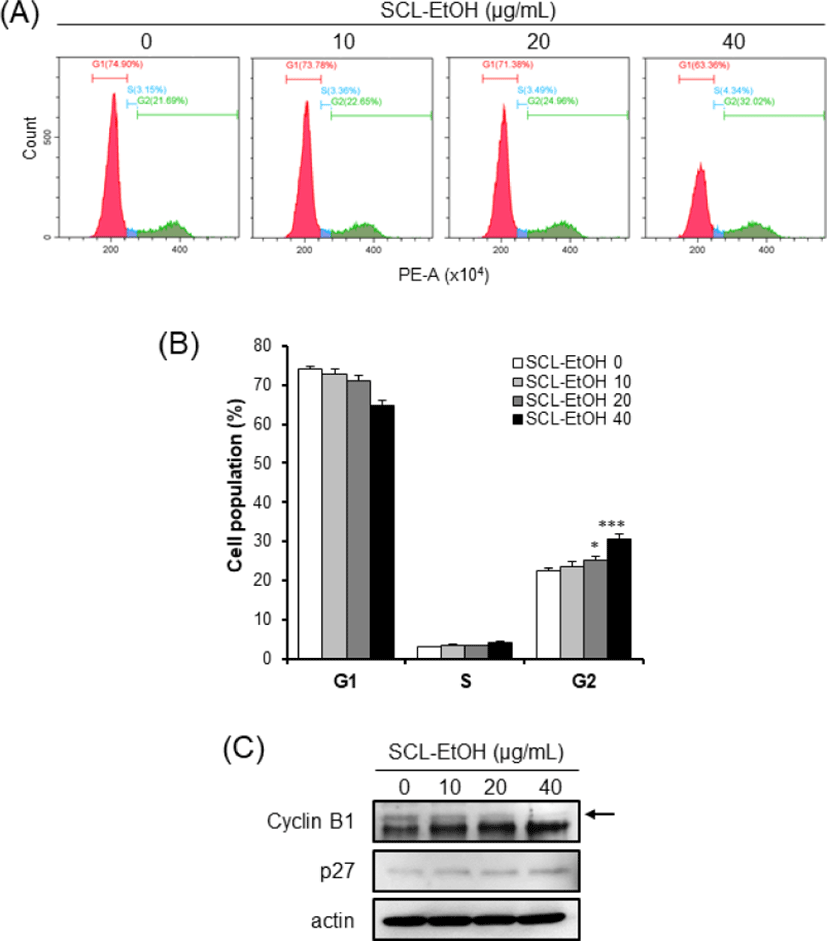
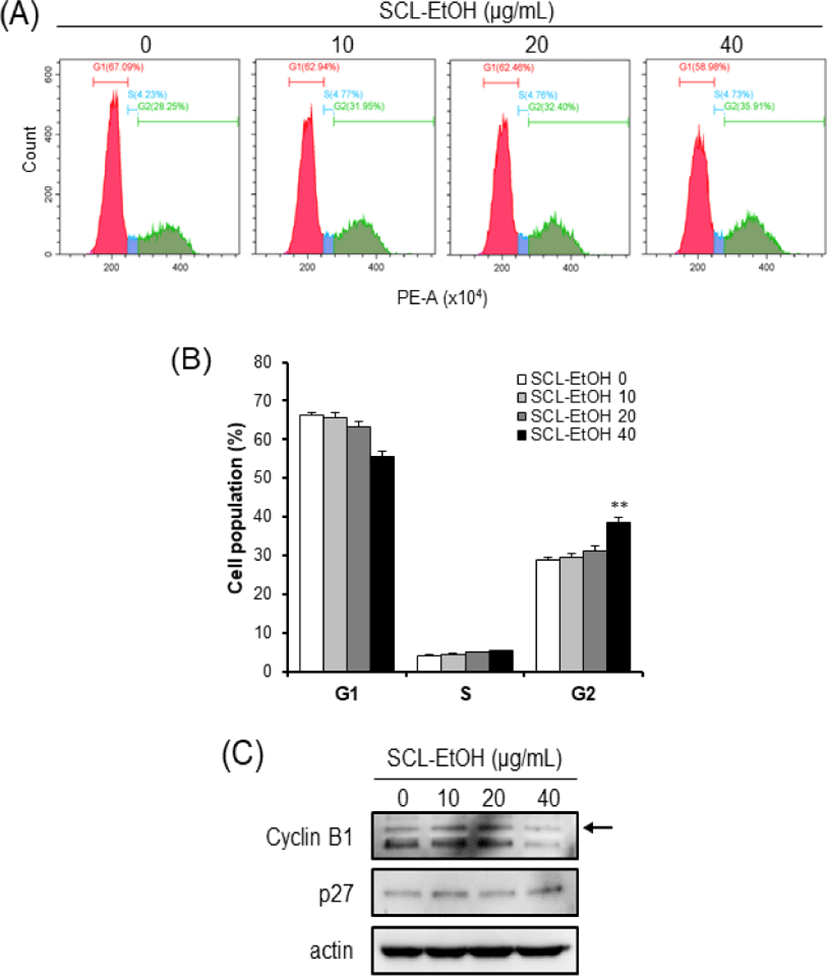
Flow cytometry 분석을 통하여 세포주기별 세포의 분포를 확인한 결과, SCL-EtOH의 농도(0, 10, 20, 40㎍/㎖)가 증가함에 따라 G2/M기에 있는 세포의 비율은 SK-MEL-5 cells에서 22.4±0.6%, 23.7±1.1%, 25.2±1.1%, 30.5±1.3%로(Fig. 10), SK-MEL-28 cells에서는 29.0±0.8%, 29.5±2.1%, 31.2±1.9%, 38.6±2.3%로 각각 유의성 있게 증가하였다(Fig. 11).
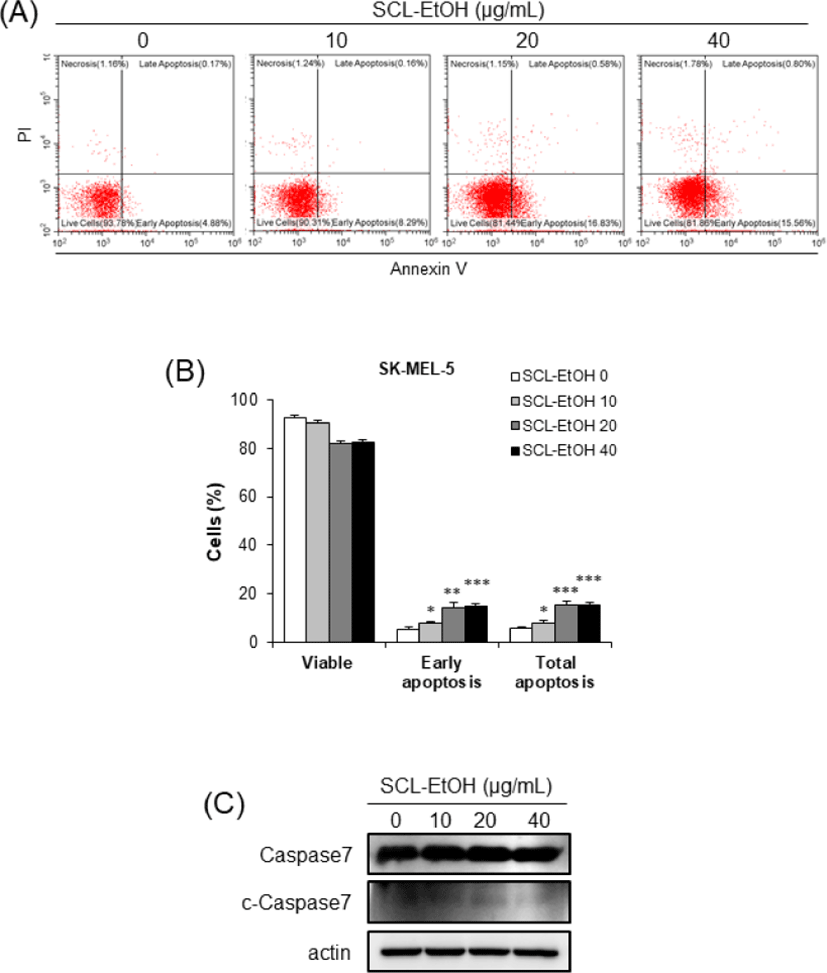
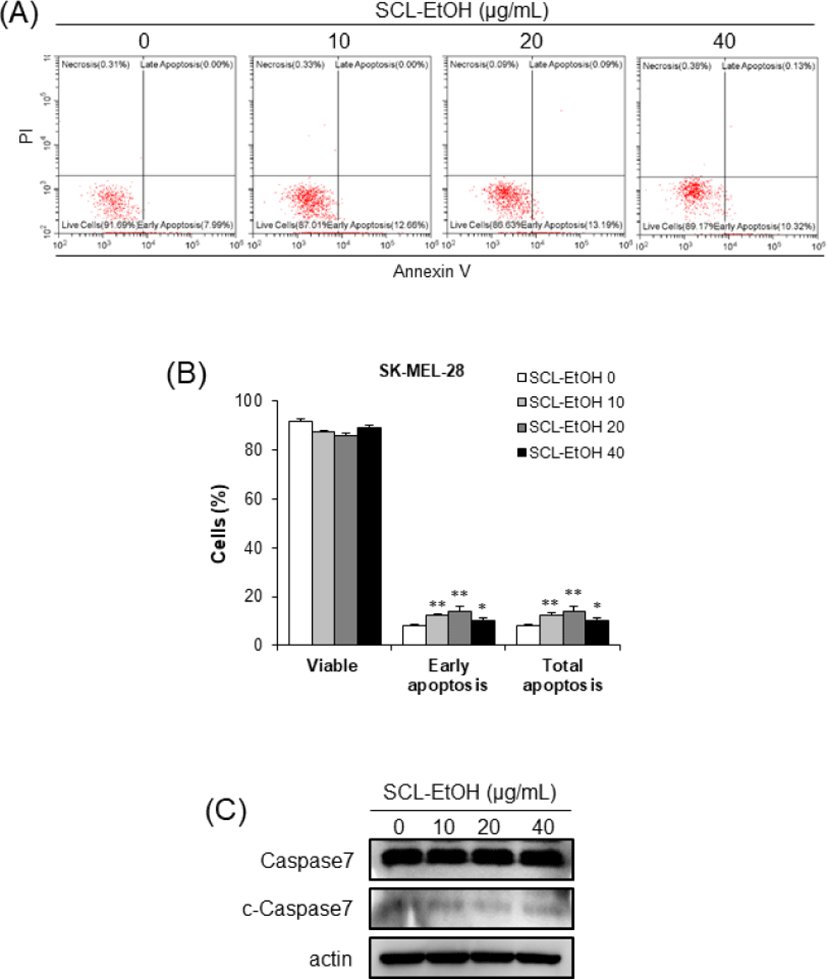
Annexin V/PI 염색 후 flow cytometry 분석을 통하여 SK-MEL-5 cells에서 SCL-EtOH의 농도가 증가할수록 early-apoptosis와 late-apoptosis를 포함한 total-apoptosis의 비율이 8.0±0.8%, 15.2±2.0%, 15.6±0.9%로 유의성 있게 증가하였다(Fig. 12). 또한 SK-MEL-28 cells에서도 7.9±0.8%, 12.4±2.1%, 14.0±1.9%, 10.6±2.3%로 SCL-EtOH의 처리에 따라 total-apoptosis 비율이 유의성 있게 증가하였다(Fig. 13).
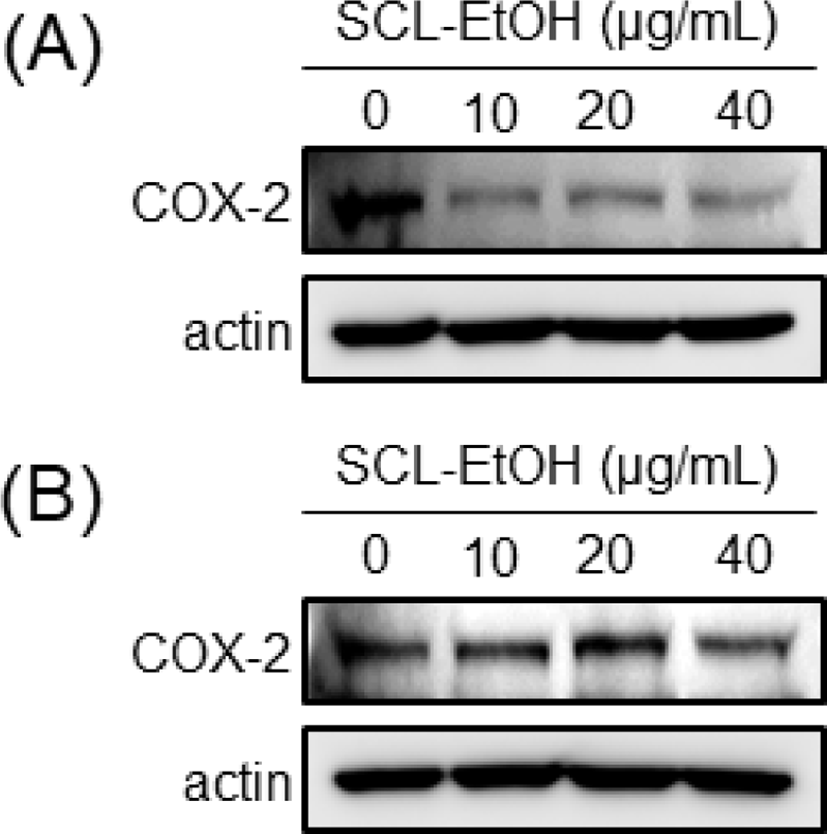
Western blot을 수행하여 염증인자의 생성과 관련된 단백질인 Cyclo- oxigenase-2(COX-2)의 발현을 살펴본 결과, SK-MEL-5와 SK-MEL-28 cells 모두에서 SCL-EtOH의 농도가 증가할수록 COX-2의 발현이 감소하였다(Fig. 14).
Ⅳ. 고 찰
지구온난화로 인한 자외선 노출, 인구 고령화, 오염원에 대한 노출 등에 의해 피부암의 발생률 및 사망률이 증가하고 있다21). 피부암은 인체의 가장 바깥층인 피부에서 발생하는 암으로 중·노년층에서 다발하고 크게 기저세포암, 편평상피세포암 그리고 악성 흑색종으로 나누어진다1-5). 기저세포암은 피부의 기저층이나 모낭 등을 구성하는 세포가 악성화한 종양으로, 각질형성세포나 모낭, 에크린한선 등의 피부부속기에서 발생하고, 편평상피세포암은 표피의 각질 형성 세포에서 유래한 악성종양으로 우리나라에서 가장 흔한 피부암 중 하나이다1-5). 악성 흑색종은 멜라닌 세포의 악성종양으로, 멜라닌 세포 또는 기존에 존재하는 모반세포의 악성 형질 변화로 악성도가 높은 종양 중 하나이다1-5). 흑색종은 전체 피부암의 5% 정도이나 발생률이 꾸준히 증가하고 있으며, 5년 생존율이 20% 미만으로 치료가 어려운 악성종양에 해당한다2-6). 국내의 경우, 국가통계포털의 암 등록 통계자료22)에 따르면 2020년에 총 247,952건의 암환자가 발생하였으며, 이 중 악성 흑색종을 포함하는 피부암 환자는 7,089명이었다. 이는 전체 암환자의 2.8%에 해당하며, 발생자수는 2010년 대비 1.9배 가량 증가하였다. 2020년에는 전 세계적으로 약 32만 5천 건의 새로운 흑색종 사례가 진단되었으며 사망자는 5만 7천 명 정도로 추정되어, 2040년에는 신규 사례 51만 명 및 사망 9만 6천 명으로 증가할 것으로 예상된다23,24).
현재 피부암 치료법으로는 외과적 절제술이 있으며 그 외에도 방사선 치료 및 항암 화학요법 등이 사용되고 있지만 수술요법은 한계가 있고 화학요법도 부작용이 많다1-5). 흑색종의 주요 치료는 수술적 제거이나 병리학적으로 구별이 매우 어렵고 최근 화학요법, 면역요법, 방사선요법 및 표적요법 또는 복합치료법인 다중항암화학요법, 다중면역요법 및 다중생화학요법과 같은 치료법이 발전하였지만, 흑색종의 치료는 여전히 매우 어렵다25,26). 그러므로 상대적으로 부작용이 적고 안전한 천연 생약에 대한 관심이 증가하고 있는데, 국내에서 단일 약재로는 鹿茸, 魚腥草, 吳茱萸, 旱蓮草, 天門冬, 紅花, 人蔘 蓬朮, 白殭蠶, 楡白皮, 차가버섯, 忍冬藤, 側柏葉, 防風, 甘菊 등이 피부암 증식 억제 효과가 있는 것으로 보고되었다27).
翻花瘡은 현대의학의 편평상피세포암, 기저세포암과 유사한데 피부에 나타난 腫瘤로 병변 부위가 파괴된 후 유합이 안 되고 胬肉이 밖으로 돌출하여 그 형상이 마치 꽃이 뒤집힌 것과 같아서 붙여진 이름이다. 한의학에서는 風毒之邪나 淫毒之氣 등 外因에 침습당한 경우, 瘡瘍이 潰한 후에 肝火로 인해 血燥하여 生風해서 發한 경우, 元氣가 허약한데 肝이 虛해져 血燥해지게 되고 이에 怒氣가 盛해서 發하는 경우, 怒火로 인한 경우 등으로 인해 번화창이 발생하는 것으로 보았고 扶正去邪의 관점에 의거하여 虛해진 肌膚와 脾胃土의 中氣를 자양하여 肌肉과 피부를 潤하게 하고, 肝火로 인한 怒氣를 살피며 아울러 外治도 겸하는 치법을 사용했다28).
土茯笭(Smilacis Rhizoma)은 다년생 활엽덩굴성 관목인 국내에서 자생하는 청미래덩굴(Smilax china Linné, SCL) 또는 중국에서 자생하는 光葉菝葜(Smilax glabra Roxburgh)의 뿌리줄기로, 본 연구에서 사용한 청미래덩굴은 명감나무 또는 망개나무로도 불리며, 5-6월에 꽃이 개화하고, 9-10월에는 둥글고 붉은 열매를 맺는다8,9). 性은 平하고 味는 甘淡하며 肝과 胃經으로 귀경하여 除濕, 解毒, 通利關節하는 효능이 있다8,9). 關節疼痛, 근육마비, 설사, 水腫, 痳病, 瘰癧, 腫毒 등을 치료하고 특히 매독, 연주창, 옹종, 수은 중독, 매독성 피부질환을 비롯한 만성 피부외과 질환의 치료 약물로 사용되고 있다8,29).
또 土茯笭에는 steroidal saponin인 smilax saponin A, B, dioscin, sieboldigenin, smilaxchinoside A-D, isonarthogenin glycoside 등이 함유되어 있고, flavonoid 계열 화합물인 astilbin, engelitin, neoastilbin, taxifolin, apigenin 등도 함유되어 있으며 또한 stilbene 계열 화합물인 resveratrol, oxyresveratrol, veraphenol, vis-scirpusin A 등이 함유되어 있다29).
현재까지 土茯笭은 항염증10-2), 항산화13), 항비만14,15) 그리고 항암16-9) 효과가 보고되었다. 장 등13)은 土茯笭의 항산화 및 산화적 DNA 손상억제 활성에 대해서 연구하였고, Xu 등10)은 土茯笭의 폴리페놀 성분이 염증성 장질환의 장내 미생물 불균형 조절 효과가 있다고 보고하였으나 土茯笭의 피부암 세포주에 대한 실험연구는 아직까지 접하지 못했기에, 본 연구에서는 국내에서 자생하는 청미래덩굴을 사용하여 土茯笭 에탄올 추출물(SCL-EtOH)이 피부암 세포주인 A431, SK-MEL-5, SK-MEL-28의 성장에 미치는 영향을 확인해 보고자 하였다.
먼저 SCL-EtOH가 사람의 정상 피부 세포주에 대한 독성을 나타내는지 관찰하기 위하여 HaCaT cells에 SCL-EtOH를 다양한 농도(0, 5, 10, 20, 40㎍/㎖)로 처리하고 24시간 및 48시간 동안 반응시켜 WST-8 분석을 수행하였다. 실험결과, 48시간에서 최고 농도인 40㎍/㎖까지 독성이 나타나지 않음을 확인하였다(Fig. 3).
이어서 SCL-EtOH가 다양한 피부암 세포주의 성장에 미치는 영향을 확인하기 위해 A431 및 SK-MEL-5, SK-MEL-28 cells에 SCL-EtOH와 대조군으로 5-FU를 처리하고 24시간, 48시간, 72시간 후에 WST-8 분석을 수행하였다. 실험 결과, SCL-EtOH가 SK-MEL-5, SK-MEL-28에서 5-FU보다 농도 및 시간 의존적으로 유의성 있게 세포 성장 저해효과가 있음을 보여주었다(Fig. 4-6). A431을 제외한 SK-MEL-5와 SK-MEL-28 cells에서 항암제인 5-FU보다 더 뛰어난 성장 저해 효과를 나타내어, 이후 실험에서는 SK-MEL-5 및 SK-MEL-28 cells를 사용하여 실험을 진행하기로 하였다. SK-MEL-5와 SK-MEL-28 cells에서 항암제인 5-FU보다 더 뛰어난 피부암 세포 성장 저해 효과를 나타냈다는 것은 부작용이 없으면서도 기존 항암제보다 뛰어난 항암 효과로, 향후 흑색종 치료제로서의 가능성이 충분하다고 사료된다.
피부암 세포 형태에 미치는 영향을 확인한 결과 SCL-EtOH의 농도가 증가함에 따라 정상적으로 부착하여 성장하는 세포가 줄어들고 부유 상태인 세포가 증가하며, 세포의 형태가 변화하는 것을 관찰하였다(Fig. 7).
쥐의 정상 상피세포인 JB6 Cl41 cells에 성장인자 EGF와 염증인자 TPA를 처리해 세포변형을 유도하고 SCL-EtOH의 세포변형 억제 및 성장 억제 효과를 확인하기 위해 Anchorage independent cell growth assay를 수행하였다. 그 결과 세포의 형질전환을 유도한 발암 모델 모두에 대하여 SCL-EtOH의 농도가 증가할수록 세포의 형질전환을 억제하여 colony 형성 및 성장을 억제하는 것을 확인하였다(Fig. 8, 9).
EGF는 종양 촉진자로, EGF 수용체(EGFR)에 결합하면 세포 증식, 세포 변형, 혈관 신생 및 전이에 관여하는 Ras-Raf-MEK-MAPK 및 PI3K-PTEN-AKT 신호전달경로와 같은 EGFR 신호전달경로를 활성화하여 발암을 촉진한다30). TPA는 대극과(Euphorbiaceae) 식물 및 巴豆油에 많이 함유된 phorbol ester의 일종으로, 세포의 성장과 사멸과 관련된 다양한 기전에서 조절자로 작용하는 protein kinase C(PKC) 및 activator protein-1을 활성화하여 세포변형을 유도하는 강력한 발암 촉진제이다31,32). Anchorage-independent cell growth 분석법은 soft agar를 이용해 세포를 부유 상태로 배양시키는 방법으로, 사방으로 증식하며 자라는 암세포의 특성을 살려 colony 형성과 전이 능력을 확인할 수 있는 실험법으로 정상 세포에 EGF나 TPA를 처리하여 transformation을 유도함으로써 정상 세포의 암화 및 성장을 유사하게 구현할 수 있는 이점이 있다.
SCL-EtOH가 피부암 세포의 세포주기 및 세포사멸에 미치는 영향을 확인하기 위하여 SK-MEL-5, SK-MEL-28 cells에 다양한 농도(0, 10, 20, 40㎍/㎖)의 SCL-EtOH를 처리한 후 관찰하였다. Flow cytometry를 사용하여 분석한 결과 SCL-EtOH의 농도가 증가함에 따라 두 피부암 세포주에서 G2/M기에 머물러 있는 세포의 비율이 유의성 있게 증가하였고 total-apoptosis 비율이 유의성 있게 증가하였다.
또한 Western blot을 통해 G2/M기 조절 관련 단백질인 Cyclin B1의 발현 감소와 p27의 발현 증가를 확인하였고, 세포사멸 기전에서 사포사멸의 실행자로(excutioner)로 불리는 중요한 단백질인 활성화된(cleaved)-caspase7의 발현 증가를 확인하였다(Fig. 10-13). 세포주기는 G1, S, G2, M 주기로 구성되며 이런 세포주기 조절에 cyclin 단백질의 합성과 소멸이 중요한 역할을 한다33). Cyclin은 세포분열의 각 주기에서 그 발현이 특이적으로 증가했다가 감소하며 cyclin dependant kinase(CDK)들과 결합하여 작용을 나타낸다. Cyclin B1의 발현은 암의 악성도 지표로서 중요한 역할을 한다. CDK 억제제(inhibitor) 중의 하나인 p27은 cyclin A/B-CDC2 복합체의 활성을 억제하여 세포주기의 진행을 막는다34).
발암은 만성 염증과 연관성이 있으며, 세포증식 증가, 세포사멸 회피, 신생혈관 형성 및 전이 등의 다양한 과정에서 염증 매개체인 cytokine, chemokine, cyclo- oxigenase-2(COX-2), prostaglandin(PG), 유도성 산화질소 합성효소(iNOS) 등의 비정상적인 활성화가 일어나게 된다35,36). 본 연구에서는 SCL-EtOH가 SK-MEL-5, SK-MEL-28 cells에서 염증인자의 생성과 관련된 대표적인 단백질 중 하나인 COX-2의 발현을 저해하는지 확인하기 위하여 western blot을 실시하였는데 SCL-EtOH의 농도에 의존적으로 COX-2의 발현이 감소하는 것을 확인하였다(Fig. 14).
이상의 결과로부터 土茯笭 에탄올 추출물이 피부암 치료에 있어서 긍정적인 영향을 주는 것으로 생각된다. 특히 흑색종 세포주인 SK-MEL-5와 SK-MEL-28 cells에서 기존 항암제인 5-FU보다 더 뛰어난 세포 성장 저해 효과를 나타냈다는 것에 주목하여, 앞으로 다양한 흑색종 세포주를 대상으로 기존 항암제와 비교하는 연구로 확대하고, 동물모델에서의 연구도 필요할 것으로 사료된다. 더 나아가 흑색종 환자를 대상으로 土茯笭의 효능을 확인하는 임상적인 연구도 이루어지기를 기대해 본다.
Ⅴ. 결 론
-
SCL-EtOH는 HaCaT cells에 40㎍/㎖의 농도까지 세포독성이 없었다.
-
SCL-EtOH가 시간 및 농도 의존적으로 비흑색종 세포주 A431과 흑색종 세포주 SK-MEL-5, SK-MEL-28의 성장을 유의성 있게 억제하였다.
-
SCL-EtOH의 처리에 따라서 농도가 증가할수록 피부암 세포의 형태가 변화하였다.
-
JB6 Cl41 cells에 EGF 또는 TPA로 세포변형을 유도한 다음, SCL-EtOH를 농도별로 처리한 결과, 농도 의존적으로 colony가 유의성 있게 감소하였다.
-
피부암 세포의 성장저해가 세포주기 영향에 의한 것인지 확인한 결과, SCL-EtOH가 G2/M phase arrest를 유도하며, 관련 단백질인 Cyclin B1의 발현을 감소시켰고 p27의 발현을 증가시켰다.
-
피부암 세포의 성장저해가 세포사멸에 의한 것인지 확인하기 위하여 flow cytometry 분석과 western blot을 수행한 결과, SCL-EtOH가 early apoptosis를 유도하며, 관련 단백질인 cleaved-caspase-7의 발현을 증가시켰다.
-
SCL-EtOH에 의해 염증 지표 단백질인 COX-2의 발현이 감소하였다.






