I. 서 론
메니에르병의 유병률은 미국에서 10만 명당 190명으로 나타났다. 연령에 따라 증가하여 18세 미만 환자 10만 명당 9명에서 65세 이상 환자 10만 명당 440명으로 증가하였으며, 여성과 남성 비율은 1.89:1이었다1). 한국에서도 메니에르병의 유병률과 연간 발병률은 꾸준히 증가하였다. 2013년에서 2017년 사이 유병률은 10만 명당 약 36명에서 153명으로 4.3배 증가하였고, 연간 발병률은 10만 명당 약 30명에서 118명으로 4배 증가하였다. 고령으로 갈수록 발병률이 급증하였으며, 여성이 남성보다 2.17배 더 많이 발병하는 것으로 나타났다2).
메니에르병에 대한 치료 연구가 다양하게 보고되고 있지만 효과적인 치료로 확립된 것은 없다. 메니에르병의 특성상 발병 원인이 다양하고 불확실하여 병인에 따른 치료가 어렵고, 일반 질병과 달리 자연적 회복이 이루어지기 때문에 치료 효과를 평가하기 어렵다. 메니에르병 치료의 1차 목표는 어지럼증 발작의 지속시간과 빈도를 줄이는 것이고, 2차적으로 난청을 예방하고 이명을 완화시키는 것이다3).
二陳湯은 《太平惠民和劑局方》에 최초로 기록되어 《東醫寶鑑》 등에 이르기까지 여러 시대를 거쳐 임상에 활용된 처방이다4). 半夏(Pinellia ternate), 陳皮(Citrus unshiu), 赤茯苓(Poriacocos), 炙甘草(Glycyrrhiza uralensis), 生薑(Zingiber officinale)으로 구성되어 있으며, 痰飮을 치료하는 데 가장 기본이 되는 처방이다.
痰飮은 체내의 과다한 수분이 일부에 정취된 것으로 비생리적인 분비물을 의미하는데5), 메니에르병에서 나타나는 내림프 수종은 한의학에서 津液 대사의 병리적 산물인 水濕, 痰飮으로 이해된다6).
저자들은 이에 네트워크 약리학을 활용한 메니에르병에 대한 二陳湯의 활성 성분과 치료 기전 연구(I)7)를 통하여 메니에르병에 二陳湯을 구성하는 약재들이 어떤 활성 성분과 타겟 단백질을 가지고 있으며, 어떤 치료 기전을 가지는지 확인하였다. 본 연구는 그 후속 연구로 二陳湯과 기존의 메니에르병 치료 가이드라인에서 권고되는 약물의 치료 기전과의 비교 분석으로 二陳湯이 가지는 치료의 작용점과 가이드라인 권고 약물이 가지는 치료의 작용점이 공통적으로 작용하는 경로와 독자적으로 작용하는 경로를 네트워크 약리학을 통해 확인하고 고찰해보고자 한다.
II. 연구 방법
현재 메니에르병에 권고되는 양약 성분을 확인하기 위하여 2020년 4월 15일까지의 기간 동안 출간된 메니에르병 가이드라인을 체계적으로 평가한 논문8)에서 검색된 가이드라인을 포함하였으며, 동일한 방식으로 검색한 결과 2022년 8월 10일까지의 기간 동안 추가적으로 출간된 메니에르병 가이드라인은 없음을 확인하였다. 2020 American Academy of Otolaryngology-Head and Neck Surgery(AAO-HNS)3), 2018 European Academy of Otology and Neurotology9), 2017 French Otorhinolaryngology-Head and Neck Surgery Society(SFORL)10), 2018 International Consensus(ICON)11), 2021 Japan Society of Equilibrium Research12), 2021 National Institute for Health and Care Excellence(NICE)13) 6개의 가이드라인에서 권고하는 모든 약 성분을 추출하였다. 추출한 약 성분의 타겟 단백질을 수집하기 위하여 STITCH에서 성분의 이름으로 검색을 시행하였고, organism은 homo sapiens로 지정하였다. 검색 결과에서 interaction score가 high confidence(0.700) 이상의 기준을 충족하는 단백질을 선별하였다.
앞서 수집한 타겟 단백질을 대상으로 venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/)을 사용하여 벤 다이어그램 그래프를 작성하였다. 二陳湯과 메니에르병 및 메니에르병에 권고되는 양약 간의 교차 내용을 시각화하여 확인하였다. 각 군의 결과는 통합하여 중복을 제거하였다.
Ⅲ. 결 과
메니에르병 가이드라인에서 권고하고 있는 양약의 성분을 통합하고 중복을 제거하여 총 21개의 양약 성분을 수집하였다.
STITCH에서 각각의 양약 성분이 타겟으로 하는 단백질을 검색하였고, 검색 결과에서 interaction score가 high confidence(0.700) 이상의 기준을 충족하는 단백질을 선별하였다. 결과를 통합하고 중복을 제거하여 총 77개의 단백질을 수집하였다(Appendix 1).
앞서 네트워크 약리학을 활용한 메니에르병에 대한 二陳湯의 활성 성분과 치료 기전 연구(I)에서 수집한 二陳湯의 타겟 단백질, 메니에르병 연관 유전자와 메니에르병에 권고되는 약물 타겟 단백질을 대상으로 벤 다이어그램을 작성하여 각 군집 사이의 교차 대상을 확인하였다(Fig. 1).
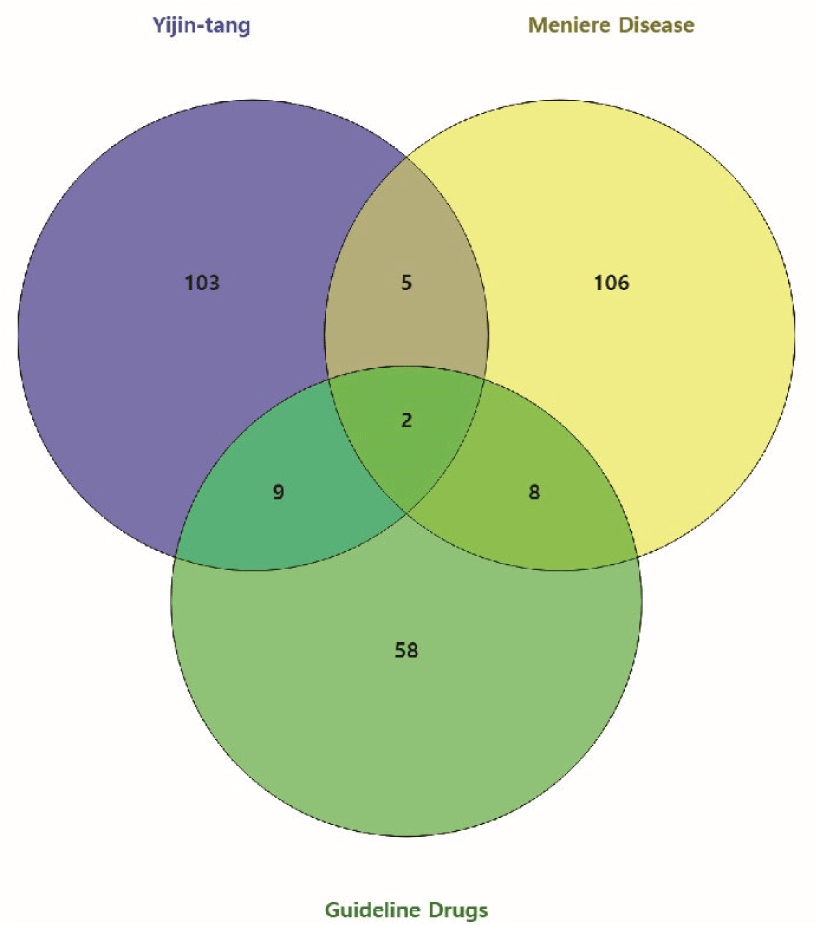
二陳湯과 메니에르병에 모두 연관이 있는 단백질은 총 7개로 TNF, CASP9, PARP1, CCL2, CFTR, NOS2, NOS1이었으며, 가이드라인 권고 약물과 메니에르병에 모두 연관이 있는 단백질은 총 10개로 AQP2, KCNE1, AQP1, AVP, ACE, HRH1, HRH3, NOS1, CA1, CFTR이었다. 세 군 모두에서 교차하는 단백질은 CFTR, NOS1이었다.
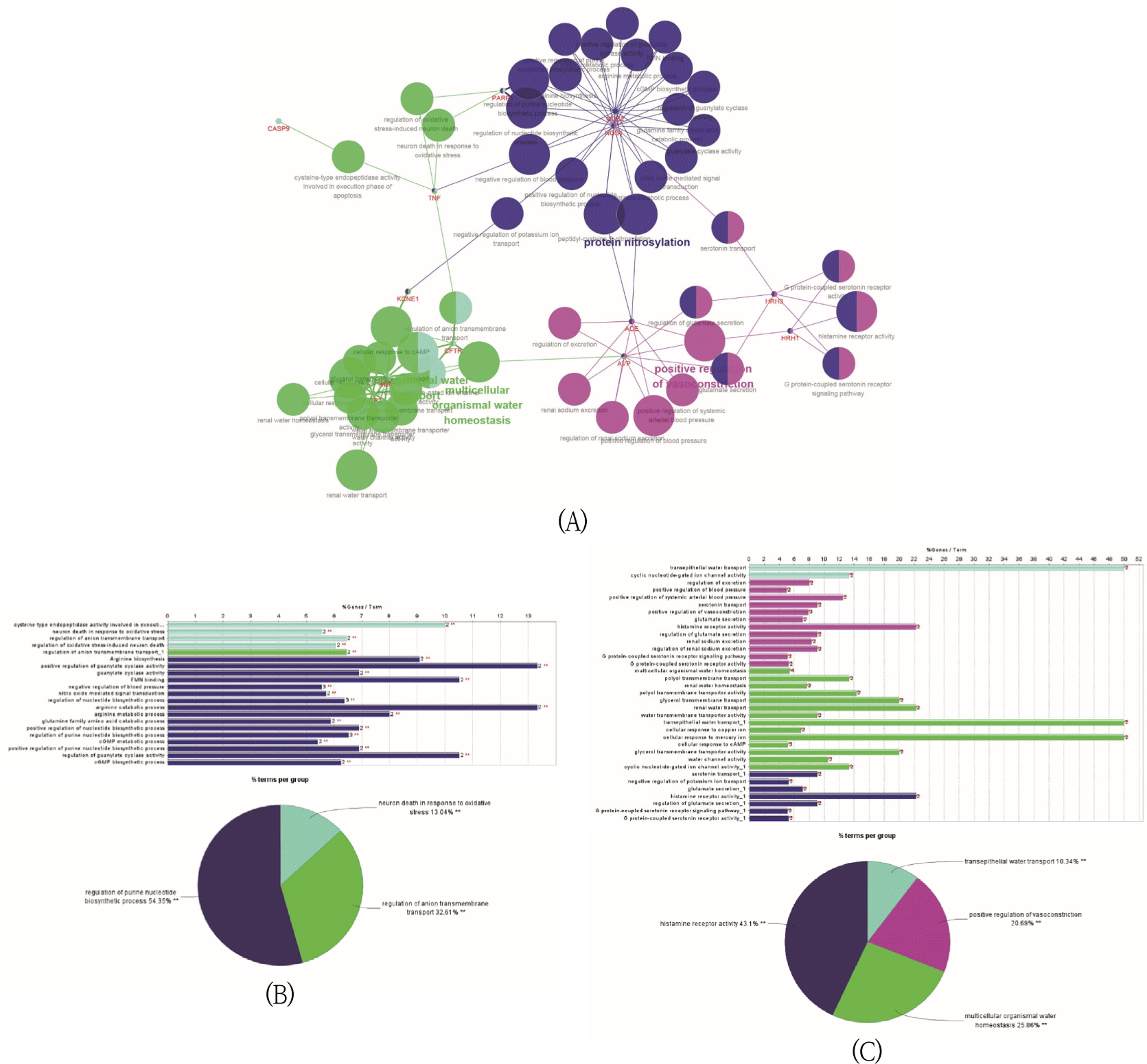
메니에르병 연관 단백질과 二陳湯 활성 성분의 타겟 단백질 사이 총 7개의 공통 타겟 단백질군을 cluster #1, 그리고 메니에르병 연관 단백질과 메니에르병 권고 양약 성분의 타겟 단백질 사이 총 10개의 공통 타겟 단백질군을 cluster #2로 지정하여 분석을 수행하였다. p value<0.05 조건에서 GO database에서 56개의 Biol ogical Process Term, 1개의 Molecular Function Term이 도출되었으며, KEGG database에서 1개의 pathway가 도출되어 총 58개의 pathway가 확인되었다. 二陳湯에서의 기능적 그룹은 regulation of purine nucleotide biosynthetic process(54.35%), regulation of anion transmembrane transport(32.61%), neuron death in response to oxidative stress(13.04%) 3가지로 이루어졌으며, 가이드라인 약물에서의 기능적 그룹은 histamine receptor activity(43.1%), multicellular organismal water homeostasis(25.86%), positive regulation of vasoconstriction(20.69%), transepithelial water transport(10.34%) 4가지로 이루어졌다(Fig. 2).
Ⅳ. 고 찰
메니에르병 연관 단백질과 二陳湯 활성 성분의 타겟 단백질 사이 총 7개의 공통 타겟 단백질군과 메니에르병 연관 단백질과 메니에르병 권고 양약 성분의 타겟 단백질 사이 총 10개의 공통 타겟 단백질군을 분석하였을 때 각각 二陳湯에서의 기능적 그룹은 regulation of purine nucleotide biosynthetic process, regulation of anion transmembrane transport, neuron death in response to oxidative stress 3가지로 이루어졌으며, 가이드라인 약물에서의 기능적 그룹은 histamine receptor activity, multicellular organismal water homeostasis, positive regulation of vasoconstriction, transepithelial water transport 4가지로 이루어졌다.
二陳湯의 regulation of purine nucleotide biosynthetic process에 연관된 유전자는 NOS1, NOS2, PARP1, TNF이고, regulation of anion transmembrane transport에 연관된 유전자는 PARP1, TNF, CASP9, CFTR이고, neuron death in response to oxidative stress에 연관된 유전자는 TNF, CFTR이었다. 가이드라인 약물의 histamine receptor activity에 연관된 유전자는 NOS1, HRH1, HRH2, ACE, AVP, KCNE1, multicellular organismal water homeostasis에 연관된 유전자는 CFTR, AQP1, AQP2, AVP, positive regulation of vasoconstriction에 연관된 유전자는 NOS1, HRH1, HRH2, ACE, AVP, transepithelial water transport에 연관된 유전자는 CFTR, AQP1, KCNE1이었다.
두 결과 그래프를 비교해보면, 二陳湯 그룹과 가이드라인 약물 그룹 사이에서 동일한 성분의 작용이 다른 기능적 그룹으로 해석되었다. 二陳湯을 기준으로 분류하였을 때 기능적 그룹은 각각 regulation of purine nucleotide biosynthetic process가 histamine receptor activity와 대응하고, regulation of anion transmembrane transport가 multicellular organismal water homeostasis와 대응하며 neuron death in response to oxidative stress는 transepithelial water transport에 대응할 수 있다. 반면, 가이드라인 약물 그룹과 二陳湯 그룹과의 차이는 二陳湯 그룹에는 해당되지 않는 유전자인 AQP1과 AQP2가 연관된 multicellular organismal water homeostasis, ACE와 AVP가 연관된 positive regulation of vasoconstriction, HRH1과 HRH3가 연관된 histamine receptor activity 기전에 기인한다. 또한 二陳湯의 regulation of anion transmembrane transport는 가이드라인 약물의 multicellular organismal water homeostasis보다 적은 비중을 차지하고 있었으며, 二陳湯에서 나타나지 않는 기능적 그룹은 positive regulation of vasoconstriction이었다. 따라서 二陳湯의 작용 기전은 면역 이상, 내림프액 항상성 이상, 흥분 독성, 산화 스트레스, 세포 사멸의 경로와 연관성을 가진다면, 가이드라인 약물의 작용 기전은 면역 이상과 내림프액 항상성 이상, 그리고 추가적으로 혈관 확장을 통한 혈류 순환 개선 기전으로 설명할 수 있을 것으로 보인다.
따라서 가이드라인 약물과 비교하였을 때 메니에르병의 한약 치료에 있어서 二陳湯을 활용할 때 혈류 순환 개선 기능을 가진 약재 혹은 처방이 더해지거나, 혈류 순환 개선 기능을 가진 약물의 병용을 제안할 수 있다. 임상에서도 메니에르병 및 관련 증상의 한약 치료에 대하여 二陳湯을 단독으로 사용하기보다는 대부분 二陳湯을 기본방으로 하여 가감한 처방을 활용하고 있으며, 半夏白朮天麻湯14-7), 淸肝二四湯15), 防眩溫膽湯15), 香砂六君子湯18)과 같은 처방의 메니에르병 치료 효능을 확인하였다. 다만 해당 논문들은 증례 논문으로 한약 치료 이외에도 침, 약침, 뜸 등의 한방 치료를 병행하여 증상 완화에 영향을 미쳤을 가능성이 있으며, 수집한 증례 수가 적어 일반화하기는 어려운 점이 있다.
positive regulation of vasoconstriction 기능 그룹에 연관된 유전자(NOS1, HRH1, HRH2, ACE, AVP)에서 二陳湯의 작용점을 제외한 유전자에 작용하는 가이드라인 약물은 betahistine, hydrochlorothiazide, spironolactone, furosemide가 있다. 특히 betahistine은 H3수용체의 역작동제(inverse agonist)로 달팽이관 혈류를 증가시키는 작용을 가지며19), 가격이 저렴하고 부작용이 적어 유럽에서 가장 많이 처방되는 메니에르병 치료약 중 하나이다20). 그러나 메니에르병에 대한 betahistine의 효과를 입증할 충분한 근거는 아직 없으며21), 二陳湯을 가감한 처방과 betahistine을 병용할 때 안전성에 대한 충분한 검토가 이루어지지 않은 등의 한계가 있어 향후 더 많은 연구가 필요할 것으로 보인다.
Ⅴ. 결 론
본 연구는 메니에르병에 대한 二陳湯의 치료 기전을 분석하기 위하여 네트워크 약리학 방법론을 활용하여 메니에르병 치료 가이드라인에서 권고되는 약물의 치료 기전과 비교 분석하였다. 총 21개의 가이드라인 권고 약물 성분을 확인하였으며 타겟 단백질은 총 77개였다. 二陳湯과 메니에르병에 모두 연관이 있는 단백질은 총 7개로 TNF, CASP9, PARP1, CCL2, CFTR, NOS2, NOS1이었으며, 가이드라인 권고 약물과 메니에르병에 모두 연관이 있는 단백질은 총 10개로 AQP2, KCNE1, AQP1, AVP, ACE, HRH1, HRH3, NOS1, CA1, CFTR이었다. 세 군 모두에서 교차하는 단백질은 CFTR, NOS1이었다. 다음으로 수집한 단백질을 GO/KEGG pathway 분석한 결과, 二陳湯과 가이드라인 권고 약물의 공통적인 작용 기전은 면역 이상과 내림프액 항상성 이상 등의 경로와 관련이 있었으며, 가이드라인 권고 약물은 추가적으로 혈관 확장을 통한 혈류 순환 개선 기전 작용을 하는 것으로 보인다.






