Ⅰ. 서 론
피부 노화는 시간의 흐름에 따른 내인성 노화와 외부 요인으로 인한 외인성 노화로 나눌 수 있다. 자외선은 외인성 노화에서 가장 많은 비중을 차지하며 활성산소 및 염증성 사이토카인의 발현을 증가시켜 노화를 가속화한다. 그중 tumor necrosis factor-α(TNF-α)는 염증성 사이토카인 중 하나로 matrix metallo-proteinases (MMPs)를 활성화시켜 extracellular matrix(ECM) 성분의 분해를 유발하여 노화를 가속화한다1-3). 진피의 ECM은 대부분 type Ⅰ 콜라겐으로 이루어져 있다. 콜라겐의 전구체 물질은 섬유아세포에 의해 합성되며 콜라겐은 피부에 힘과 지지력을 부여한다. 그렇기 때문에 콜라겐의 합성 감소 및 분해는 피부 노화와 직결되어 있다. 콜라겐의 분해와 관련 있는 핵심 단백질은 MMPs이다. MMPs는 염증, 혈관 신생, 상처 치유 등의 상황에서 광범위하게 단백질 분해에 관여하는 효소로 피부 진피를 구성하는 ECM 단백질을 분해하는 역할을 한다. 현재까지 약 25개의 종류가 알려져 있으며, collagenase, gelatinase, stromelysin 등으로 분류된다. 그중 MMP-1은 ECM의 대부분을 차지하는 type Ⅰ 콜라겐을 분해하여 주름을 유발하는 것으로 알려져 있다4,5).
표피는 자외선에 노출되는 가장 최외각 층이다. 자외선에 의한 자극으로 reactive oxygen species(ROS)와 TNF-α 등의 염증성 사이토카인이 생성되며 이는 표피의 아래에 위치한 진피의 섬유아세포를 자극하게 된다. 자외선으로 유도된 사이토카인은 MAPKs를 활성화시키고 activator protein-1(AP-1), nuclear factor kappa B(NF-κB) 등의 전사인자들을 활성화시켜 MMP-1의 발현을 증가시킨다. 이는 곧 콜라겐의 분해로 이어져 주름이 발생한다. 인간 표피 각질세포에서 UVA는 MMP-1을 유도하지 않았지만, UVA를 통해 발생한 TNF-α가 인간 섬유아세포에서 MMP-1을 유도한다는 연구가 보고되었다6-8). 즉, 염증성 사이토카인으로 유도된 MMP-1의 발현 조절은 피부 노화의 중요한 표적이라고 볼 수 있다.
淸肺瀉肝湯(Chungpyesagan-tang, CPSGT)은 《東醫壽世保元》9)에 수록되어 있는 熱多寒少湯에 大黃 4g을 加한 처방으로, 太陰人 肝受熱裏熱病證편에 太陰人 燥熱病에 사용되는 방제로 기재되어 있다. 현대에 들어서 淸肺瀉肝湯은 중풍의 진행을 억제한다고 알려져 급성 중풍에 많이 사용되고 있다. 《東醫壽世保元》에는 ‘諸澁枯涸皺揭 皆屬於燥’라고 기록되어 淸肺瀉肝湯이 燥熱證에 쓰임을 알 수 있다. 燥熱證으로 기술된 증상들을 보면 頭面項頰赤腫, 咽喉腫痛, 痰涎甕盛, 睛疼, 赤眼口瘡 등의 熱症과 不汗出, 手指焦黑癍瘡, 皮膚毛髮爪甲乾燥, 脚弱腰痛, 耳聾目暗의 燥症이 나타난다. 熱證의 증상들이 나타난 상태에서 裏熱이 지속되면서 氣液이 고갈되어 燥證의 증상들이 나타나게 되는 것이다10-2). 이러한 병리적 과정은 氣, 血, 津液, 精과 같은 인체 구성 물질이나 에너지가 소모되면서 나타나는 신체 기능 저하로 볼 수 있는데, 질병이나 노화의 과정과 연결된다.
淸肺瀉肝湯에 대한 최근 연구로는 중풍13), 혈소판 응집 억제14), 허혈/재관류 환경에서의 세포 보호15), 중대뇌동맥 폐쇄 후 재관류16), 관절염17), lipase 활성 저해 및 체중 감량, 혈장 지질, UCP 1,2 발현18), 비만19), 당뇨20), 항산화21) 등에 대해 보고되었으나, 피부 항노화에 대한 연구는 없었다. 이에 본 연구에서는 淸肺瀉肝湯의 항산화 효과에 관한 선행 연구21)에 기반을 두어 인간 섬유아세포인 Hs68 세포에서 TNF-α로 유도된 MMP-1의 억제 효과와 그에 따른 신호전달경로를 확인하고자 하였다.
Ⅱ. 재료 및 방법
한약재 규격품을 ㈜HMAX(Korea)에서 구입한 후 제조하였다. 사용된 약재는 다음과 같다(Table 1).
약재를 증류수 2,000㎖에 넣고 heating mantle (MS-DM607, M-TOPS, Korea)을 이용하여 100℃에서 4시간 동안 추출하였다. Filter paper(Advantec, Tokyo, Japan)로 여과한 다음, 감압농축기(CH-9230 Flawil 1, BUCHI Switzerland)로 감압 농축하였다. 초저온 냉동고에서 24시간 동안 냉각시킨 후 동결 건조하여 건조분말 17.9g을 얻었다. 수율은 약 14%였다.
Hs68 세포는 American Type Culture Collection (ATCC)에서 구입하여 사용하였다. 10%의 FBS (GenDEPOT, USA)와 1% penicilin/streptomycin (GenDEPOT, USA)을 포함한 Dulbecco’s Modified Eagle Medium(DMEM, GenDEPO, USA)을 이용해 37℃, 5% CO2 조건에서 배양하였다.
CPSGT의 세포 독성을 평가하기 위해 MTT assay를 진행하였다. Hs68 세포를 96 well plate에 5×103cells/well로 분주한 후 24시간 동안 배양하였다. 상층액을 제거한 후 CPSGT를 농도별로 처리하고 24시간 동안 배양하였다. 5㎎/㎖의 MTT를 처리하고 4시간 동안 반응시킨 후, 상층액을 제거하였다. Dimethylsulfoxide(DMSO)를 이용하여 용해시키고 spectrophotometer로 570㎚에서 흡광도를 측정하였다.
CPSGT가 MMP-1 mRNA 발현에 미치는 효과를 확인하기 위해 real-time RT-PCR을 진행하였다. Hs68 세포를 60㎜ plate에 6×105cells/well로 분주한 뒤 24시간 동안 배양하였다. 200, 400 및 800㎍/㎖의 농도로 CPSGT를 전처리한 후, TNF-α를 처리하여 24시간 동안 배양하였다. RNA는 Trizol reagent(Ambion, USA)를 이용하여 추출하였다. Diethylpyrocarbonate (DEPC, Sigma, USA)로 용해시키고, Nano Drop 2000(Thermo Fisher, USA)으로 정량하였다. cDNA는 cDNA 합성 kit(ReverTra ACE-⍺, Toyobo, Japan)를 이용하여 합성하였다. cDNA와 Taqman master mix(Thermo Fisher, USA)를 이용해 real-time RT-PCR을 진행하였다. 실험에 사용한 probe들은 Table 2에 나타내었다.
| Symbol | Gene Name | Assay ID |
|---|---|---|
| GAPDH | Glyceraldehyde-3-phosphate dehydrogenase | Hs02786624_g1 |
| MMP-1 | matrix metalloproteinases-1 | Hs00899658_m1 |
CPSGT의 MMP-1 억제 신호전달경로를 확인하기 위해 western blotting을 진행하였다. Hs68 세포를 60㎜ plate에 6×105cells/well로 분주한 뒤 24시간 동안 배양하였다. 200, 400 및 800㎍/㎖의 농도로 CPSGT를 전처리한 후, TNF-α를 15분 동안 처리하였다. Halt™ protease and phosphatase inhibitor cocktail, EDTA-free(Thermo Fisher, USA)를 첨가한 RIPA lysis extraction buffer(Thermo Fisher, USA)를 이용하여 세포를 용해시키고 원심분리 하였다. 얻은 단백질은 Pierce™ BCA Protein Assay Kit(Thermo Fisher, USA)로 정량하고, 5X SDS-PAGE loading dye로 염색 후 전기영동 하였다. membrane에 transfer하고 5% skim milk로 blocking한 후, 1차 항체를 처리하여 overnight하였다. Tris Buffered Saline with Tween 20(TBST)으로 3회 세척 후 2차 항체를 3시간 동안 처리하였다. TBST로 3회 세척 후 단백질 발현을 확인하였다.
CPSGT가 MMP-1 단백질 분비에 미치는 효과를 확인하기 위해 ELISA를 진행하였다. Hs68 세포를 60㎜ plate에 6×105cells/well로 분주한 뒤 24시간 동안 배양하였다. 200, 400 및 800㎍/㎖의 농도로 CPSGT를 전처리한 후, TNF-α를 처리하여 24시간 동안 배양하였다. 상층액을 분리하여 MMP-1 human ELISA kit(GE Healthcare Life Sciences, USA)의 지침에 따라 단백질 분비량을 측정하였다.
Ⅲ. 실험 결과
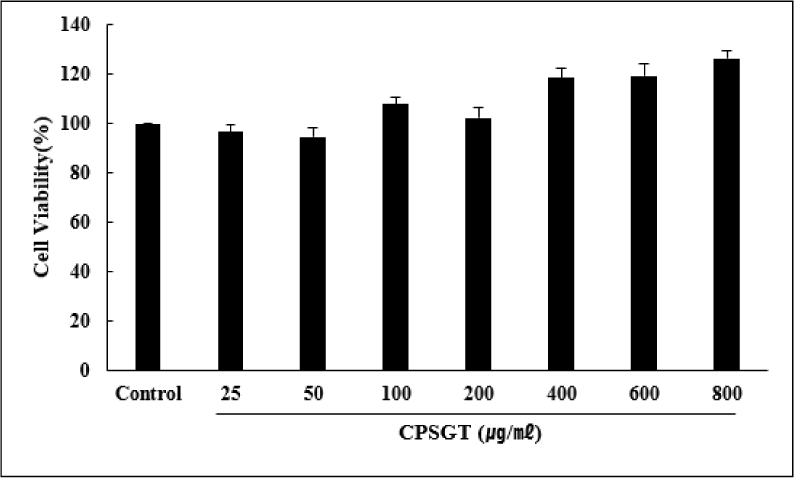
Hs68 세포에 CPSGT를 농도별로 처리하여 세포 독성을 평가한 결과, 모든 농도에서 독성이 없음을 확인하였다. 이에 본 연구는 200, 400 및 800㎍/㎖의 농도로 실험을 진행하였다(Fig. 1).
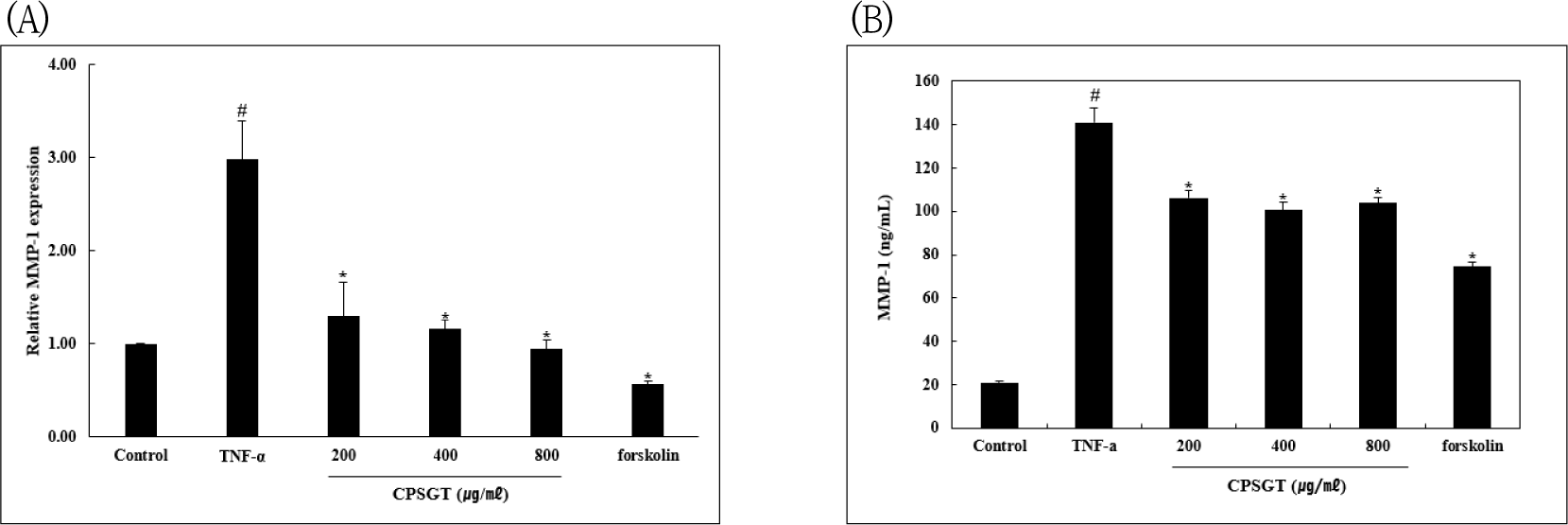
Hs68 세포에서 CPSGT를 처리하여 TNF-α로 유도된 MMP-1의 mRNA 발현 및 단백질 분비 변화를 real-time RT-PCR 및 ELISA를 통해 확인하였다. TNF-α를 처리한 군과 비교한 결과 MMP-1의 mRNA 발현과 단백질 분비 모두 CPSGT를 처리함에 따라 감소하였다(Fig. 2).
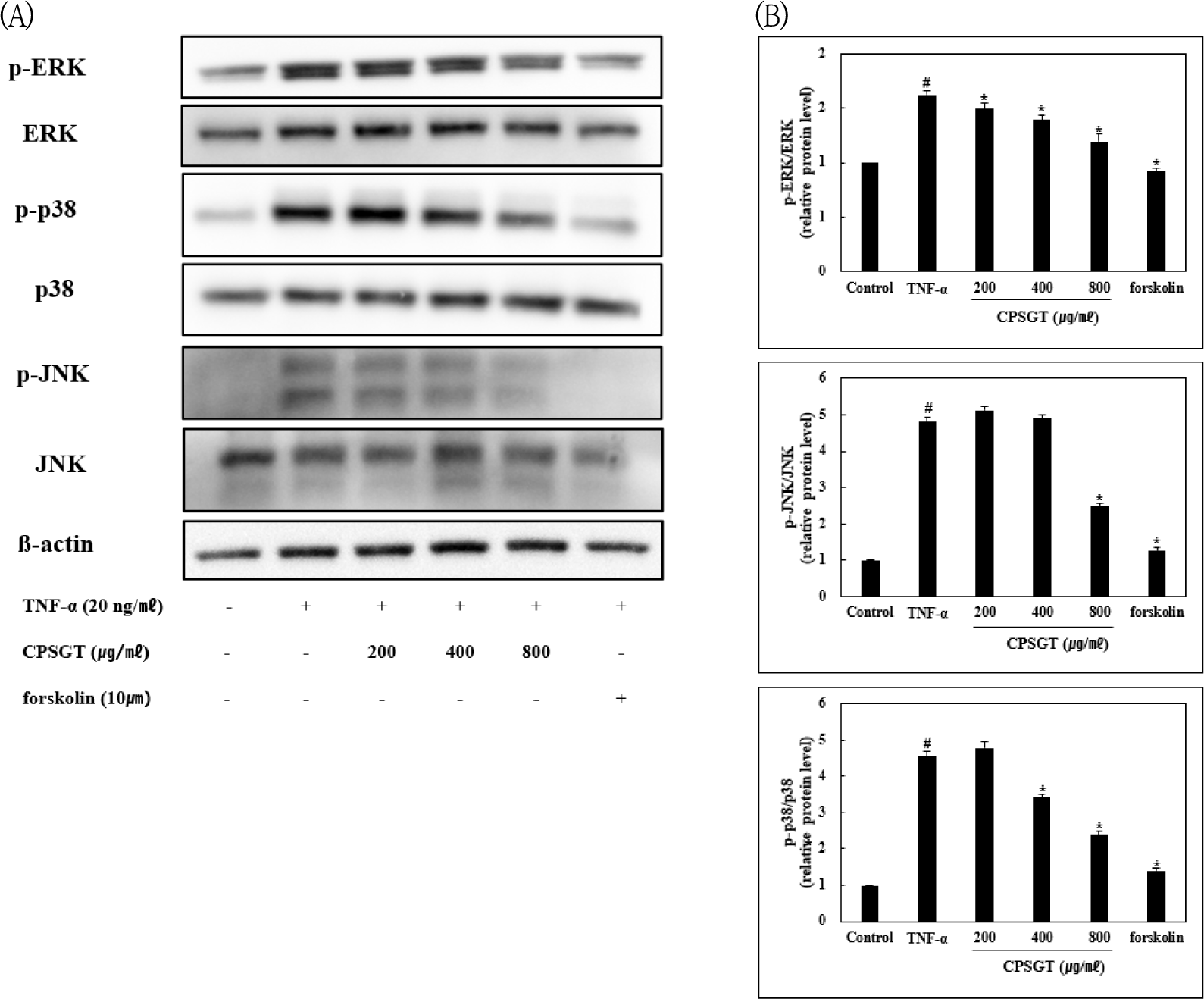
Hs68 세포에서 CPSGT 처리에 따른 MAPKs의 인산화 변화를 확인하기 위해 western blotting으로 단백질 발현을 확인하였다. TNF-α를 처리한 군과 비교한 결과 p-ERK, p-JNK, p-p38의 단백질 발현이 CPSGT를 처리함에 따라 유의성 있게 감소하였다(Fig. 3).
Hs68 세포에서 CPSGT 처리에 따른 c-jun의 인산화 변화를 확인하기 위해 western blotting으로 단백질 발현을 확인하였다. TNF-α를 처리한 군과 비교한 결과 p-c-jun의 단백질 발현이 CPSGT를 처리함에 따라 유의성 있게 감소함을 확인하였다(Fig. 4).

Hs68 세포에서 CPSGT 처리에 따른 NF-κB의 인산화 변화를 확인하기 위해 western blotting으로 단백질 발현을 확인하였다. TNF-α를 처리한 군과 비교한 결과 p-NF-κB의 단백질 발현이 CPSGT를 처리함에 따라 유의성 있게 감소함을 확인하였다(Fig. 5).

Ⅳ. 고 찰
피부는 가장 최외각에 존재하여 다양한 환경적 요인에 영향을 받기 때문에 시간의 흐름에 따른 내인성 노화 및 외부 요인에 의한 외인성 노화가 일어나게 된다. 섬유아세포에 의해 생성되는 ECM은 콜라겐 및 엘라스틴 등으로 이루어져 있다. 콜라겐은 피부에 지지력을 부여하는 데 필수적이며 콜라겐의 항상성은 진피 섬유아세포에 의해 조절되는데, 항상성이 무너져 콜라겐의 양이 감소하고 분해되면 주름이 발생한다21). MMPs는 조직 리모델링 과정의 핵심으로 여겨지는 효소로서 정상 세포에서는 낮은 수준으로 발현된다. 하지만 병리학적 상태에서 발현이 증가하여 조직의 파괴를 유도하게 된다. 그중 콜라겐은 주요 파괴 대상으로 MMP-1에 의해 분해된다. MMP-1은 섬유아세포에서 생성되며 type Ⅰ 콜라겐을 절단하여 주름을 유발한다. MMP-1의 발현은 IL-1β, TNF-α와 같은 전염증성 사이토카인에 의해 증가된다. 그중 TNF-α는 세포 내에서 일련의 인산화 과정을 유도하여 MMP의 전사를 유도한다. 인산화되는 단백질 그룹 중 하나는 MAPKs로 c-Jun N-terminal kinase(JNK), extracellular signal-regulated kinase(ERK), p38로 구성된다. 활성화된 MAPKs는 AP-1의 구성원인 c-jun을 인산화하고 활성화하여 MMP의 전사를 유도한다22,23).
淸肺瀉肝湯은 《東醫壽世保元》에서 熱多寒少湯 加 大黃으로 기록되어 있다. 太陰人 裡熱病證에서 手指焦黑斑瘡病 飮一溲二면서 大便燥澁할 때 사용한다고 되어 있다. 이후 의학자 원덕필이 편람한 《東醫四象新編》에 ‘淸肺瀉肝湯’으로 명칭이 처음 소개되었다. 大便秘, 目疼, 鼻乾, 不得臥, 咽嗌乾燥 등의 肝熱 증상이 뚜렷하게 나타나면서 동시에 不汗出 皮膚乾燥, 小便量 증가, 惡心嘔吐 등의 肺燥를 동반한 증상에 적용할 수 있다. 熱證의 증상들이 나타난 상태에서 裏熱이 지속되면서 氣, 血, 津液, 精이 고갈되어 燥證의 증상들이 나타나게 된다10-2). 이러한 병리적 과정은 氣, 血, 津液, 精과 같은 인체 구성 물질이나 에너지가 소모되면서 나타나는 신체 기능 저하로 볼 수 있는데, 질병이나 노화의 과정과 연결된다. 淸肺瀉肝湯의 구성 약물들을 보면 發散하는 약재인 葛根, 藁本, 白芷, 升麻와 淸熱燥濕하는 黃芩, 消食하는 蘿葍子, 攻下하는 大黃, 淸化熱痰하는 桔梗으로 구성되어 解熱하는 동시에 일부 祛痰하는 작용이 있음을 유추할 수 있다. 이는 심한 燥熱證을 보일 때 藁本, 大黃을 모두 사용해 燥熱證을 해결하고자 한 것으로 보인다. 淸肺瀉肝湯은 燥熱證이 盛하여 津液과 氣血이 소모되어 나타나는 일종의 인체 기능 저하 작용에 대해 강력한 解熱 및 除濕痰 작용을 지닌 것으로 볼 수 있다10-2).
인체 기능 저하인 질병 및 노화를 촉진하는 활성산소의 과잉 생산을 억제하는 淸肺瀉肝湯의 항산화 효과에 대한 연구는 이미 선행되었다. 활성산소는 단백질, DNA, T 세포 등의 면역계통 인자를 손상시켜 인체 기능 저하와 노화를 유발한다. 생물학적 관점에서 접근한 최근 연구 동향은 노화의 현상을 활성산소(oxygen free radical)와 콜라겐 분해효소(collagenase)가 주된 원인으로 평가되고 있다. 특히 콜라겐을 분해하는 효소 중 type I 콜라겐을 분해하는 collagenase(MMP-1)가 가장 많이 알려져 있다.
淸肺瀉肝湯에 대한 최근 연구로는 중풍13), 혈소판 응집 억제14), 허혈/재관류 환경에서의 세포 보호15), 중대뇌동맥 폐쇄 후 재관류16), 관절염17), lipase 활성 저해 및 체중 감량, 혈장 지질, UCP 1,2 발현18), 비만19), 당뇨20), 항산화21) 등에 대해 보고되었으나, 피부 항노화에 대한 연구는 없었다. 이에 본 연구에서는 淸肺瀉肝湯의 항산화 효과에 관한 선행 연구21)에 기반을 두어 인간 섬유아세포에서 淸肺瀉肝湯의 피부 항노화에 대한 효과를 확인하였다.
본 연구는 TNF-α로 MMP-1을 유도하여 인간 섬유아세포에서 CPSGT 처리에 따른 피부 항노화 효과를 확인하기 위해 진행되었다. CPSGT 처리에 따른 농도별 세포 독성을 평가하기 위해 MTT assay를 실시하였다. 그 결과 CPSGT는 최고농도인 800㎍/㎖까지 세포 독성을 나타내지 않았다(Fig. 1). 그에 따라 이후의 실험은 200, 400 및 800㎍/㎖의 농도로 진행하였다.
인간 섬유아세포인 Hs68 세포에서 CPSGT가 TNF-α로 유도된 MMP-1을 억제하는지 확인하기 위해 real-time RT-PCR과 ELISA를 진행하였다. 그 결과 CPSGT는 MMP-1 mRNA 발현을 농도 의존적으로 감소시켰고, 단백질 분비를 유의성 있게 감소시켰다(Fig. 2).
MAPKs는 세포 성장, 사멸 등을 조절하는 데 중요한 역할을 하며 ERK, JNK, p38로 나누어진다. 피부 섬유아세포에서 TNF-α를 처리하면 ERK, JNK, p38이 활성화되고 이는 MMP-1의 발현에 영향을 미친다25). CPSGT가 MAPKs 경로를 통해 MMP-1을 억제하는지 확인하기 위해 western blotting을 진행하였다. 그 결과, CPSGT를 처리함에 따라 p-ERK, p-JNK, p-p38의 단백질 발현이 유의성 있게 감소함을 확인하였다(Fig. 3).
AP-1은 c-jun 및 c-fos로 이루어진 전사인자로서 MMP-1의 전사를 유도한다고 알려져 있다. c-fos는 인간 피부에서 항상 발현되고 있는 상태이기 때문에 AP-1의 활성은 c-jun의 발현 증가로 인해 발생한다. 자외선을 조사하였을 때, c-jun의 발현은 증가하여 MMP의 발현에 영향을 미쳤으나, c-fos의 발현은 변화가 없었다는 연구가 보고되었다26,27). 그렇기 때문에 MMP-1의 전사 억제를 확인하기 위해서는 c-jun의 발현 변화가 중요하다고 볼 수 있다. CPSGT가 c-jun의 활성을 억제하는지 확인하기 위해 western blotting을 진행한 결과, CPSGT를 처리함에 따라 p-c-jun의 단백질 발현이 감소함을 확인하였다(Fig. 4).
MMP의 전사는 AP-1, NF-κB와 같은 전사인자로 인해 조절된다. 그중 NF-κB는 RelA, RelB, p50 등으로 이루어진 복합체로서 ERK 및 p38의 인산화를 통해 활성화되어 MMP를 유도한다28-30). CPSGT가 NF-κB의 활성을 억제하는지 확인하기 위해 western blotting을 진행한 결과, CPSGT를 처리함에 따라 p-NF-κB의 단백질 발현이 감소함을 확인하였다(Fig. 5).
이상의 결과로 CPSGT가 MAPKs/AP-1/NF-κB 경로를 통해 TNF-α로 유도된 MMP-1의 발현을 억제함을 확인하였다. 본 연구는 太陰人 燥熱病에 사용되는 淸肺瀉肝湯이 피부 노화로 유발될 수 있는 다양한 피부 질환에 활용될 수 있음에 대하여 in vitro 수준에서 피부 항노화 효능과 그 기전을 제시하였다. 그러나 MAPKs의 상위 인자들인 mitogen-activated protein kinase kinase (MEK), SAPK/ERK kinase(SEK)에 대해서는 추후 심도 있는 기전 연구가 필요할 것으로 생각된다.
Ⅴ. 결 론
인간 섬유아세포인 Hs68 세포에서 CPSGT의 피부 항노화 효과를 연구한 결과 다음과 같은 결과를 얻었다.
-
Hs68 세포에서 CPSGT의 세포 독성을 확인한 결과, 25-800㎍/㎖ 농도에서 독성을 보이지 않았다.
-
Hs68 세포에서 CPSGT를 처리하였을 때, MMP-1의 mRNA 발현 및 단백질 분비를 확인한 결과, TNF-α를 처리한 군과 비교하여 MMP-1의 mRNA 발현 및 단백질 분비가 감소하였다.
-
Hs68 세포에서 CPSGT를 처리하였을 때, MAPKs의 단백질 발현을 확인한 결과, TNF-α를 처리한 군과 비교하여 ERK, JNK, p38의 인산화가 감소하였다.
-
Hs68 세포에서 CPSGT를 처리하였을 때, p-c-jun의 단백질 발현을 확인한 결과, TNF-α를 처리한 군과 비교하여 인산화가 감소하였다.
-
Hs68 세포에서 CPSGT를 처리하였을 때, p-NF-κB의 단백질 발현을 확인한 결과 TNF-α를 처리한 군과 비교하여 인산화가 감소하였다.






