Ⅰ. 서 론
槐花散은 《衛生總微》 제11권에 수록된 처방으로, 槐花(炒), 地榆(炒) 각 등분으로 주치증은 血痢不愈다1).
槐花散의 구성 약물 중 槐花(Sophora japonica L.)는 회화나무의 미개화한 꽃송이 혹은 꽃봉오리이며 肝과 大腸으로 歸經하고, 苦寒하다2). 凉血止血, 淸肝明目의 효능이 있고, 胃腸管에 발생한 實證의 痔病, 腸風, 痢疾 및 腸毒, 皮膚風 등을 치료한다3,4).
地楡(Sanguisorba officinalis L.)는 다년생 본초인 오이풀, 기타 동속 근연식물의 뿌리를 건조한 것으로 성미는 酸, 苦, 澁味이며, 귀경은 肝과 大腸이다5). 地楡의 효능은 凉血止血, 解毒斂瘡으로 便血, 痔血, 血痢, 崩漏 및 水火燙傷, 癰腫瘡毒에 사용된다6-8).
《衛生總微》에 근거한 槐花散의 점막 염증에 대한 항염증 작용 기전을 밝히는 연구는 부족하지만, 구성 약물에 대한 연구는 다양하게 이루어졌다. 槐花는 지혈 효과, 항염증 효과, 항암 효과와 항균 효과 연구 등이 보고되었다9-12). 地榆는 항산화 연구, 항균 활성 연구, 항암 연구, 인슐린 분비 연구, 항궤양 효과 연구 및 항불안 연구와 항암 및 항균 연구, 지혈 효과 연구 등이 있다13-20).
槐花散과 관련 연구 기존 연구들은 배 등21)의 槐花散이 Dextran Sulfate Sodium으로 유도된 생쥐의 궤양성 대장염에 미치는 영향에 대한 연구, 강 등22)의 槐花散이 抗消化性潰瘍 및 血液 凝固作用에 미치는 영향에 대한 연구 등이 있었으나 본 연구에 사용된 槐花散과는 출전, 약재의 구성, 용량이 달랐다.
한편 槐花散의 주치는 血痢不愈인데 이는 서양의학의 궤양성 대장염의 주증상인 혈성 설사에 속한다21). 궤양성 대장염은 대장에 발생하는 만성적인 재발성의 점막 염증 질환으로, 주요 증상은 혈성 설사와 복통, 배변 후 후중감 등이 있다22). 槐花散의 구성 약물의 효능과 기존 연구 결과 및 점막 염증을 치료한다는 점에 근거하여 임상에서 만성 점막 염증성 질환에 응용이 가능할 것으로 생각되어 槐花散에 대한 연구를 진행하였다.
본 연구에서는 槐花散의 열수추출물(Goihwa-san water extract, GHS)을 in vitro에서 Raw 264.7 cell에 전처치하여, lipopolysaccharide(LPS)를 포함한 다양한 toll-like receptor(TLR) ligand로 활성화시켰을 때, 전염증성 매개 인자들의 생성에 미치는 영향과 이 과정에 관여하는 주요 기전들을 연구하였다. in vivo에서는 carrageenan(CA)으로 족부종을 유도한 모델에서 부종의 억제 및 염증 매개 인자 생성의 억제를 확인하였다.
II. 재료 및 방법
槐花散 구성 약재인 槐花(炒), 地榆(炒)는 대원약업사(대구, 대한민국)에서 구매하였으며, 불순물을 제거하고 각 100g씩을 1.5L의 물에 넣고 3시간 동안 추출하였다. 이후 GHS를 거즈로 1차 여과하였고, 여과액을 3,000×g에서 3분간 원심분리하였다. 원심분리 후 상층액만을 취하여 No. 2 filter paper(Whatman, Buckinghamshire, UK)로 여과한 후, 여과액을 진공회전농축기(Rotary evaporator; EYELA, Tokyo, Japan)로 농축하였다. 이후 초저온냉동기(Ultra-low temperature freezer; Operon, Gimpo, Korea)에서 24시간 이상 동결하고, 동결 추출액은 동결건조기(Lyophilizer; LABCONCO, Kansas, MO, USA)에 넣어 동결건조 후 실험에 사용할 때까지 –20℃에서 보관하였다. GHS의 수율은 33.969% 였으며 in vitro 연구에서는 dulbecco’s modified eagle’s medium(DMEM)에 용해하여 농도에 맞게 처치하였고, in vivo 연구에서는 saline으로 용해하여 사용하였다(Table 1).
| Herbal Name | Scientific Name | Amount(g) |
|---|---|---|
| 槐花 | Sophora japonica L. | 100 |
| 地楡 | Sanguisorba officinalis L. | 100 |
| Total | 200 |
Empower를 software로 사용하였고, Branson사의 ultrasonic cleaner 8210R-DHT를 추출기로 사용하여 Ultra Performance Liquid Chromatography(UPLC)에 필요한 시료를 추출하였다. Waters사의 ACQUITYTM ultra performance LC system(USA)의 고성능 액체 크로마토그래피(UPLC)를 사용하였고, Waters사의 photodiode array detector(PDA)와 Waters사의 BEH C18 column(1.7㎛, 2.1×100)인 HPLC 컬럼을 사용하였다. 시약은 물, Methanol(HPLC용, Junsei), 아세토니트릴(HPLC용, JT BAKER)을 사용하였다. 실험에 사용된 표준품은 Rutin(ChemFaces, China), Sophoricoside (ChemFaces, China), Sophocarpine(ChemFaces, China), Galic acid (Sigma, USA)를 구입하여 사용하였다.
槐花散 시료의 정량에 사용된 표준품은 槐花에서 Rutin, Sophoricoside, Sophocarpine과 地榆에서 Galic acid를 지표로 선정하여 분석을 진행하였다. 위의 표준품들을 정밀하게 달아 각각 Methanol에 녹여서 ㎖당 1㎎을 함유하는 표준원액을 만들고 적당량을 취하여, Methanol로 ㎖당 12.5, 25, 50, 100㎍이 함유되도록 희석하여 표준액으로 하였다. 모든 표준물질에 있어서 표준곡선의 R2(결정계수)는 전체 표준물질에서 0.999 이상이었다.
정량 분석을 위한 검사액은 동결건조 시료를 균질하게 혼합하여 0.1g을 측정하고, 70% Methanol 10㎖를 첨가하였고, 1시간 동안 초음파로 추출하였다. 이러한 과정으로 추출한 검액을 멤브레인 필터 공경 0.22㎛로 여과한 다음 검액으로 사용하였다.
PDA의 분석 파장은 Rutin과 Sophocarpine은 280㎚, Sophoricoside는 310㎚, Galic acid는 330㎚에서 분석하였다. 이동상으로는 Formic acid(FA)를 0.1% 함유하 고 있는 아세토니트릴과 물의 혼합액을 사용하였고, 아래 조건과 같이 분석하였다. 2㎕의 시료를 주입하였으며, 0.4㎖/min 유속이었다. 분석의 결과는 피크면적법으로 정량하여 머무르는 시간을 통한 정성 확인을 하였다(Table 2).
Sigma사(St. Louis, MO, USA)에서 MTT와 Lipopolysaccharide(LPS) 및 Griess 시약을 구입했고, Promega사(Madison, WI, USA)로부터 Griess reagent system을 구입하였다. GibcoBRL사(Eggenstein, Germany)에서 FBS, DMEM, penicillin 및 streptomycin을 구입하였고, 순수화학㈜(Junsei Chemical Co., Ltd. Tokyo, Japan)으로부터 dimethylsulfoxide(DMSO)를 구입하였다. In vivo Gen사(Toulouse, France)에서 Loxoribine(LOX), Peptidoglycan(PGN), Flagellin(FLA)을 구입했고, BD biosciences사(San Jose, CA, USA)에서 Anti-inducible nitric oxide synthase(iNOS의 antibody)를 구입하였다. Santa Cruz Biotechnology사(Santa Cruz, CA, USA)에서 inhibitory κBα(IκBα), nuclear factor-κB(NF-κB) 및 actin의 antibody를 구입하였다. Cell Signaling Technology사(Danvers, MA, USA)에서 phospho-IκBα(p-IκBα)와 Lamin A/C 및 MAPKs phospho-p38(p-p38), phospho-c-Jun N-terminal kinase(p-JNK), phospho-extracellular signal-regulated kinase(p-ERK)의 antibody를 구입하였다. Schleicher & Schuell사(Dassel, Germany)에서 nitrocellulose(NC) membrane을 구입하였으며, Pierce endogen사(Rockford, IL, USA)에서 구입한 ELISA kit를 사용하여 Interleukin–1β(IL-1β)와 Interleukin-6(IL-6) 및 Tumor necrosis factor-α(TNF-α)의 cytokine을 측정하였다. Sigma Chemical사(St Louis, USA)에서 급성 염증성 부종 유발 물질인 carrageenan(CA)을 구입하였고, 유발된 부종을 측정하기 위해서는 부종측정기인 LE 7500(LETICA Scientific Instruments, Spain)을 써서 평가하였다.
한국세포주연구재단(Seoul, Korea)에서 Raw 264.7 cell을 구입하였고, 세포배양액은 penicillin-streptomycin (100㎛/㎖), FBS(10%)의 혼합물인 DMEM 배지를 사용하였다. 80-90% confluence에 도달될 때까지 24-well plate에서 5% CO2, 37℃ 조건으로 세포배양기(Sanyo, Japan)에서 배양하였다. 실험에 사용된 모든 세포에서는 80-90% 이상 배양되면 실험을 실시하였고, 계대배양 횟수는 20회 미만인 cell만을 사용하였다.
NO의 생성량은 Raw 264.7 cell에서 Griess 시약을 이용하여 측정하였고, 96-well plate에 각 실험군의 세포 배양 상등액 50㎕와 동량의 Griess reagent를 혼합하여 암실에서 10분 동안 반응시킨 다음, 540㎚에서 Infinite 200 Pro(Tecan, Switzerland)인 automatic microplate reader로 흡광도를 측정했다. NO의 생성량은 각 실험군의 배수로 control cell과 대비하여 나타내었다.
세포 생존율을 분석하기 위하여 Raw 264.7 cell을 24-well plate에서 5×104cell/well로 분주하였다. 그다음 GHS를 10, 30, 100 및 300㎍/㎖로 전처치하였고, 다음으로 LPS를 처치 후 CO2, 5%, 37℃의 조건으로 18시간 배양기에서 배양하여 세포 생존율을 측정하였다. 배양 후에는 24-well plate에 well당 MTT(0.1㎎/㎖) 200㎕를 넣었고 추가로 4시간 더 배양하였다. 생존 세포의 미토콘드리아에 작용하여 어두운 보라색을 띤 formazan이 형성되는 MTT는 배양한 다음에 배지를 조심스럽게 압력이 가해지지 않도록 제거하고, 생성된 암자색의 formazan crystal을 DMSO에 녹여 570㎚에서 microplate reader (Model; Infinite M200 pro, Switzerland)로 흡광도를 측정하였다. 세포 생존율은 각 실험군의 백분율을 control cell에 대하여 나타내었다.
NF-κB, IκBα, p-IκBα와 iNOS, COX-2의 단백질 발현 수준을 측정하기 위하여 Raw 264.7 cell을 GHS로 전처리하고 LPS까지 처치한 다음 전세포 추출액(whole cell lysate)과 핵분획 추출물(nuclear fraction)로, 관찰하고자 하는 단백질에 따라 나누었다. 핵분획 추출물은 세포를 ice-cold PBS를 사용하여 세척하고 scrapper로 수집한 후 microtube로 옮기고 원심분리(3,000×g)하여 상등액을 제거하였다. 100㎕의 lysis buffer(0.5㎜ phenyl-methylsulfonyl fluoride(PMSF), 0.5% Noridet P-40, 0.1㎜ EDTA, 1㎜ dithiothreitol(DTT), 10㎜ HEPES (pH 7.9), 0.5㎜ phenylmethylsulfonyl fluoride (PMSF), 0.1㎜ EDTA, 10㎜ KCl)를 넣어 vortex하여 완전히 용해시킨 다음, 10분간 ice에 두었다가 4℃에서 5분간 16,000×g로 원심분리하였다. 원심분리 후 상등액을 없애고 microtube 밑의 핵 펠릿에 NaCl 400㎜, PMSF 1㎜, DTT와 EDTA, pH 7.9인 HEPES 20㎜를 함유한 40㎕ 추출 완충액을 넣고 vortex하였다. 1시간 동안 용해시킨 후, 4℃에서 10분 동안 16,000×g로 원심분리하여 상등액을 핵분획 추출물을 얻었다. 핵분획 추출물은 단백질 함량을 BCA protein assay kit로 정량하였으며, 실험에 사용할 때까지 –70℃로 보관하였다. 전세포 추출액는 세포를 ice-cold PBS로 세척하고, scrapper로 수집하여 microtube로 옮긴 다음에 1,500×g로 10분 동안 원심분리하여 상등액을 취하였다. 여기에 radioimm-noprecipitation(RIPA) buffer를 100㎕ 첨가한 후에 1% sodium deoxycholate, 0.1% SDS와 Halt protease, 25㎜ Tris-HCl(pH 7.1) 및 150㎜ NaCl, 1% NP-40, phosphatase inhibitor cocktail을 포함하는 RIPA buffer(Thermo Scientific, USA)를 넣고 vortex하여 완전히 용해시킨 후, 30분 동안 4℃에서 반응시킨 다음, 15,000×g로 10분간 원심분리하였다. 이렇게 얻은 상등액을 BCA protein assay kit를 써서 전세포 추출액에서의 단백질 함량을 정량하였다. 전세포 추출액 및 핵분획 추출물에서의 단백질 함량을 측정하고, 동량의 단백질을 취한 후 SDS-PAGE로 전기영동시키기 위해서 젤 전기영동법으로 NC membrane에 단백질을 전이시켰다. 1차 antibody를 NC membrane에서 반응시키고, 다시 2차 항체와 반응시켜 Amersham Biosciences사 enhanced chemiluminescence(ECL) detection reagents (Piscataway, NJ, USA)로 발색하고 각 단백질의 발현을 평가하였다. Ultra-Violet Products Ltd.의 Image analyzing system(Upland, CA, USA)을 써서 발현된 단백질을 계량화하였고, 각 단백질의 발현량은 control군과 비교하여 각 실험군의 배수로 나타내었다.
염증을 매개하는 것에 관련된 cytokine 측정을 위하여 Raw 264.7 cell을 6-well plate에 well당 5×105cell/㎖를 분주하고 배양한 다음 GHS를 100, 300μg/㎖의 농도로 처치하고, 1시간 후에 LPS를 처치하였다. LPS를 처치한 후 18시간이 지나서 배지를 회수하여 cytokine을 측정하였다. 회수된 상등액의 TNF-α, IL-1β, IL-6는 ELISA kit를 사용해 분석하였다. 표준곡선은 각 cytokine마다 7개의 농도로 표준품을 측정하여 얻었으며, cytokine마다 발현량의 표현은 표준곡선을 이용하여 pg/㎖로 나타내었다.
실험동물은 Orient Bio(Seongnam, Korea)로부터 Sprague Dawley계 수컷 rat(4주령, 130-160g)을 매입하였고, 동물환경제어 사육장치(ECRS; Environment Controlled Rearing System)에서 사육하였다. 1주일의 기간은 사육장치에 적응시키고 나서 실험에 사용하였고, 동물환경제어 사육장치의 명암주기는 12시간, 온도는 20-23℃, 습도는 60%가 유지되도록 설정하였으며 사료와 음용수는 자유롭게 섭취하도록 하였다. 본 연구는 동물실험 윤리위원회(대구한의대학교 산학협력단-IACUC)의 승인을 획득하고 실험하였다(승인번호 : DHU 2021-103). 실험은 아무 처치도 없는 군을 normal군으로, carrageenan(CA) 100㎕/rat를 피하주사함으로써 염증을 유도한 군을 CA군으로 설정한 후, CA와 dexamethasone 1㎎/㎏을 투여한 군을 DEXA + CA군, CA와 0.3g/㎏의 GHS를 투여한 군을 GHS 0.3g/㎏ + CA군, CA와 1.0g/㎏의 GHS를 투여한 군을 GHS 1.0g/㎏ + CA군으로 설정하였다. 각 실험군은 5마리의 흰쥐로 하였다. dexamethasone과 GHS는 하루에 한 번 나흘간 계속 투여하고, 나흘째에 마지막으로 약물을 투여한 후 1시간에 흰쥐의 오른쪽 발바닥에 CA를 100㎕/rat으로 주사하였다(Table 3).
| Group | Treatment | |||
|---|---|---|---|---|
| CA | GHS 0.3 | GHS 1.0 | DEXA | |
| Normal | - | - | - | - |
| CA | + | - | - | - |
| GHS 0.3g/㎏ + CA | + | + | - | - |
| GHS 1.0g/㎏ + CA | + | - | + | - |
| DEXA + CA | + | - | - | + |
GHS와 DEXA는 4일간 1일 1회 약물을 투여하고, 마지막 투여 1시간 후에 100㎕/rat CA를 주사하여 족부종을 유발시켰다. 족부종의 정도는 CA 주사한 후 1시간마다(1, 2, 3, 4시간) 측정하였으며, 부종측정기로 측정하였다. 부종의 정도는 오른쪽 뒷다리의 volume 측정 후 아무 처치도 하지 않은 control군에 대비한 각 실험군의 배수로 나타내었다.
족부종의 측정 후 조직을 채취한 다음, 조직 0.1g에 1㎖의 total lysis buffer를 가하여 조직파쇄기(Prep Bead Beater taco사; Taiwan)로 균질화한 후 4℃에서 상등액을 15,000×g에서 10분간 원심분리하여 얻었고, 이 상등액의 단백질 함량을 BCA kit(IL, USA)를 써서 정량하였다. 동량의 단백질을 SDS-PAGE를 사용하여 전기영동시키고, gel상의 단백질을 NC membrane으로 전이시켰다. 단백질이 전이된 NC membrane에서 iNOS의 1차 항체로 반응시킨 다음에 다시 2차 항체를 써서 반응시켰고, Amersham Biosciences사 enhanced chemilu-minescence(ECL) detection reagents(Piscataway, NJ, USA)로 발색하고 각 단백질의 발현을 가시화시킨 다음 평가하였다. Ultra-Violet Products Ltd.의 Image analyzing system(Upland, CA, USA)을 써서 계량화하였고, 각 단백질의 발현량은 control군과 비교하여 각 실험군의 배수로 나타내었다.
III. 결 과
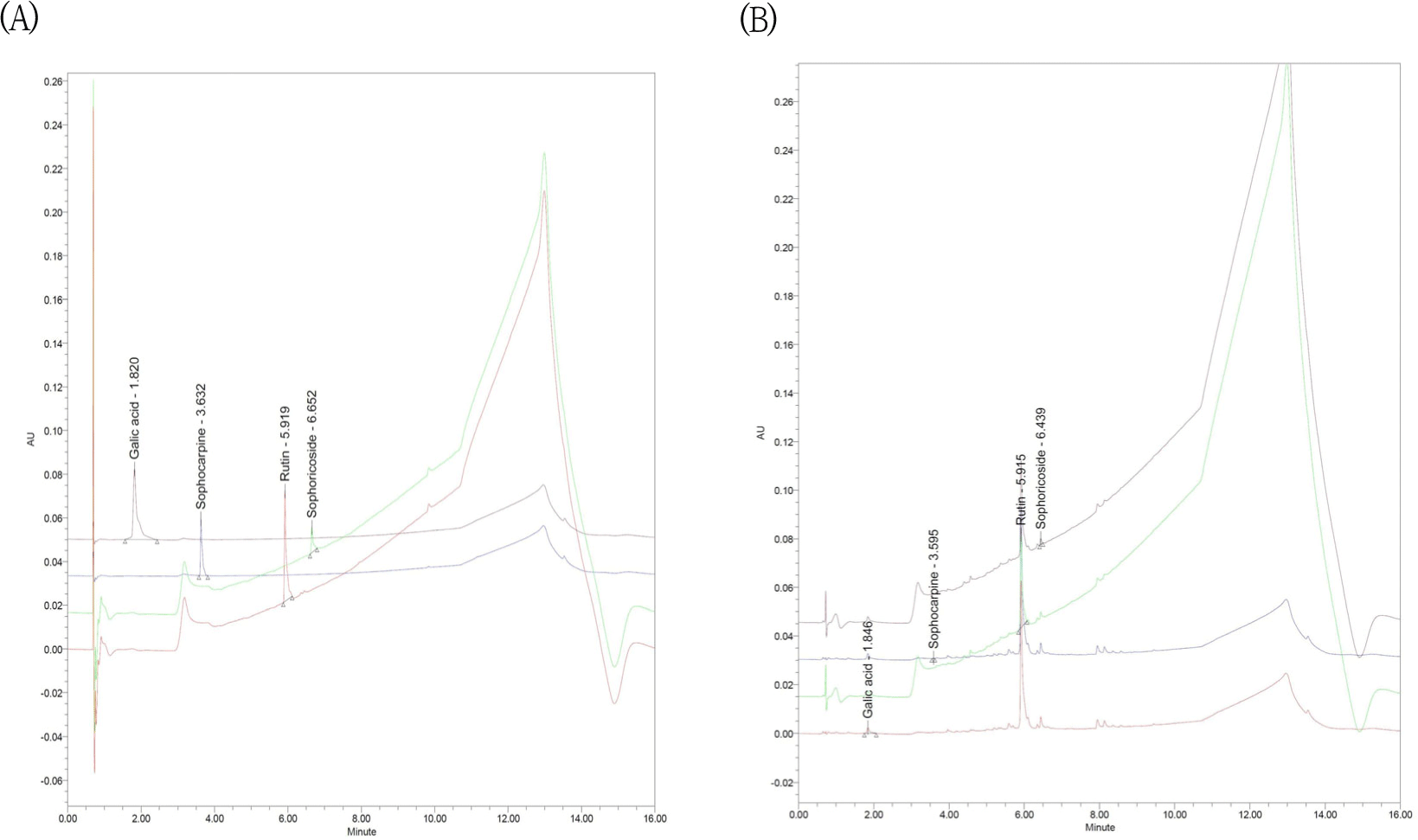
GHS의 槐花에서는 Rutin과 Sophoricoside, Sophocarpine, 地榆에서는 Galic acid를 지표성분으로 측정하였고, GHS를 분석한 결과, Rutin이 70.606± 0.305ppm, Sophoricoside가 4.494±0.033ppm, Sophocarpine이 10.101±0.065ppm, Galic acid가 8.46±0.070ppm이 함유되어 있었다(Table 4, Fig. 1).
| Goihwa-san(GHS) | ||||
|---|---|---|---|---|
| Herb | 槐花 | 地楡 | ||
| Compound | Rutin | Sophoricoside | Sophocarpine | Galic acid |
| Content(ppm) | 70.606±0.305 | 4.494±0.033 | 10.101±0.065 | 8.46±0.070 |
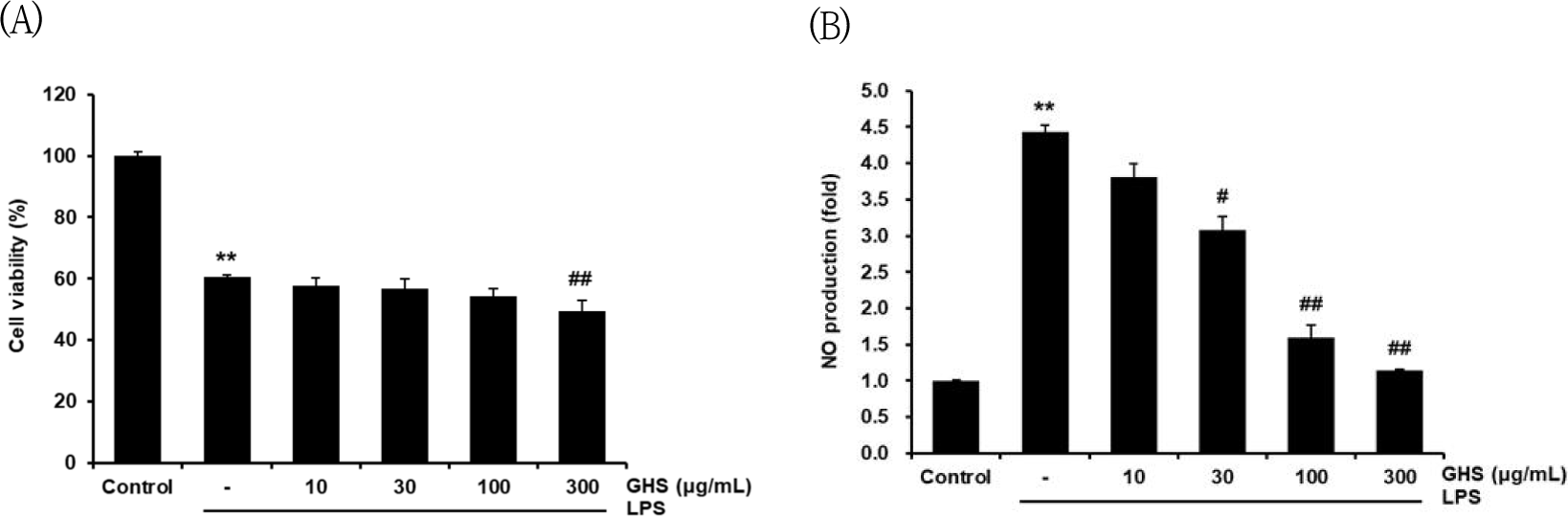
in vitro에서 GHS의 항염 효과를 평가하기 위하여, GHS로 1시간 동안 전처치한 Raw 264.7 cell에 LPS를 처치하여 GHS의 NO에 대한 생성을 억제하는 효과를 측정하였다. GHS의 NO 억제가 세포 생존율의 감소에서 일어나는지 평가하기 위하여, GHS + LPS에서 세포 생존율을 평가하였다. LPS군에서는 무처치 대조군에 비교하여 64.58±2.93%로 유의하게 세포독성을 나타내었으나, LPS + GHS 10, 30, 100 및 300㎍/㎖의 세포 생존율은 각각 61.93±1.72%, 58.85±1.728%, 57.61 ±1.72%, 47.93±1.87%로, LPS로 유도된 30, 100㎍/㎖은 LPS에 비해 세포독성이 증가하지 않았고, 300㎍/㎖은 LPS에 비해 세포독성이 증가하였다. 따라서 본 연구는 30㎍/㎖와 100㎍/㎖로 in vitro 실험을 진행하였다(Fig. 2A). LPS군은 무처치 대조군과 비교하였을 때 LPS 처치 18시간 후 NO의 생성량에 있어서 4.38배로 유의하게 증가하였으며, GHS 10, 30, 100, 300㎍/㎖는 각각 3.91, 3.26, 1.40, 1.17배로 NO 생성량을 억제하였고, 30, 100, 300㎍/㎖는 유의성 있게 NO 발현을 감소시켰다(Fig. 2B).
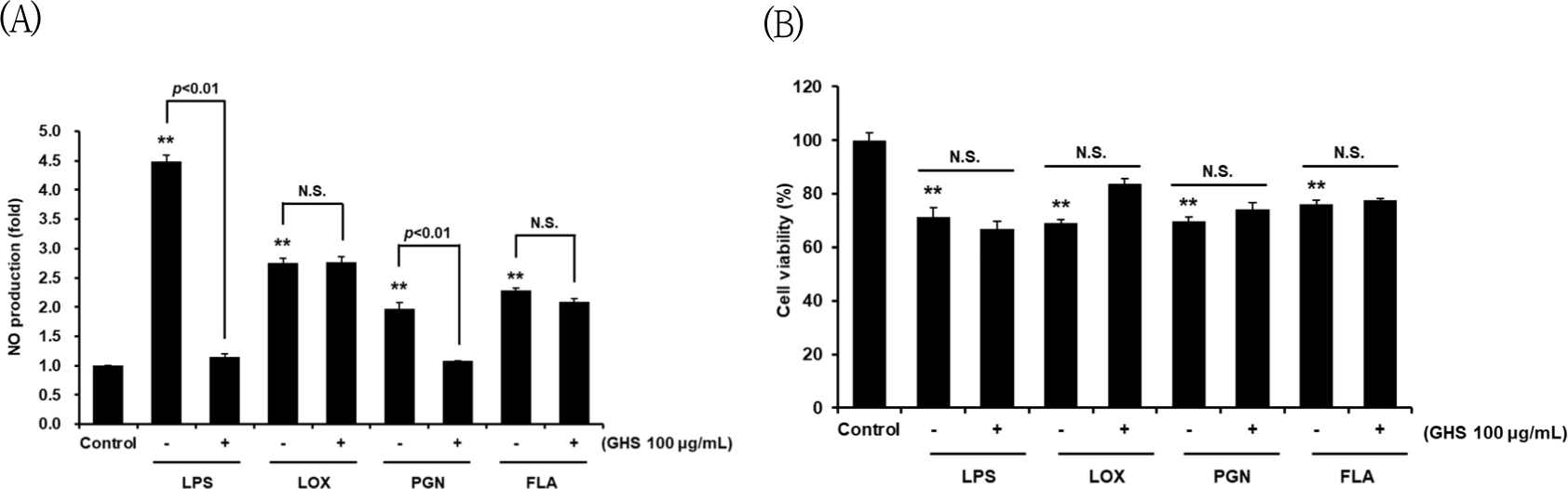
GHS가 LPS-toll-like receptor(TLR)4의 염증 매개 반응을 억제할 수 있음을 확인하였고, GHS가 TLR4 외의 다른 TLR의 ligand인 LOX(TLR7), PGN(TLR2), FLA(TLR5) 유도에 의하여 염증반응이 억제될 수 있는지에 대해서 확인하였으며, LPS로 활성화시킨 Raw 264.7 cell을 세포의 생존율 연구와 NO의 생성량 억제에서와 마찬가지로 TLR4의 ligand인 LPS 대신 TLR7의 ligand인 LOX 30㎍/㎖, TLR2의 ligand인 PGN 30㎍/㎖, TLR5의 ligand인 FLA 30㎍/㎖로 처치하여 NO의 생성량과 세포 생존율을 평가하였다. NO는 GHS 100㎍/㎖를 전처리하였을 때 LPS 처치군과 비교하였을 때 25.68%로, PGN 처치군과 비교하였을 때 54.59%로 NO의 생성을 유의하게 억제하였고, LOX 처치군이나, FLA 처치군에서는 NO의 생성을 유의하게 억제하지는 못하였다(Fig. 3A). 세포 생존율은 GHS 100㎍/㎖를 전처리하였을 때 LPS, LOX, PGN, FLA 처치군에서 모두 유의한 세포 생존율의 증감은 나타나지 않았으므로 세포독성이 없음을 확인하였다(Fig. 3B).
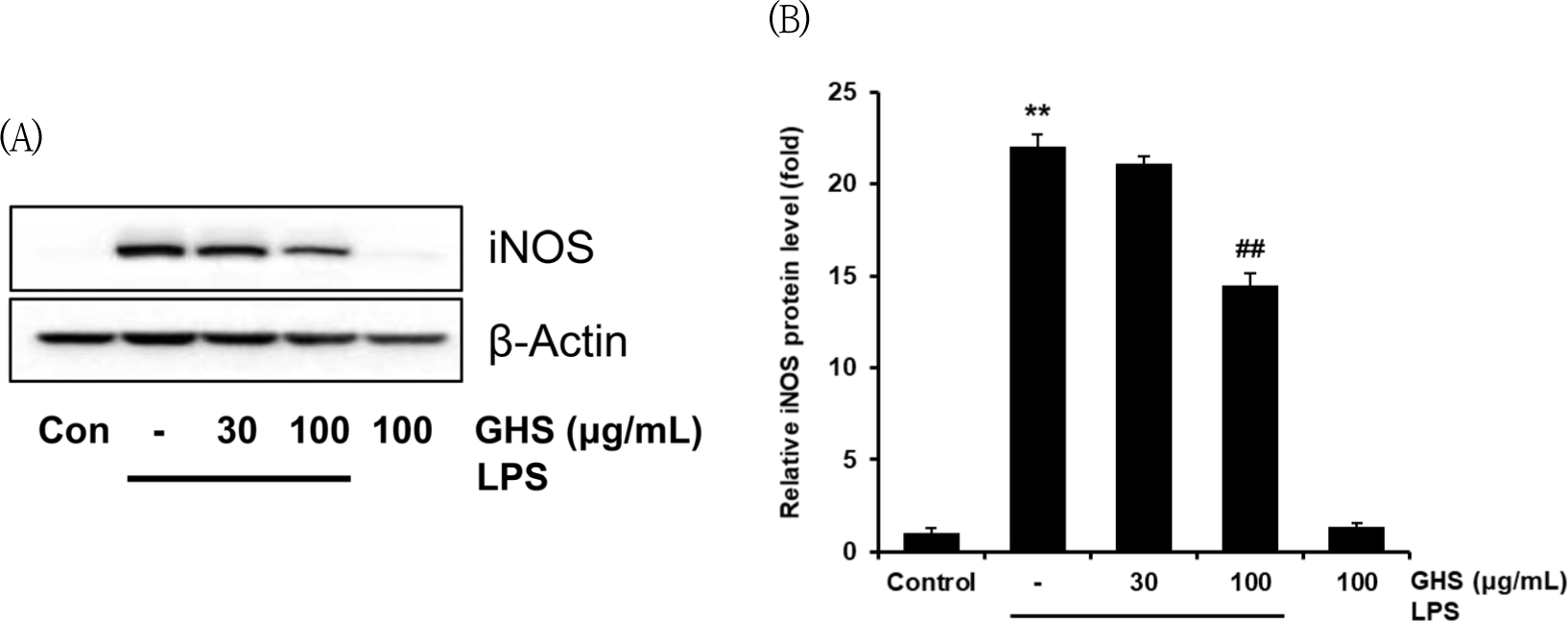
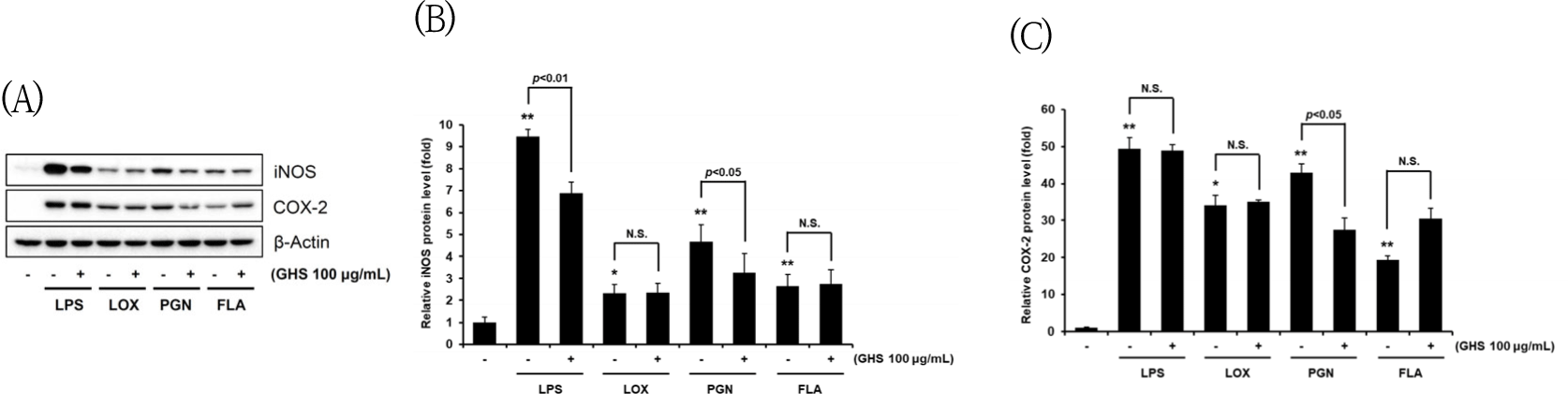
GHS 30과 100㎍/㎖ 농도에서 NO의 생성을 유의하게 억제하고(Fig. 2A) LPS 단독 처치군과 비교하여 세포독성을 나타내지 않음(Fig. 2B)을 확인한 다음, NO의 합성에 관여하는 iNOS 단백질의 발현을 immunoblot analysis를 통하여 평가하였다. LPS군에는 iNOS의 발현이 control 대비 22.03±0.66배로 유의하게 증가되었으나, GHS 30㎍/㎖의 농도에서는 21.08±0.32배로 LPS군과 유사하였으나, GHS 100㎍/㎖에서는 14.45± 0.70배로 LPS군과 비교하였을 때 유의성 있는 감소를 보였고(p<0.01), GHS 100㎍/㎖의 단독 처치군에서 iNOS의 생성에 유의한 증감을 보이지 않았다(Fig. 4).
GHS가 LPS TLR4/ligand 매개로 iNOS를 억제할 수 있 었던 것에서 다른 TLR/ligand에 의해 NO의 생성에 관여하는 iNOS의 발현 수준을 western blot를 통하여 평가하였고, COX-2에 있어서도 LPS, LOX, PGN, FLA로 어떤 영향을 미치는지 확인하였다. iNOS의 발현에서 LPS 단독 처리군에서는 normal 대비 9.45배로 유의하게 증가되었으나, GHS 100㎍/㎖에서는 6.88배로 LPS군에 비교하여 유의성 있게 감소되었고, LOX군에서는 normal 대비 2.30배로 증가되었으나, GHS 100㎍/㎖에서는 2.35배로 LOX군에 비교하여 유의미한 감소를 보이지는 않았으며, PGN군에서는 normal 대비 4.68배로 증가되었으나, GHS 100㎍/㎖에서는 3.25배로 PGN군에 비교하여 유의 성 있게 감소되었고, FLA군에서는 normal 대비 2.64배로 증가되었으나, GHS 100㎍/㎖에서는 2.74배로 FLA군에 비교하여 유의미한 감소를 보이지는 않았다(Fig. 5A, B). COX-2의 발현에서 LPS군에서는 normal 대비 49.35배로 유의하게 증가되었으나, GHS 100㎍/㎖에서는 48.96배로 LPS군에 비교하여 유의성 있게 감소되지는 않았고, LOX군에서는 normal 대비 34.11배로 증가되었으나, GHS 100㎍/㎖에서는 35.08배로 LOX군에 비교하여 유의미한 감소를 보이지는 않았으며, PGN군에서는 normal 대비 42.87배로 증가되었으나, GHS 100㎍/㎖에서는 27.36배로 PGN군에 비교하여 유의성 있게 감소 되었고, FLA군에서는 normal 대비 19.25배로 증가되었으나, GHS 100㎍/㎖에서는 30.44배로 FLA군에 비교하여 유의미한 감소를 보이지는 않았다(Fig. 5A, C).
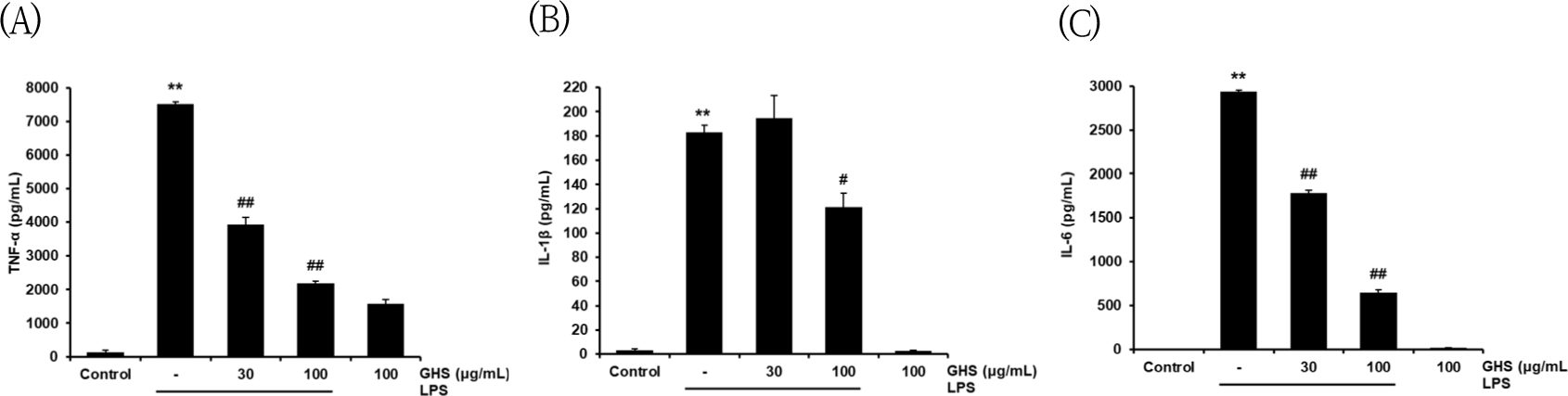
GHS가 전염증성 cytokine의 생성을 억제하는지 평가하기 위하여, LPS로 활성화시킨 Raw 264.7 cell에서 생성된 TNF-α와 IL-1β, IL-6를 측정하였다. GHS를 30과 100㎍/㎖의 농도로 처치하고 18시간 후 ELISA kit로 측정하였다. TNF-α는 control군에서는 136.22 pg/㎖였던 것에 비해, LPS군에서는 7,503.44pg/㎖로 약 55.08배로 유의하게 증가하였고, GHS 30㎍/㎖에서는 3,930pg/㎖로 LPS군과 비교하여 52.38% 수준으로 유의하게 감소시켰으며, GHS 100㎍/㎖에서는 2,189.66pg/㎖로 LPS군 대비 29.18% 수준으로 유의하게 감소시켰다(Fig. 6A). IL-1β는 control군에서는 3.31pg/㎖였던 것에 비해, LPS군에서는 183.22pg/㎖로 약 52.28배로 유의하게 증가하였고, GHS 30㎍/㎖에서는 194.77pg/㎖로 LPS 단독 처치군 대비 106% 수준으로 유의하게 감소시키지는 못하였고, GHS 100㎍/㎖에서는 121.42pg/㎖로 LPS군에 비하여 66.27% 수준으로 유의하게 감소시켰다(Fig. 6B). IL-6는 control군에서는 0.03pg/㎖였던 것에 비해, LPS군에서는 2,934.06pg/㎖로 약 97,802배로 유의하게 증가하였고, GHS 30㎍/㎖에서는 1,783pg/㎖로 LPS군 대비 60.76% 수준으로 유의하게 감소시켰으며, GHS 100㎍/㎖에서는 644.54pg/㎖로 LPS 단독 처치군 대비 21.96% 수준으로 유의하게 감소시켰다(Fig. 6C).
NF-κB pathway가 LPS로 대식세포의 활성화 과정을 거치게 되면, NF-κB를 억제하는 단백질인 IκBα는 인산화되어 p-IκBα와 NF-κB의 복합체가 분리되며, IκBα로부터 유리된 NF-κB는 핵으로 이동하고, NO, iNOS, cytokines를 생성하는 유전자의 전사를 유도하므로, 핵분획에 있어서는 NF-κB의 발현량을 측정하였고, 세포질에 있어서는 p-IκBα, IκBα의 발현 정도를 측정하고 immunoblot analysis로 평가하였다. 세포질 내에서의 LPS에 의해 IκBα 단백질은 control군에 비해 약 13% 수준으로 유의성 있게 감소하였으나, GHS 30㎍/㎖는 LPS군 대비 152.2% 수준으로 증가시켰으며, GHS 100㎍/㎖는 LPS군 대비 299.25% 수준으로 유의성 있게 증가시켰다(Fig. 7A, B).
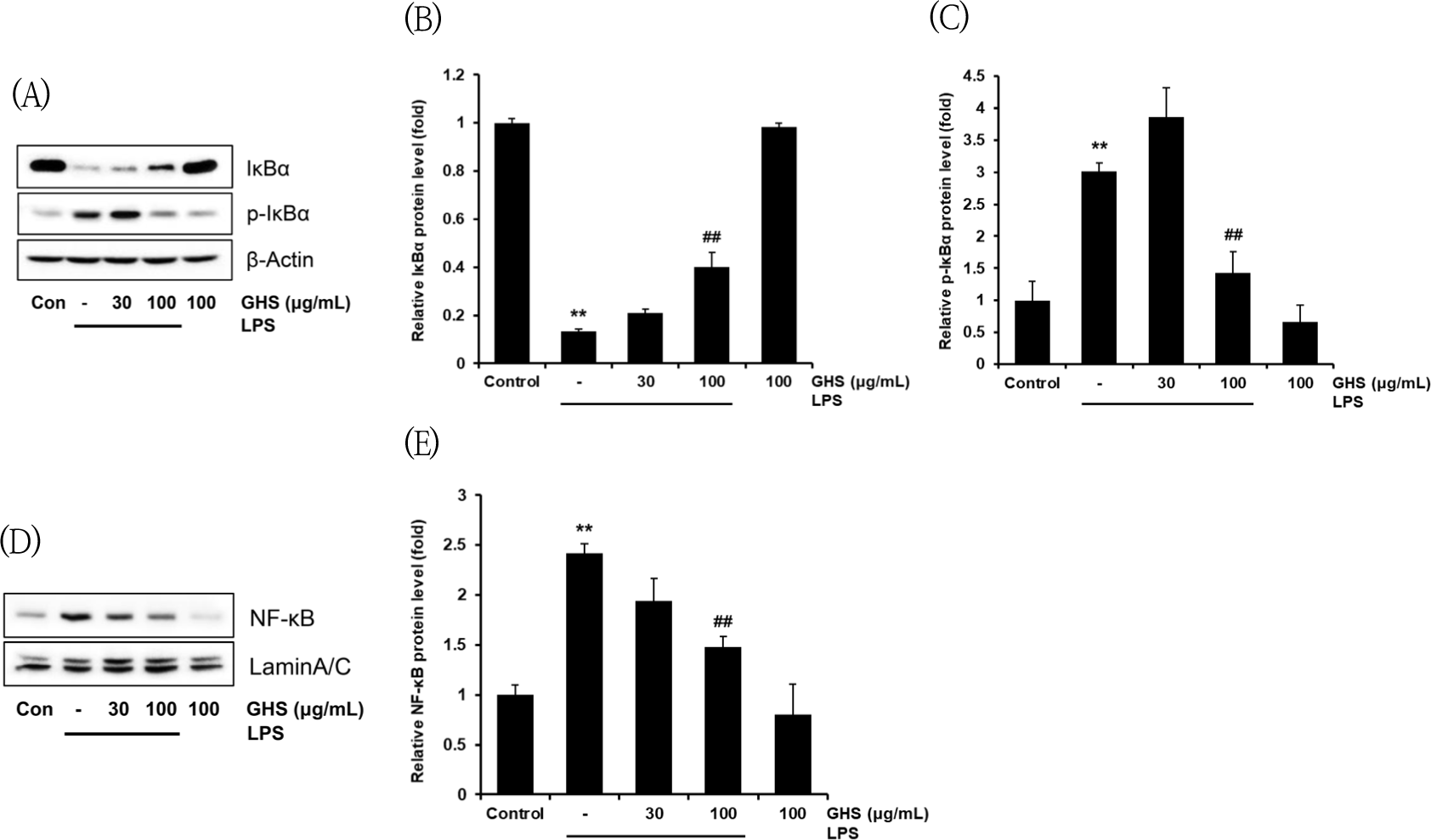
세포질 내에서의 LPS에 의해 p-IκBα의 발현은 약 3배 수준으로 유의성 있게 증가하였으나, GHS 30㎍/㎖는 LPS군 대비 128.45% 수준으로 증가시켰으며, GHS 100㎍/㎖는 LPS군 대비 47.66% 수준으로 유의성 있게 감소시켰다(Fig. 7A, C).
핵 내에서의 LPS에 의한 NF-κB의 발현은 세포질에 서 IκBα가 감소하고, p-IκBα가 증가함에 따라, LPS에 의해 약 2.41배 수준으로 유의성 있게 증가하였으나, GHS 30㎍/㎖는 LPS군 대비 80.35% 수준으로 감소시켰고, GHS 100㎍/㎖는 LPS군 대비 61.00% 수준으로 유의성 있게 감소시켰다(Fig. 7D, E).
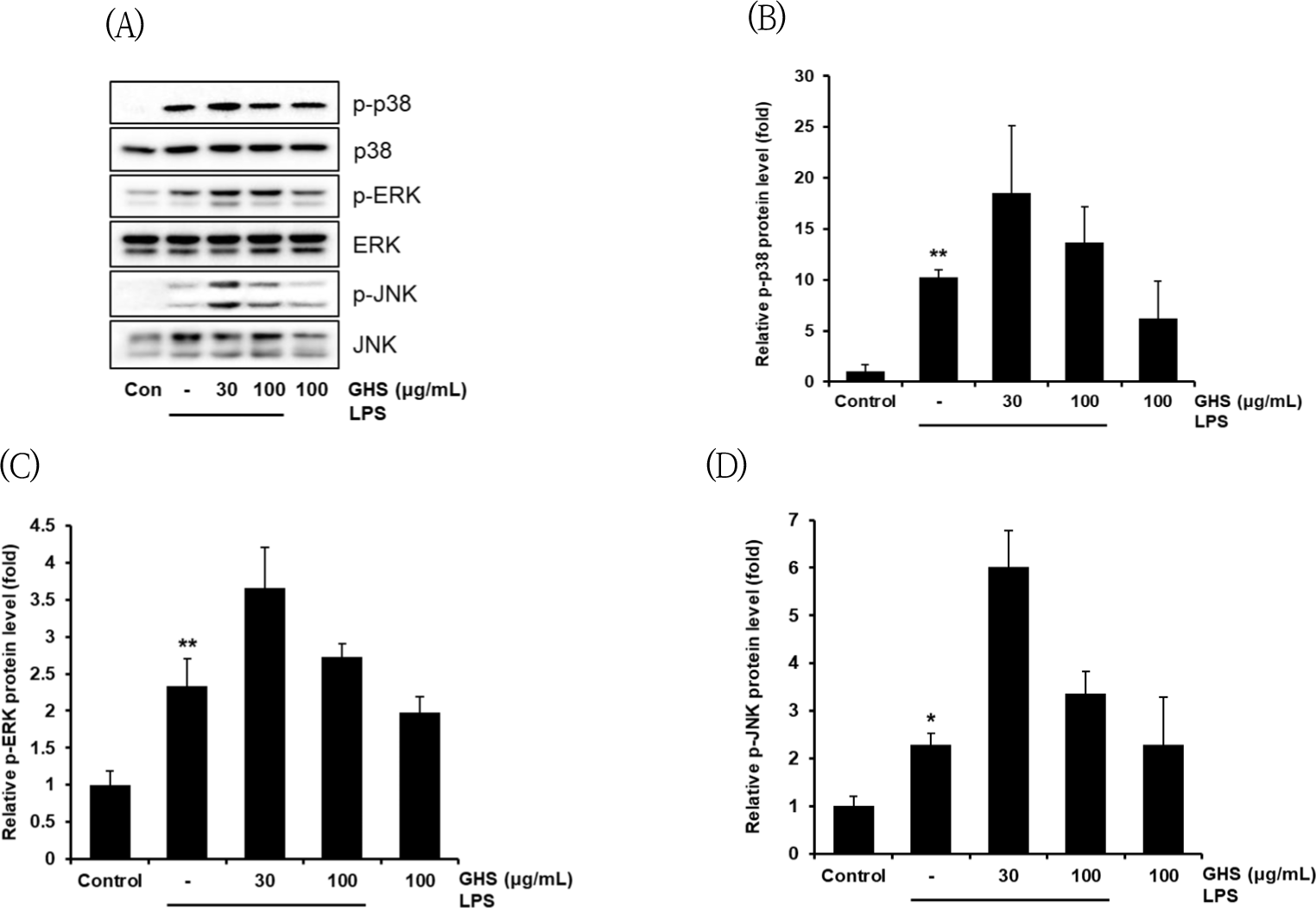
LBP/CD14/TLR4를 거치면서 LPS는 NF-κB 기전, Mitogen-induced protein kinase(MAPK) 기전을 활성화하여 염증반응을 유도하며, GHS는 NF-κB pathway에서 활성을 억제하는 것을 확인하였고, MAPK pathway에 대해서도 LPS가 JNK, p38, ERK에 어떤 영향을 주는지 측정하였다.
p38의 인산화는 LPS군에서는 control군에 비교하여 10.29배로 유의하게 증가하였으며, ERK의 인산화도 LPS군은 control군 대비 2.33배로 유의하게 증가하였 고, JNK의 인산화도 LPS군은 control군 대비 2.27배로 유의하게 증가하였으나, GHS 30㎍/㎖와 100㎍/㎖는 p38과 ERK, JNK의 인산화를 억제하지 못하였다(Fig. 8).
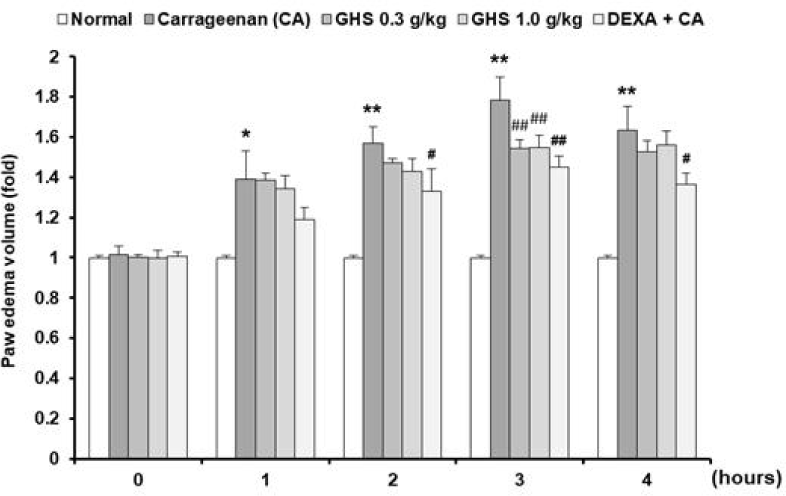
in vitro 연구에서는 GHS가 NF-κB pathway를 억 제하여 항염증 효과를 나타냄을 확인하였고, in vivo 연구에서는 CA에 의해 유발시킨 족부종의 모델에 있어서 GHS이 족부종에 대해 억제하는 정도와 염증에 연관된 지표를 측정하고 분석하였다. CA로 염증을 일으킨 CA군에 있어서 족부종의 정도를 normal군과 대비하여 비교하였을 때 1시간에서 4시간까지에 1시간 간격일 때 1.392배, 1.569배, 1.783배, 1.632배로 증가하여 유의한 족부종이 유발되었다. GHS 0.3g/㎏ + CA군, 1.0g/㎏ + CA군은 3시간에 유의하게 족부종이 억제되었고, DEXA + CA군에서는 2, 3, 4시간에 유의하게 족부종이 억제되었다(Fig. 9).
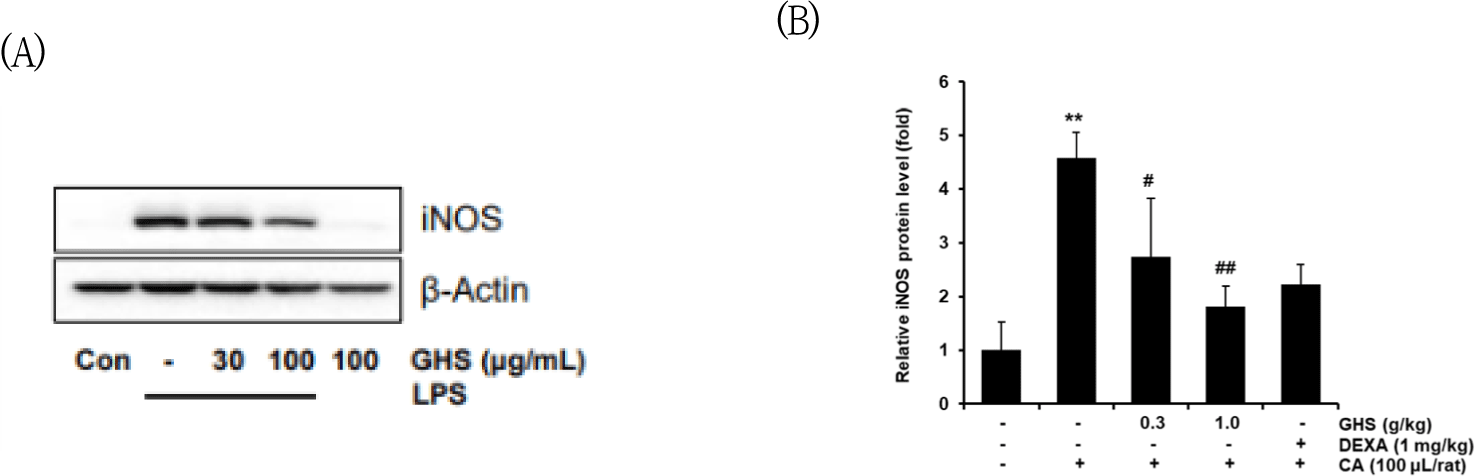
GHS가 족부종을 억제함을 in vivo에서 확인하고 rat의 paw 조직에서 iNOS의 발현을 억제하는지 측정하였다. iNOS의 발현은 CA 처리군에서는 normal군에 대비 4.58배로 유의하게 증가되었고, GHS 0.3g/㎏ + CA군, 1.0g/㎏ + CA군에서는 2.73, 1.81배로 CA군과 비교하였을 때 유의미하게 감소되었고, 양성대조군으로 사용된 DEXA군은 2.22배로 유의한 감소를 보였다(Fig. 10).
Ⅳ. 고 찰
槐花散은 血痢不愈를 치료하고, 槐花(炒)와 地楡(炒) 각 등분으로 구성되어 《衛生總微》에 수록되어 있는 방제이다1). 槐花散의 주치증인 血痢는 서양의학의 궤양성 대장염의 주증상인 혈성 설사와 유사한 증상이다. 만성 염증성 장질환은 장 점막에 원인불명의 염증이 만성적으로 일어나는 질환으로 광의의 세균성 장염, 베체트 장염, 허혈성 장염, 아메바성 이질, 결핵성 장염, 방사선 조사 후 장염 등 모두를 의미하지만 일반적으로 궤양성 대장염(ulcerative colitis)과 크론병(Crohn's disease)으로 나누어질 수 있다23). 크론병의 주증상은 항문 열상, 누공, 복통, 복부 종괴 등이 자주 발생하고, 궤양성 대장염의 주증상으로는 혈성 설사가 심하게 생긴다는 차이가 있다24). 槐花散의 구성 약물의 효능과 기존 연구 결과를 근거로 살펴보았을 때에 槐花散은 궤양성 대장염과 같은 만성 점막 염증성 장질환에 응용 가능할 것으로 보인다. 하지만 지금까지 《衛生總微》의 槐花散에 대한 연구는 전무하며 점막에 생긴 염증의 기전에 대해 밝힌 바가 부족하여 이론적 근거가 약하였다. 이에 저자는 槐花散 열수추출물을 in vitro 모델에서는 Raw 264.7 cell에서 LPS로 활성화시킨 후 항염증 효과에 대한 연구와 in vivo 모델에서는 급성 염증 동물모델을 이용하여 염증 억제 효과를 연구하여 보고하고자 한다.
면역반응에서 염증반응(inflammation)은 정상을 벗어나는 손상을 입거나 감염 등의 자극이 발생하여 손상을 복구하려고 하는 신체의 자연 방어 기전이고 병리학적 상태에서 중요한 역할을 담당한다. 크게 급성과 만성으로 구분되고, 정상 염증반응은 체내에서 시간이 지남에 따라 염증 촉진성 매개물질의 생성은 줄어들고, 항염증성 매개물질은 늘어남으로써 저절로 염증반응이 제한되어야 하지만 비정상으로 염증 매개물질이 과생산되면 염증은 종식되지 않고 염증성 질환으로 악화된다. 반복적이며 만성적 염증반응이 생기면 조직의 손상 원인으로 작용하고, 만성 염증성(chronic inflammatory) 질환, 자가면역성(autoimmune) 질환 및 대사성(metabolic) 질환 등을 일으키게 된다. 따라서 과도하게 항진된 염증반응을 억제하는 항염증 물질의 개발을 위한 연구들이 활발하게 진행되고 있다25).
염증반응의 과정은 LPS를 포함한 다양한 염증 유발성 매개물질이 대식세포 표면의 TLR과 결합하여 유발되기 시작한다. 대식세포는 외부로부터 침입한 인자에 대하여 방어기전을 신속히 내보내면서 활성화된다. 대식세포에 생긴 염증성 인자에 의해 전염증성 매개 물질인 cytokine에 속하는 IL-1β, IL-6, TNF-α 등이 발현되는데, 유전자 기전인 NF-κB 신호전달체계에 의한 전사촉진 및 MAPK 신호전달체계의 인산화 촉진으로, 염증 매개물질인 iNOS와 COX-2가 증가됨에 따라서 전염증물질인 NO와 PGE2가 발현되는 과정이다26).
염증반응의 방어기전은 cytokines, PGE2, lysosomal enzyme, free radicals 등과 같은 다양한 염증 매개물질이 관여하고 있다. 대식세포에서 외부자극에 의한 염증반응으로 IL-6, TNF-α와 같은 염증 매개성 cytokine의 발현이 활성화되고 COX-2, iNOS를 만드는 유전자의 발현이 자극된다. 다음 단계로 iNOS를 통한 NO를 만들고 COX-2에 의해서 PGE2를 생성하는 등의 전염증인자가 생성된다. 또한 NO의 생성과 전염증성 cytokine의 발현은 MAPKs를 통해 일어나며, MAPK pathway는 NF-κB pathway와 함께 염증반응의 중요 기전이 된다27).
한약재는 재배, 채취의 시기나 지역으로 인한 유효성분의 함량에 차이가 발생할 수 있고, 이는 처방의 효과에 영향을 미칠 수 있다. 따라서 槐花散의 항염증 효과에 대한 연구를 진행하기 전에 구성 약재의 주요 지표성분 함량을 확인하였다. GHS에서 槐花의 주요 지표성분인 Rutin(70.606±0.305ppm), Sophoricoside(4.494± 0.033ppm), Sophocarpine(10.101±0.065ppm)이 함유되어 있고, 地楡의 주요 지표성분인 Galic acid (8.46± 0.070ppm)가 함유되어 있음을 확인하고 본 연구를 진행하였다(Fig. 1).
NO는 염증을 일으키는 반응을 조절할 수 있는 인자 중 하나이며, 저농도에서는 항바이러스, 항균 등의 반응을 일으키지만, 고농도에서는 염증 유발, 조직 손상 등과 같은 반응을 하므로 이중적인 성격의 생물학적인 인자이다. NO는 L-arginine에서 NOS가 만들어지면서 생성되는 radical로서 세포 내부에서 2차적인 신호를 전달하는 중요한 역할을 한다28). GHS의 NO 생성 억제 효과가 세포의 생존율을 저하시키는 것에서 생성된 것인지 평가하기 위하여, GHS + LPS에서 세포 생존율을 평가하였고 LPS 단독 처리군은 세포독성이 유의성 있게 나타났으나, LPS + GHS 10, 30, 100, 300㎍/㎖에서의 세포 생존율이 유의한 증감을 나타내지 않았으므로 세포독성이 없는 것으로 확인하였다(Fig. 2B).
GHS의 NO 억제를 확인하고자 Raw 264.7 cell에 대하여 전처치 후 LPS로 염증을 유발하면 NO 생성량이 GHS 10, 30, 100, 300㎍/㎖은 LPS에 의해 각각 3.91, 3.26, 1.40, 1.17배 증가된 NO의 발현을 유의하게 억제하였다(Fig. 2A).
TLRs는 선천적인 면역반응에서 NF-κB 신호전달 경로를 활성화하여 염증반응에 관여하는데, 주로 병원체(세균 등)의 인식에 있어서 중요한 역할을 담당한다29). 수용체와 결합하는 주요 ligand에 따라 포유동물에서의 Toll 수용체로는 10가지 정도가 밝혀져 있으며, TLR4는 ligand인 LPS에 의해 활성화되고, TLR7의 ligand는 LOX에 의해 활성화되며, TLR2의 ligand인 PGN은 그람양성균의 세포벽 산물에 의해 활성화되고, TLR5는 ligand인 flagellin에 의해 활성화된다30). 이 중에 TLR2는 여러 종류의 감염원에 반응하고, 인체에서는 기도 상피, 폐포, 신세뇨관 및 신소체의 보우만낭에서 발견된다. 또한 장 상피세포와 위장관의 점막고유층, 피부의 각질세포와 피지선에서도 발견된다30).
GHS가 LPS, LOX, PGN, FLA 단독 처치 또는 GHS+LPS, GHS+LOX, GHS+PGN, GHS+FLA에서 세포의 생존율을 유의하게 증가시키거나, 감소시키지 않았으므로 세포독성이 없음을 확인하였고, 또한 GHS가 LPS와 PGN에 의한 염증 매개 물질을 억제할 수 있으므로 NO의 생성 억제 효능이 있음을 확인하였다(Fig. 3).
또한 GHS는 유의한 세포독성 없이 LPS-TLR4 매개 NO를 억제하였을 뿐만 아니라, PGN-TLR2 매개 NO 역시 억제하였다. GHS는 NO를 유의미하게 억제함으로써 염증반응을 억제하고 항염증 효과를 가진다는 것을 확인하였고, NO 생성 저해로 염증반응 조절제로 작용하여 NO의 과잉 생산을 억제할 수 있는 항염증 효과를 나타내었다. iNOS는 NO의 생성에 중요하게 관여하는 효소 단백질이며, 염증 시 대량으로 생성되고, NOSs는 constitutively expressed NOS(cNOS)와 iNOS로 크게 두 가지로 나누어지며, cNOS는 저농도에서 생리적으로 작용한다. 또한 iNOS는 LPS, interferon-YIFN-γ(IFN-γ), TNF-α, IL-1 등의 자극에 의해 대식세포, 내피, 간, 심근 세포 등에서 NO를 생성한다32).
본 연구에서는 GHS가 LPS로 유도된 iNOS 발현을 측정하고, 다양한 TLR/ligand인 LOX, PGN, FLA로도 유도하여 iNOS 발현을 측정하였다. LPS군에는 iNOS의 발현이 control 대비 22.03배로 유의하게 증가되었으나, GHS 30㎍/㎖의 농도에서는 LPS군과 유사하였고, GHS 100㎍/㎖에서는 LPS 처치군에 비해 유의하게 감소하였다. 또한 GHS는 LPS와 PGN으로 유도되었을 때 유의하게 iNOS 발현을 억제하였고, 이는 NO 억제의 근거가 된다(Fig. 4). COX는 생물학 반응의 주요 매개체인 prostanoids의 합성에 관여하는 중요한 효소단백질이다. 크게, 주로 항상성의 조절에 쓰이는 프로스타그란딘 합성에 관여하는 COX-1과 염증이 유발된 부위에 활성화된 대식세포에 의하여 염증반응을 매개하는 데에 관여하는 COX-2로 크게 나누어진다33). PGE2는 COX-2의 활성화로 인하여 생성되며, 대식세포 또는 비만세포에서 분비되고 염증 부위의 감각과민을 비롯한 통증 유발, 부종 등을 일으키는 histamine, NO, bradykinin 등과 같이 혈관의 투과성을 향상시킨다34). GHS는 COX-2의 발현에서 PGN군에 비교하여 유의성 있게 감소시켰고, LPS, LOX, FLA군에 비교하여 유의미한 감소는 없었다(Fig. 5A, C).
본 연구에서 PGN군에서 NO, iNOS, COX-2의 유의한 감소는 TRL-2가 장 상피세포와 위장관의 점막고유층에서 발견된다는 점에서 의미가 있다고 생각할 수 있다30). 대식세포(Macrophage)는 식균작용(phagocytosis)을 주기능으로 하며, 피부조직, 호흡기, 소화기 등에 다량으로 존재하고, 대부분의 조직에서 발견된다. 대식세포는 전염증성 cytokine인 IL-6 , TNF-α 등을 발생시키면서 활성화되어 염증반응을 조절하며, 염증반응을 일으키는 동안 일정하게 생성된다35,36).
본 연구에서 GHS는 Raw 264.7 cell을 LPS에 의해 활성화되었을 때에 IL-1β, IL-6, TNF-α의 생성을 유의성 있게 증가시켰고 LPS로 유도된 TNF-α 및 IL-6를 GHS는 농도 의존적으로 유의성 있게 감소시켰다. 따라서 GHS에 의한 IL-6, IL-1β 및 TNF-α의 생성 저하는 전염증성 cytokine의 생성 억제를 나타내는 것임을 확인할 수 있었다. GHS 100㎍/㎖에서는 TNF-α는 LPS 단독 처치군 대비 29.18% 수준으로 유의성 있게 감소시켰고(Fig. 6A), IL-1β도 LPS 단독 처치군 대비 66.27% 수준으로 유의성 있게 감소시켰으며(Fig. 6B), IL-6 또한 LPS 단독 처치군 대비 21.96% 수준으로 유의성 있게 감소시켰다(Fig. 6C).
따라서 GHS는 외부자극(LPS)에 대하여 숙주의 방어와 항상성 유지에 관여하는 대식세포가 활성화되었을 때 분비하는 다양한 cytokine인 IL-6, IL-1β 및 TNF-α 등을 유의미하게 억제하였다. NF-κB는 인체 내의 염증반응 및 면역을 위해 중요한 역할을 하는 대표적인 전사인자로서 여러 염증성 cytokine과 염증 매개물질인 COX-2, iNOS 유전자 발현을 조절하는 전사인자이며 세포의 사멸, 세포 조절, 종양 형성 등과 관련이 있다고 알려져 있으며, 세포질 내 IκB가 p-IκB로 인산화되고 NF-κB가 핵 내로 이동하는 과정으로 염증을 유발하는 신호 경로이다37). GHS는 세포질에서의 IκBα의 단백질은 LPS에 의해 유의성 있게 감소하였으나, GHS 30㎍/㎖는 0.208±0.016배로 LPS 단독 처치군 대비 152.2% 수준으로 증가시켰으며, GHS 100㎍/㎖는 0.401± 0.059배로 LPS 단독 처치군 대비 299.25% 수준으로 유의성 있게 증가시켰다(Fig. 7A, B). LPS에 의해 활성화된 세포질 내에서의 p-IκBα의 발현은 3.008배로 control에 비해 약 3배 수준으로 유의성 있게 증가하였으나, GHS 100㎍/㎖는 1.432배로 LPS 단독 처치군 대비 47.66% 수준으로 유의성 있게 감소시켰으며(Fig. 7A, C), LPS에 의해 활성화된 핵 내에서의 NF-κB의 발현은 세포질에서 IκBα가 감소하고, p-IκBα가 증가함에 따라, LPS에 의해 2.418배로 control군에 비해 약 2.41배 수준으로 유의성 있게 증가하였으나, GHS 30㎍/㎖는 1.943배로 LPS 단독 처치군 대비 80.35% 수준으로 감소시켰고, GHS 100㎍/㎖는 1.475배로 LPS 단독 처치군 대비 61.00% 수준으로 유의성 있게 감소시켰다(Fig. 7D, E). 즉 GHS 100㎍/㎖에서 LPS로 처리하였을 때 세포질 내에서 감소된 IκBα를 유의성 있게 증가시키고 p-IκBα를 감소시켜서 핵 내에서 NF-κB의 발현을 억제하였다.
MAPK 경로는 또 다른 염증 유발 신호 경로이며 NF-κB 활성화에 영향을 주는 대표적인 신호분자이다. MAPKs의 구성은 주요하게 3개로 이루어져 있고, c-JunN-terminal kinase(JNK), p38 kinase(p38), extracellular signal-regulated kinase(ERK)가 그 구성 인자들이다. MAPKs가 활성화되면서 대식세포는 NO를 생성하고 전염증성 cytokine의 발생을 초래한다. MAPK 경로는 cytokine, 스트레스, 성장호르몬 등의 수용체로부터 활성화된 신호를 전달하여 정상적인 세포의 분화 및 증식, 사멸 조절 등의 기능과 단백질 인산화에 의해 한정적으로 조절된다는 특징을 갖고 있다38). GHS는 NF-κB pathway에서 활성을 억제하는 것을 확인하였고, MAPK pathway에서 LPS로 인해 유의하게 증가된 p38, ERK, JNK의 인산화에 대해서 GHS 30㎍/㎖와 100㎍/㎖로 측정한 결과, p-38과 p-ERK, p-JNK를 유의성 있게 억제하지 못하였다(Fig. 8).
in vivo에서 GHS은 염증 유발 물질 CA로 부종을 유발하며 항염증 과정을 연구하는 실험에서 많이 이용되는 CA로 유도된 급성 족부종 모델을 사용하여 평가하였고 3시간에 유의하게 족부종이 억제되었다(Fig. 9). rat의 부종조직에서 iNOS 단백질의 발현은 GHS 1.0g/㎏ + CA군에서는 1.81±0.38배로 CA군에 비교하여 유의성 있게 감소되었다(Fig. 10).
따라서 본 연구를 통하여 GHS는 대식세포에서 염증이 발생되었을 때, in vitro와 in vivo에서 전염증물질인 NO의 발현을 억제하고, 전염증성 매개 물질인 cytokine(IL-6, IL-1β 및 TNF-α)을 억제함으로써 항염증 효과를 나타내었고, NF-κB 전사 경로의 유의미한 억제를 근거로 항염증 기전을 확인하였다.
향후 槐花散의 항염증 기전을 다양한 염증 유발 신호 경로 등을 통한 다각적인 확인이 더해진다면 항염증 효과에 대한 이론적 근거가 확고해질 수 있을 것이며, 구성 약물의 가감에 있어서 용량의 적합 비율과 약재 구성에 따른 효과의 변화가 어떠한지, 槐花散을 다른 방제와 비교해서 血痢不愈를 치료하는 효과는 어느 정도인지에 대한 추가적인 연구가 필요할 것으로 판단된다.
Ⅴ. 결 론
槐花散은 血痢不愈를 치료하는 처방으로 槐花散 열수추출물(GHS)로 in vitro와 in vivo에서 NF-κB pathway, MAPK pathway를 중심으로 항염증 효과를 평가한 결론은 다음과 같다.
in vitro에서는 LPS, LOX, PGN, FLA이 TLR(4, 7, 2, 5)과의 결합으로 활성화된 Raw 264.7 cell에서
-
GHS는 30, 100㎍/㎖에서 세포독성 없이 NO를 유의성 있게 억제하였고, 이러한 결과는 iNOS의 발현을 억제한 것에서 기인하였다.
-
GHS는 PGN-TLR2 매개 NO와 iNOS, COX-2를 유의하게 억제하였다.
-
GHS는 LPS-TLR4 매개 염증 유발성 cytokine인 IL-6, IL-1β 및 TNF-α를 유의하게 억제하였다.
-
GHS는 LPS-TLR4 매개 NF-κB pathway에서는 세포질에서 LPS에 의해 감소된 IκBα를 유의성 있게 증가시키고 p-IκBα를 감소시켜서 핵 내에서 NF-κB의 발현을 억제하였다.
-
GHS는 LPS-TLR4 매개 MAPK pathway에서는 MAPK(JNK, p38, ERK)의 인산화를 유의한 정도로 억제하는 바는 없었다.
in vivo에서는 CA로 유도된 족부종 모델의 염증조직에서
GHS은 NF-κB 기전을 억제함으로써 NO를 감소시키는 항염증의 효능이 있음을 확인하였고, 槐花散이 염증 질환의 예방 및 치료에 사용될 수 있다고 판단된다.






