Ⅰ. 서 론
인간 노화 과정의 일부라 할 수 있는 피부의 노화는 일반적으로 주름, 위축, 탄력 감소, 늘어짐, 거칠음, 칙칙함, 색소 침착 및 두꺼워진 표피를 특징으로 한다1). 주로 진피층에서 볼 수 있는 이러한 피부 노화는 자연스러운 노화의 과정에 수반되는 느리고 지속적이며 비가역적인 조직의 퇴행과 더불어 햇빛, 자외선 및 음주, 흡연과 같은 화학, 독성물질 등에 노출되어 발생한다. 특히 햇빛에 노출되는 피부 부위인 얼굴과 목, 손등과 같은 부위들은 위와 같은 요인이 중첩됨으로써 눈에 띄는 피부 노화에 의한 변화가 나타난다2). 이러한 변화는 피부의 생리적 특성에 기여하는 콜라겐섬유(collagen fiber), 탄력 섬유(elastic fiber) 및 히알루론산(hyaluronic acid) 등과 같은 피부 진피층에 존재하는 세포외기질을 구성하는 요소들의 합성 및 분해 사이의 불균형으로 인해 발생하는 것으로 알려져 있다3). 한편, 피부 건강의 중요 요소인 피부 수분 함량은 수분 손실에 대한 장벽 역할을 하고 있는 각질층과 연관되어 있으며, 건강한 피부의 경우 10% 이상의 수분을 유지한다4). 피부의 수분 함량이 정상 수준 아래로 떨어질 경우, 거친 피부 및 피부의 건조, 표피 박리, 가려움 등으로 나타날 수 있다.
피부는 전체적인 신체의 건강 상태를 반영한다고 하는 만큼, 피부의 노화를 막고 건강한 피부 상태를 유지하기 위한 항산화, 미백, 보습 및 주름개선 등의 기능성 소재를 함유한 다양한 미용 및 건강기능제품이 개발되어 왔다. Vitamin C(L-ascorbic acid, L-AA)는 인체 건강에 대한 효과가 폭넓게 연구되어 온 물질로 다양한 피부 질환 및 피부의 건강, 미용에도 유익한 것으로 알려져 있다. L-AA는 피부 표피 장벽 형성 및 보습 효과와 collagen, elastin, ceramide 합성 촉진 및 항산화 효과 등을 통해 피부 주름 개선 및 자외선 보호 효과를 나타내 피부 건강 유지에 도움을 줄 수 있으며, melanin 형성을 억제하여 피부 미백에도 효과가 있는 것으로 보고된 바 있다5). 그러나 기존의 화학 합성 기반의 피부 기능성 제품들에 함유된 유해한 화학물질 및 잠재적 독소와 관련된 부작용이 지속적으로 제기되어왔으며, 이에 따라 효과적이면서 안전한 약용 식물 및 허브 등 천연물 기반의 피부 기능성 소재의 발굴 및 개발이 주목받고 있다6).
사과는 장미과 낙엽교목 사과나무(Malus pumila Mill.)의 성숙한 과실로, 문헌에 柰子 혹은 苹果로 기록되어 있다. 오늘날의 사과는 柰子의 개량종으로 같은 식물로 분류할 수 있다. 《東醫寶鑑》에 柰子는 성질은 차고 맛은 쓰며, 心氣를 더해주고, 脾를 조화롭게 하며, 中焦의 여러 기운이 부족한 것을 補하는 것으로 기록되어 있으며, 生津, 潤肺, 解暑 등의 작용이 있어 피부에의 효과 또한 기대된다7,8). 미성숙 과실인 풋사과(unripe apple, immature fruit of Malus pumila Mill)는 성숙과실에 비해 유기산, 아미노산, 칼슘이온 및 폴리페놀 등이 많이 존재한다9). 특히 UA의 항산화 활성은 성숙과실 보다 10배 이상 높은 것으로 보고된 바 있으며10), chlorogenic acid, rutin, quercetin glycoside, lutetolin, caffeic acid, p-coumaric acid, phloridzin 등과 같은 항산화능이 우수한 폴리페놀을 다량 함유하고 있는 것으로 보고된 바 있다11,12). 또한, 아토피 피부염13), 음식 알레르기에 대한 개선효과 역시 보고된 바 있어14), 피부 기능 개선을 위한 천연물 신약 및 건강 기능식품 소재로서의 가능성이 기대된다.
따라서 본 연구에서는 정상 ICR 마우스를 이용하여 풋사과 농축분말(UA)의 피부 보습효과를 현재 피부 보호 효과가 잘 정립되어 있는 L-AA(100㎎/㎏)와 비교하여 평가하고자 하였다. 또한 그 작용 기전으로 피부 수분함량에 매우 중요한 영향을 미치는 것으로 알려진 transforming growth factor(TGF)-β1, ceramide, hyaluronan(hyaluronic acid) 및 collagen type I (COL1)의 발현 역시 평가하고자 하였다.
II. 재료 및 방법
개화 후 55-66일 시점에 수확한 풋사과(unripe fruit of Malus pumila Mill.) 100㎏을 착즙하여 얻은 23.75㎏을 여과, 농축하여 5.25㎏을 회수하였다. 덱스트린을 부형제로 첨가한 후 분무 건조하여 최종 12㎏의 풋사과 농축분말(UA)을 얻었으며, 이를 Nutracore (Suwon, Korea)로 제공받아 사용하였다. 풋사과의 활성성분으로 널리 알려진 phloridzin(Sigma-Aldrich, St. Louis, MO, USA)을 지표물질로 설정하여 한국기능식품연구원에 의뢰하여 high-perfomance liquid chromatography로 확인한 뒤 실험에 사용하였다(Fig. 1)11,12). 표준물질(phloridzin)을 이용하여 작성한 검량곡선의 회귀식을 이용하여 성분 함량 측정한 결과, UA의 phloridzin 함량은 0.06㎎/g이였다.
UA의 투여용량 의존적인 피부 보습효과를 동물수준에서 알아보고자 ICR계통의 6주령 수컷마우스(Orient Bio, Seongnam, Korea)를 이용하여 동물실험을 수행하였다. 실험동물은 1주일간 사육시설(온도 22±2℃, 습도 50±5%)에 적응시킨 뒤, 체중을 기준으로 군당 10마리씩 5개군으로 나누어 동물실험에 이용하였다. UA 100, 200 및 400㎎/㎏를 멸균증류수에 용해시켜 매일 1회씩 8주 동안 경구로 투여하였다. 또한 세포 및 동물실험에서 피부보호효과가 널리 알려져 있는 L-ascorbic acid(L-AA, 100㎎/㎏/day)(Sigma-Aldrich)를 양성 대조 약물로 사용하여 비교 평가하였으며5), 정상대조군은 멸균 증류수를 10㎖/㎏로 동일한 기간 동안 경구 투여하였다. 실험동물은 최종 투여 종료 24시간 후에 2-3% isoflurane(Hana Pharm. Co., Hwasung, Korea)을 rodent ventilator(Model 687, Havard Apparatus, Cambridge, UK)로 흡입마취한 뒤 피부 조직을 채취하여 추후 분석에 사용하였다. 본 동물실험은 대구한의대학교 동물실험윤리위원회의 사전 승인을 얻어 수행하였다(Approval No. DHU2021-028).
실험동물 개체의 체중 측정은 약물 투여 시작 1일 전부터 투여 종료 시까지 매주 1회 자동전자저울(XB320M, Precisa Instrument, Zuerich, Switzerland)을 사용하여 측정하였다.
피부 수분 함량은 지름 6㎜의 등 쪽 피부 조직을 채취하여, Automated moisture anlayzer balance (MB23, Ohaus, Pine Brook, NJ, USA)를 이용하여 측정하였다. 피부 수분의 함량은 피부 조직의 전체 중량에 대한 백분위 값으로 제시하였다.
최종 투여 종료 24시간 후 등 쪽 피부 조직을 채취한 후 조직을 tacoTM Prep Bead Beater(GeneReach Biotechonology Corp., Taichung, Taiwan) 및 ultrasonic cell disruptor(KS-750, Madell Technology Corp., Ontario, CA, USA)를 이용하여 균질화하였다. 이를 radioimmunoprecipitation assay(RIPA) buffer(Sigma-Aldrich)에 용해한 뒤, 원심분리(15,000×g, 30min, 4℃)하여 상층액을 분리하였다. Procollagen type I C-peptide(PIP) EIA kit(Takara Bio, Tokyo, Japan)를 이용하여 제조사의 매뉴얼에 따라 정량 측정하였다.
Hyaluronan 함량의 측정은 채취한 등 쪽 피부 조직을 acetone으로 탈지하고, 50mM Tris/HCl(pH7.8) buffer에 20분 동안 끓인 뒤 1% actinase E(Sigma-Aldrich) proteolytic digestion 용액에 넣어 일주일 동안 40℃로 가열하였다. 그 다음으로 trichloroacetic acid(Sigma-Aldrich)를 전체 용액의 10%가 되도록 더하여 탈단백화한 뒤, 원심분리(3,000×g, 20min, 4℃)하여 상층액을 분리하였다. 분리한 상층액을 10N의 NaOH로 중화한 뒤, mouse hyaluronic acid enzyme-linked immunosorbent assay(ELISA) kit(Mybiosource, San Diego, CA, USA)를 이용하여 제조사의 매뉴얼에 따라 hyaluronan을 정량 측정하였다.
피부 조직 내 ceramide 함량은 primary antibody coated plate excluded blank ELISA kit(MyBioScience)를 이용하여 제조사의 매뉴얼에 따라 샘플을 준비한 뒤, 96 well plate에 10㎍/well의 농도로 샘플을 4℃에서 하룻밤 동안 코팅하여 측정하였다. 단일클론 ceramide 항체(Sigma-Aldrich, Cat. No. C8104)와 샘플을 면역반응 시킨 후, 3,3`,5,5`- Tetramethylbenzidine substrate와 반응시켜 microplate reader(Sunrise, Tecan; Männedorf, Switzerland)로 450㎚에서 측정하여, standard ceramide(Sigma-Aldrich)와 대비하여 그 함량을 계산하였다.
피부 조직 내 TGF-β1 함량은 mouse TGF-β1 PicoKineTM ELISA kit(MyBioSource, San Diego, CA, USA)를 이용하여 제조사의 매뉴얼에 따라 측정하였다.
피부 조직 내 Hyaluronan Synthase(HAS1, HAS2, HAS3), Collagen type 1 alpha(COL1A1, COL1A2) 및 TGF-β1 유전자의 발현량을 측정하기 위해, 먼저 채취한 등 쪽 피부 조직으로부터 Trizol reagent(Invitrogen, Carlsbad, CA, USA)를 이용하여 total RNA를 분리하였다. 그 후 High-Capacity cDNA Reverse Transcription Kit(Thermo Fisher Scientific Inc., Rockford, IL, USA)를 이용하여 역전사시켜 cDNA를 합성한 뒤 ABI Step One Plus Sequence Detection System(Applied Biosystems, Foster City, CA, USA)를 이용하여 Real-time PCR을 수행하였다. 각 유전자의 증폭산물은 β-actin의 증폭량에 대비하여 상대 정량하였다. 실험에 사용한 HAS1, HAS2, HAS3, COL1A1, COL1A2 및 TGF-β1의 primer 염기서열은 Table 1에 정리하였다.
실험군 간의 다중 비교를 위하여 SPSS for windows(Release 14.0K, SPSS Inc.) 프로그램을 사용하여 통계적 분석을 실시하였다. 모수적 방법으로는 Levene test를 실시하여 등분산성을 검정한 후 그 결과에 따라 일원배치분산분석(One-way analysis of variance) 후 Tukey’s honest significant difference (HSD) test로 사후검정을 실시하였다. 비모수적방법으로는 Kruskal-Wallis H test로 분산분석을 실시한 후 Mann-Whitney U test로 사후검정하였다. 모든 통계값은 평균±표준편차로 제시하였으며, p값이 0.05 미만일 경우 통계적 유의성이 있는 것으로 판정하였다.
III. 결 과
정상대조군의 투여 시작 하루 전 체중은 평균 32.04 ±1.81g이였으며, 투여 시작 시점(Day 0)에 절식에 의하여 평균 29.03±1.84g으로 감소하였다. 이후 정상 대조군의 평균 체중은 점차 증가하여 최종 투여 시점(Day 55)에 평균 29.03±1.84g이였다(Fig. 2). 모든 측정 시점에서의 정상대조군과 UA 100, 200 및 400㎎/㎏ 또는 L-AA 100㎎/㎏ 투여군 평균 체중 사이의 유의한 차이는 발견되지 않았다(Fig. 2).
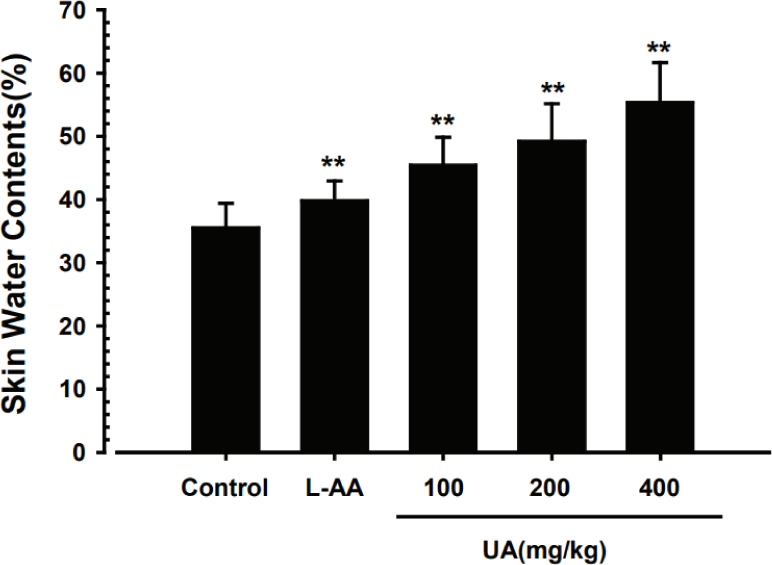
풋사과 추출물(UA)이 마우스의 피부 수분 함량 변화에 미치는 영향을 관찰하기 위하여, 등 쪽의 지름 6㎜의 피부 조직을 채취하여 수분 함량을 측정하였다. 정상대조군의 피부 수분 함량은 평균 34.79±2.50%로 나타났으며, UA 100, 200 및 400㎎/㎏ 각각 42.35±4.06%, 45.37±4.36%, 50.20±6.46%로, 모든 군에서 정상대조군에 비하여 유의하게 피부 수분의 함량이 증가하였다. 특히, UA 200, 400㎎/㎏의 농도에서는 L-AA와 비교하여 피부 수분 함량에 유의한 차이를 보이지 않았다(Fig. 3).
UA가 피부 조직 내 COL1 함량 변화에 미치는 영향을 관찰한 결과, 정상대조군 대비 UA 100, 200 및 400㎎/㎏ 투여군의 피부 조직 내 COL1 함량은 각각 평균 130.00±10.36%, 147.30±13.03%, 161.50± 14.92%로 정상대조군에 비해 유의하게 증가한 것으로 나타났다(Fig. 4). 특히, UA 200㎎/㎏의 농도에서는 L-AA와 비교하여 피부 COL1 함량에 유의한 차이를
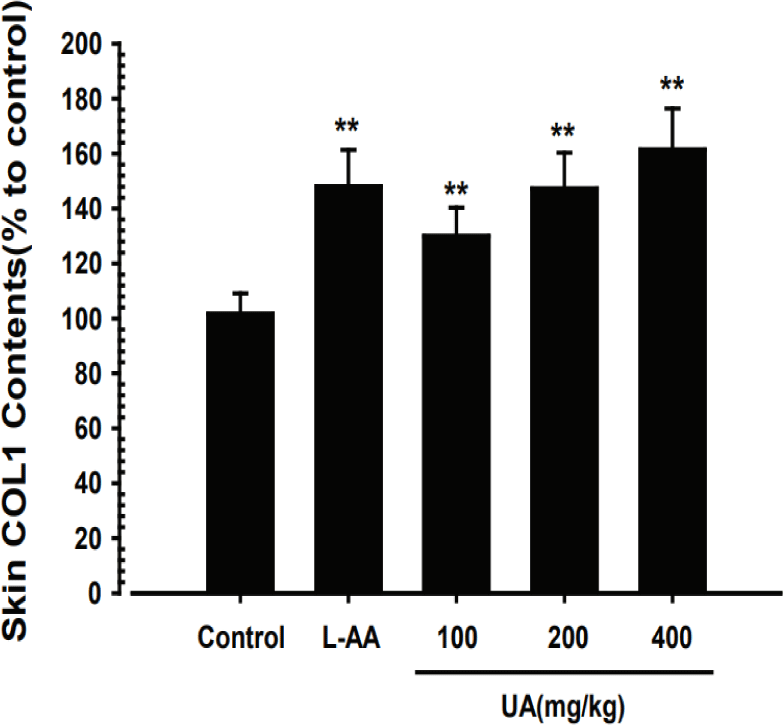
보이지 않았으며, 400㎎/㎏의 농도에서는 L-AA에 비해 유의한 피부 COL1 함량의 증가를 나타내었다(Fig. 4). 특히, UA 200, 400㎎/㎏의 농도에서는 L-AA와 비교하여 피부 COL1 함량에 유의한 차이를 보이지 않았다(Fig. 4).
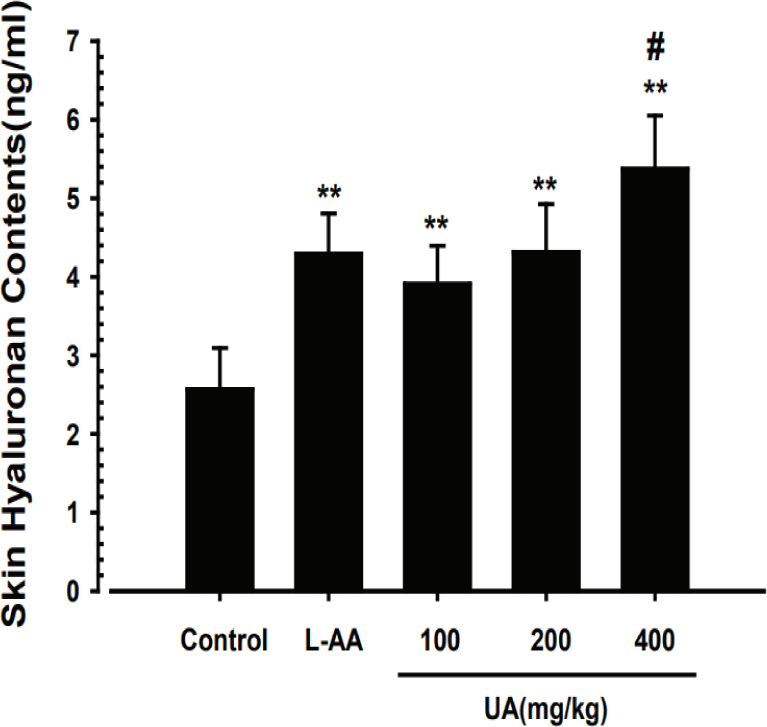
UA가 피부 조직 내 hyaluronan 함량 변화에 미치는 영향을 ELISA kit를 사용하여 확인하였다. 관찰 결과, 정상대조군은 평균 2.57±0.53ng/㎖로 나타났으며, UA 100, 200 및 400㎎/㎏ 투여군은 각각 평균 3.91±0.49, 4.31±0.61, 5.37±0.68ng/㎖로 측정되어 UA의 투여가 정상대조군에 비해 유의하게 피부 조직 내 hyaluronan 함량을 증가시키는 것으로 나타났다(Fig. 5). 특히, UA 200㎎/㎏의 농도에서는 L-AA와 비교하여 피부 hyaluronan 함량에 유의한 차이를 보이지 않았으며, 400㎎/㎏의 농도에서는 L-AA에 비해 유의한 피부 hyaluronan 함량의 증가를 나타내었다(Fig. 5).
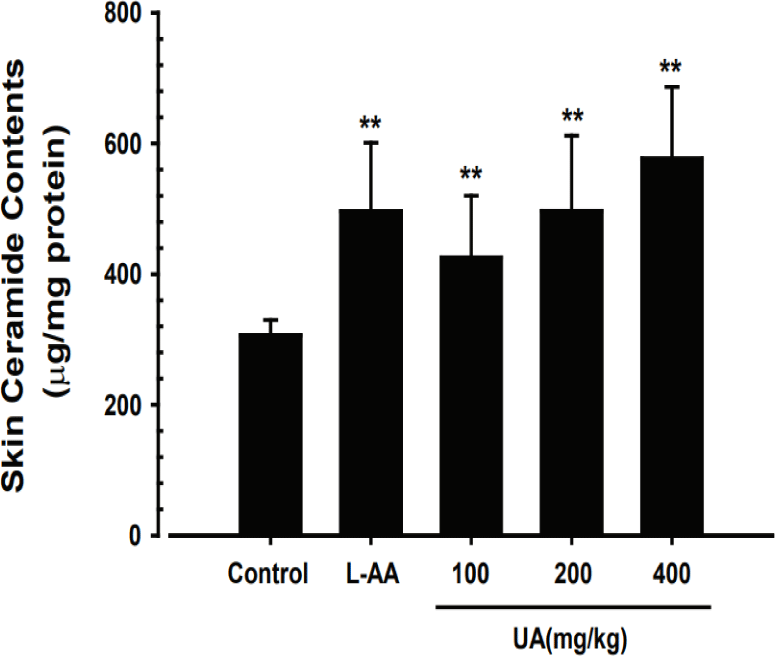
UA가 피부 조직 내 ceramide 함량 변화에 미치는 영향을 관찰한 결과, 정상대조군은 평균 306.62± 23.12μg/㎎ protein으로 나타났으며, UA 100, 200 및 400㎎/㎏ 투여군은 각각 평균 425.51±94.53, 496.82±115.30, 576.82±109.63μg/㎎ protein으로 측정되어 UA의 투여가 정상대조군에 비해 유의하게 피부 조직 내 ceramide 함량을 증가시키는 것으로 나타났다(Fig. 6). 특히, UA 200, 400㎎/㎏의 농도에서는 양성대조군인 L-AA와 비교하여 피부 조직 내 ceramide 함량 변화에 유의한 차이를 보이지 않았다(Fig. 6).
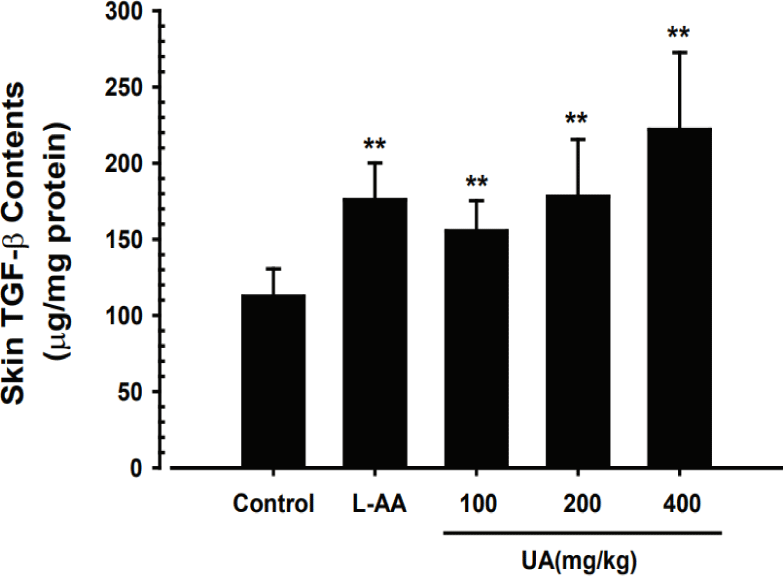
UA가 피부 조직 내 TGF-β1 함량 변화에 미치는 영향을 ELISA kit를 사용하여 확인하였다. 정상대조군은 평균 112.46±18.12μg/㎎ protein으로 나타났으며, UA 100, 200 및 400㎎/㎏ 투여군은 각각 평균 155.46±19.98, 178.22±37.31, 222.08±50.54μg/㎎ protein으로 측정되어 UA의 투여가 정상대조군에 비해 유의하게 피부 조직 내 TGF-β1 함량을 증가시키는 것으로 나타났다(Fig. 7). 특히, UA 200, 400㎎/㎏의 농도에서는 L-AA와 비교하여 피부 TGF-β1의 함량에 유의한 차이를 보이지 않았다(Fig. 7).
UA가 hyaluronan의 합성과 관련된 HAS1, HAS2 및 HAS3 유전자의 발현에 미치는 영향을 realtime RT-PCR을 통해 확인하였다. 피부 조직내 HAS1 mRNA 발현은 정상대조군과 대비하여 UA 100, 200 및 400㎎/㎏ 투여군에서 각각 1.38±0.15, 1.68± 0.19, 2.07±0.43배 유의하게 증가하였으며, HAS2 mRNA의 발현 역시 정상대조군 대비 UA 100, 200 및 400㎎/㎏ 투여군 각각 1.37±0.16, 1.67±0.21, 2.06±0.42배 유의한 증가를 보였다. HAS3 mRNA 발현 역시 UA 100, 200 및 400㎎/㎏ 투여군 각각 정상대조군 대비 1.31±0.15, 1.55±0.21, 1.97±0.42배 유의하게 증가한 것으로 나타났다(Table 2).
UA가 피부 조직 내 collagen의 합성과 관련된 COL1A1와 COL1A2 유전자의 발현에 미치는 영향을 realtime RT-PCR을 통해 확인하였다. 그 결과, 피부 조직 내 COL1A1 mRNA 발현은 UA 100, 200 및 400㎎/㎏ 투여군에서 각각 정상대조군과 대비 1.49± 0.20, 1.77±0.21, 2.27±0.34배 유의하게 증가하였으며, COL1A2 mRNA의 발현 역시 UA 투여군 각각 정상대조군 대비 1.42±0.21, 1.69±0.20, 2.15±0.29배 유의하게 증가한 것으로 관찰되었다(Table 2).
UA가 피부 조직 내 TGF-β1 mRNA 발현에 미치는 영향과 관련하여서는 UA 100, 200 및 400㎎/㎏ 투여군에서 각각 정상대조군 대비 1.50±0.23, 1.69± 0.14, 1.91±0.27배 유의하게 증가한 것으로 나타났다(Table 2).
특히, UA 200, 400㎎/㎏의 농도에서 양성대조군인 L-AA와 비교하였을 때 HAS, COL1A 및 TGF-β1 모두의 mRNA 발현 변화에 있어 유의한 차이를 보이지 않았다(Table 2).
IV. 고 찰
나이가 들어감에 따라 피부는 더 이상 이전처럼 탱탱하고 생기가 있으며 매끄러워지지 않게 된다. 표피와 진피의 성분 구성 및 구조의 퇴행적 변화에 더하여 외부 자극 요인(자외선, 공기 오염, 화학 독성 물질 등)에 따라 표피가 얇아지고 각질층이 증가하여 잔주름과 처짐 및 멜라닌 색소의 침착 등이 일어나게 된다6). 한의학적으로 이러한 피부 손상은 外邪에 해당하는 暑熱, 燥邪 또는 노화에 따른 陰虛에 의해 피부의 津液을 充養하지 못함으로 인해 생기는 것으로 생각된다. 이에 피부 노화 방지에 대한 요구가 증가함에 따라 미백, 주름 개선, 보습, 자외선 차단 및 피부 손상 보호 등의 기능을 가진 피부 기능성 제품들이 발달하게 되었다. 화장품, 식품을 포함한 피부 기능성 제품 산업은 부가가치가 매운 큰 산업으로 그 규모는 지속적으로 성장하고 있다. 특히, 천연물 기반 제품의 시장은 전체 시장보다 더욱 빠르게 성장하고 있다15). 사과(柰, 苹果)는 한의학적으로 生津, 潤肺, 解暑의 작용이 있어 피부의 積熱을 淸하고 津液을 보충하는데 적합할 것으로 생각된다. 사과의 미성숙 과실인 풋사과는 사과에 비해 활성성분이 더 풍 부한 것으로 보고된 바 있으나, 해마다 20-30%의 미숙과가 폐기처분되는 실정으로 경제적, 환경적으로 문제가 되고 있어 풋사과의 다양한 활용법이 요구된다11). 따라서 본 연구에서는 풋사과추출물(UA)을 이용하여 피부 기능 개선을 위한 천연물 기반 기능성 식품 소재로서의 가능성을 탐색하고자 하였다.
사람 피부의 각질층은 정상적으로 10-20% 정도의 수분을 함유하고 있어, 피부에 적절한 탄력을 제공하며 피부의 낙설(desquamation) 과정에 필요한 가수분해 효소가 적절하게 기능하도록 한다. 그러나 수분 함량이 정상수준 이하로 감소할 경우 위와 같은 효소의 기능의 상실로 인해 각질세포가 피부에 축적되어 피부가 건조하여 거칠어지고 벗겨지는 등의 비정상적인 변화가 발생하게 된다. 일상에서의 태양광, 낮은 습도 및 계면활성제의 잦은 사용으로 인한 수분의 손실로부터 피부를 보호하기 위해서는 적절한 관리가 중요하다4). hyaluronan은 흡습성 고분자로 인체에서는 절반 이상이 피부에 존재하여 피부 층의 공간을 수분으로 채움으로써 피부 수분을 유지하는데 기여한다16). 실제로 hyaluronan의 섭취는 얼굴 각질층의 수분을 증가시키는 것으로 보고된 바 있다17). 본 연구에서 UA의 경구 투여가 피부 보습에 미치는 효과를 관찰한 결과, UA의 모든 투여 농도(100, 200 및 400㎎/㎏)에서 정상군에 비해 유의한 피부 수분 함량의 증가를 확인하였다. 또한, UA는 피부 조직 내 hyaluronan의 발현을 유의하게 증가시켰으며, HAS1, HAS2, HAS3의 mRNA의 발현 역시 유의하게 증가시켰다. HAS1과 HAS2는 큰 분자의 hyaluronan의 합성을, HAS3는 좀 더 작은 분자 크기의 hyaluronan의 합성을 담당하는 것으로 알려져 있다18). 따라서 UA의 피부 보습 효과는 HAS 유전자의 발현 조절에 의한 피부 조직 내 hyaluronan의 증가에 기인한 것으로 생각된다.
피부 표피의 각질층은 건조한 환경에서 수분 손실을 방지하는 투과성 장벽으로써 기능한다. 피부 기능 개선을 위한 소재는 피부의 재생 및 탄력을 강화하고 주름 형성을 방지하는 것뿐만 아니라 피부 collagen과 elastin의 분해를 방지하고 보존하여 피부 각질층의 정상적 기능을 강화하는 것 역시 중요하다6). UA의 투여로 피부 조직 내 COL1A1, COL1A2 mRNA 및 collagen의 발현이 유의하게 증가한 본 연구의 결과는 피부 수분 손실의 방지 및 주름 형성 억제에 도움을 줄 수 있는 피부 기능성 소재로서의 UA의 개발 가능성을 시사한다. 또한, UA는 피부 조직 내 ceramide의 함량을 유의하게 증가시키는 것으로 관찰되었다. ceramide는 각질층을 구성하는 주요 성분 중 하나이며, 피부 장벽 기능 및 피부 보습에 중요한 역할을 담당하는 인자로, 아토피 피부염에서는 ceramide의 수치가 감소되어 있는 것으로 알려져 있다19). UA는 피부 조직 내 ceramide의 함량을 증가시켜 피부 장벽의 기능을 강화하여 피부 수분 손실을 방지함으로써 피부 건강을 유지하는데 도움을 줄 수 있을 것으로 생각된다20).
TGF-β는 세포외기질 구성 요소의 발현을 조절하는 인자로, 섬유아세포(fibroblast)를 자극하여 collagen, elastin, hyaluronan 등을 합성함으로써 피부 전해질 조절, 수분 보유 및 피부 재생, 상처 회복 과정에 관여하는 것으로 알려져 있다21,22). 따라서 TGF-β 신호의 적절한 조절은 피부의 건강을 유지하는데 필수적이라 할 수 있다. 본 연구의 결과에 따르면 UA의 투여에 의해 피부 조직 내 TGF-β1의 mRNA 및 단백질 함량이 유의하게 증가하는 것으로 나타났다. TGF-β는 섬유아세포에서 collagen 및 hyaluronan의 합성을 증가시키는 것으로 알려져 있다22). TGF-β1는 진피와 표피에서 HAS1과 HAS2의 유전자를 차등적으로 조절하며16), 성장인자에 노출된 섬유아세포에서는 HAS2가 hyaluronan의 합성에 주된 역할을 하는 것으로 알려져 있다23). 피부가 자외선에 노출되면 피부 섬유아세포의 HAS2 유전자가 감소하고 이에 따라 hyaluronan의 합성이 억제된다24). 한편, TGF-β가 HAS1 mRNA의 발현은 증가시키고 HAS3 mRNA의 발현은 억제시킨다는 보고가 있어, 피부에서 HAS의 isoform에 따라 개별적으로 다르게 조절될 가능성이 있다25). 본 연구에서 관찰된 UA의 피부 조직 내 collagen, hyaluronan의 증가 효과는 TGF-β1에 의한 조절 효과일 수 있으나 좀 더 세부적인 기전 연구가 뒷받침되어야 할 것으로 생각된다.






