Ⅰ. 서 론
염증은 감염 등에 대한 대식 세포 등의 면역세포 등의 보호 반응이다. 염증 자체는 정상적인 방어 작용이며, 생명체를 유지하는 필수 방어 체계로, 조직의 재생을 증진시키거나 감염을 치유하지만, 지나칠 경우 조직의 손상을 유발하기도 한다. 대표적인 만성, 재발성 염증성 피부질환인 아토피 피부염(atopic dermatitis, AD)1,2)은 심한 소양감과 홍반, 부종, 피부건조 등의 피부 증상과 함께3,4) 수면장애, 정서불안 등을 동반한다5,6). 아토피 피부염은 여러 요인들의 복합적인 영향으로 인해 유발된다7).
아토피 피부염의 치료에는 스테로이드나 칼시뉴린 억제제 등의 국소치료제가 사용되며, 만성의 경우, 사이클로스포린과 같은 전신 면역 억제제의 경구 투여 및 광선치료 요법 등이 사용된다8,9). 이러한 치료법은 장기적으로 사용했을 때 부작용이 발생할 수 있어, 보다 안전한 치료방법에 대한 연구 필요성이 높아지면서 안전한 한약 제제 혹은 천연물 제제를 소재로 하는 새로운 치료방법이 연구되고 있다10-2).
山白菊(Aster glehni)은 대한민국 울릉 지역의 대표적인 산채 특산물이다. 한의약에서 Aster속 식물들은 주로 뱀에 물리거나 상처, 타박상 등을 치료하는 용도로 사용되어 왔고 Aster 속인 山白菊 역시 항독, 항염증 효과가 있는 것으로 알려져 있다13). 山白菊의 피부 노화 방지, 미백, 주름 개선 등의 미용 목적으로의 효과에 대한 연구와,14-8) RAW 264.7 대식세포에서의 항염증 효과에 대한 연구가 시행된 바 있다19).
이에 본 저자는 사람 각질 형성 세포주인 Human Adult low calcium High Temperature(HaCaT)세포에서 山白菊 열수추출물이 피부 염증 완화에 효과가 있는지 연구하였다.
Ⅱ. 재료 및 방법
山白菊은 울릉도에서 자란 것을 직접 채취하여 사용하였다. 山白菊 열수추출물을 얻기 위하여 증류수 1ℓ에 山白菊 100g을 넣어 3시간 전탕(10배수 3시간; 1시간*3회)하여 얻은 액을 여과시키고 동결건조하였으며 그 수율은 32%였다. 동결건조한 시료는 3차 증류수에 녹여 여과 후 사용하였다.
Dulbecco’s modified Eagle’s medium(DMEM), fetal bovine serum(FBS), penicillin, and strep- tomycin을 Life Technologies Inc.(Grand Island, NY, USA)에서 구입하여 사용하였다. 3-(4,5-dimethyl thiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT), N6-(1-Iminoethyl)lysin(NIL)은 Tokyo Chemical Industry Co.(Tokyo, Japan)과 (Sigma Chemical Co.(St. Louis, MO, USA)에서 각각 구입하였다. 또한 Dimethyl sulfoxide (DMSO)는 Junsei Chemical Co. Ltd.(Tokyo, Japan)에서 구입하였다. 사이토카인 생성 확인을 위한 human TNFα와 IL-6 Enzyme-linked immunosorbent assay(ELISA) 분석을 위해 kit를 구입하였다(BD OptEIATM, BD Science, San Jose, CA, USA). 단백질 발현을 확인하기 위한 p-ERK, p-STAT1(Tyr 701), p-STAT1(Ser 727), STAT1 등의 1차 항체들은 Cell signaling Technology, Inc.(Danvers, MA, USA), ERK, β-actin 등의 1차 항체들은 Santa Cruz Biotechnology, Inc.(Dallas, Tx, USA)에서 구입하였다. Horseradish peroxidase-conjugated secondary antibodies는 Jackson Immuno Research laboratories, Inc.(West Grove, PA, USA)에서 구입하였다. mRNA 발현 확인을 위한 RT-PCR의 실험 재료로 SYBR green master mix는 Applied Biosystem(Foster, CA, USA)에서 구입하였다. IL-6, TNF-α, TARC, MDC, glyceraldehyde-3-phosphate dehydrogenase (GAPDH) 등의 oligonucleotide primer들은 Bioneer(Daejeon, Republic of Korea)를 통하였다(Table 1).
성인 각질형성세포 HaCaT는 96-well plate에 5×104cells/㎖의 농도로 seeding하고 山白菊 열수추출물을 처리한 후 24시간 동안 배양한 뒤 MTT 용액을 첨가하여 다시 24시간 동안 배양하였다. 그 후 50㎕의 MTT 시약을 넣어 4시간 동안 반응시켰다. 그 후 배양액을 제거하고 Formazan 생성물을 DMSO에 용해하고, 그 용해액을 96-well plate에 넣어 microplate reader를 이용하여 540㎚의 파장값에서 측정하였다. 세포의 생존율을 어떠한 처리도 가하지 않은 control군의 세포에서의 측정값과 비교하여 나타내었다.
전염증성 사이토카인의 염증 매개물질은 세포 상층액에서 ELISA 방법으로 정량하였다. 1×105cells/㎖의 밀도로 seeding된 세포에 山白菊 열수추출물을 처리하고 1시간 후에 TNF-α와 IFN-γ를 첨가하여 24시간 배양 후 세포 상층액을 얻어 분석 전까지 –80℃에서 보관하였다. ELISA는 human ELISA kit인 TNF-α와 IL-6 BD OptEIATM(BD Science, San Jose, CA, USA) 제품의 안내에 따라 진행하였다.
1×105cells/㎖의 밀도로 seeding된 세포에 山白菊 열수추출물을 처리하고 1시간 후에 TNF-α와 IFN-γ를 첨가하여 6시간 배양한 세포에 easy-BLUETM total RNA extraction kit(iNtRON Biotechnology Inc., Gyeonggi-do, South Korea)를 처리하였다. 그 후 정량한 RNA를 이용하여 cDNA를 합성하고, SYBR green PCR mast mix(Applied Biosystems, CA, USA)를 이용하여 real-time PCR(Real Time PCR System 7500, Applied Biosystems, CA, USA)을 진행하였다. IL-6, TNF-α, TARC, MDC의 CT값은 GAPDH의 Ct 값과 비교하여 gene express 2.0 program(Applied Biosystems, CA, USA)으로 발현 정도를 확인하였다.
1×105cells/㎖의 밀도로 seeding된 세포에 山白菊 열수추출물을 처리하고 1시간 후에 TNF-α와 IFN-γ를 첨가하여 20분 혹은 1시간 동안 배양한 세포에 protein lysis buffer Pro-prepTM(Intron biotechnology Inc., Gyeonggi-do, South Korea)을 넣어 단백질을 추출하였다. 단백질 8-12% sodium dodecyl sulphate- polyacryl amide gel에서 전기 영동하여 polyvinyli- denedifluoride membrane에 옮긴 후, 1차 및 2차 항체를 반응시켰다. ECL 용액(Absignal, Seoul, Republic of Korea)을 사용해서 단백질 발현을 chemiluminescence(GE Healthcare Life Sciences, Chalfont, UK)를 통해 확인하였다. 그 결과는 Bio- Rad Quantity One® software를 통해 분석하였다.
Ⅲ. 결 과
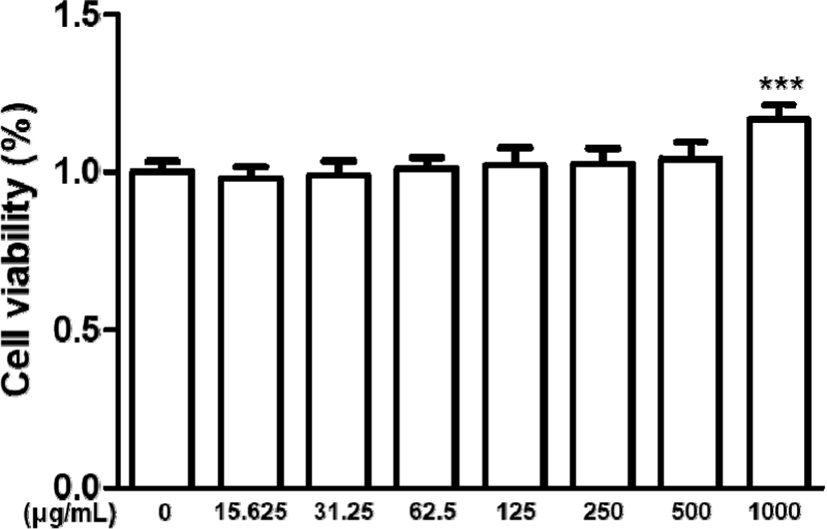
HaCaT 각질형성세포에 山白菊 열수추출물을 15.625㎍/㎖, 31.25㎍/㎖, 62.5㎍/㎖, 125㎍/㎖, 250㎍/㎖, 500㎍/㎖, 1,000㎍/㎖의 농도로 24시간 동안 처리하여 세포생존율을 MTT 분석을 통해 측정하였다. 각각 세 번의 독립적인 시행을 통해 나타난 결과는 15.625㎍/㎖, 31.25㎍/㎖, 62.5㎍/㎖, 125㎍/㎖, 250㎍/㎖, 500㎍/㎖의 농도에서는 유의성 있는 세포 독성이 발견되지 않음을 확인하였고, 1,000㎍/㎖의 농도에서는 HaCaT 각질형성세포가 급격하게 증식하는 것을 확인하였다.
이에 세포의 생존율이 급격하게 증가하는 농도인 1,000㎍/㎖은 제외하였고, 독성이 없으면서 약효를 기대할 수 있는 농도인 125㎍/㎖, 250㎍/㎖, 500㎍/㎖의 세 가지 농도를 연구에 사용하였다.
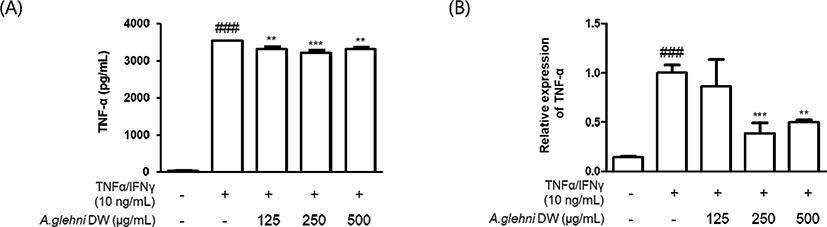
HaCaT 각질형성세포를 山白菊 열수추출물(125㎍/㎖, 250㎍/㎖, 500㎍/㎖)로 1시간 동안 전처리하였다. 그리고 TNF-α 생성과 mRNA 발현을 관찰하기 위해 세포들을 TNF-α/IFN-γ(10ng/㎖)로 24시간 동안 처리한 (A)군과 6시간 동안 처리한 (B)군으로 각각 나누어 관찰하였다. (A) TNF-α의 사이토카인 생성은 ELISA 키트를 통해 측정되었다. (B) TNF-α의 mRNA 발현은 qRT-PCR을 통해 측정되었다. 각 3번의 독립적인 측정을 통해 결과를 비교하였다.
그 결과 TNF-α/IFN-γ로 증가된 TNF-α의 생성은 山白菊 열수추출물의 처리로 유의하게 감소하였으며, 그 중 250㎍/㎖ 농도에서 가장 유의한 감소를 보였다.
mRNA의 발현은 250㎍/㎖, 500㎍/㎖의 농도에서 유의하게 감소하였으며 250㎍/㎖에서 더 많이 감소하였다.
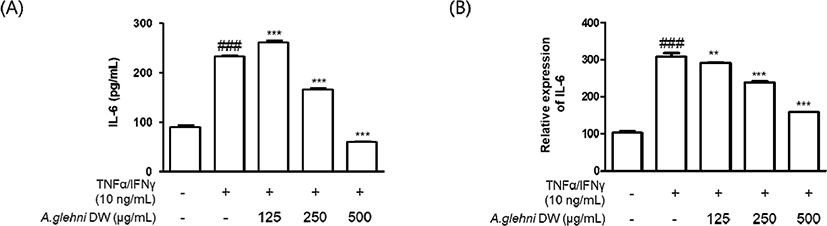
HaCaT 각질형성세포를 山白菊 열수추출물(125㎍/㎖, 250㎍/㎖, 500㎍/㎖)로 1시간 동안 전처리 한 후 TNF-α/IFN-γ(10㎍/㎖)로 (A) 24시간 동안, (B) 6시간 동안 자극하여 IL-6의 생성(량) 및 mRNA 발현을 확인하였다. (A)는 ELISA kit를 사용하였고, (B)는 qRT-PCR 시험법을 사용하였다.
그 결과 TNF-α/IFN-γ로 증가된 IL-6의 생성은 山 白菊 열수추출물의 처리로 250㎍/㎖, 500㎍/㎖의 농도에서 유의하게 감소하였다. 특히 500㎍/㎖ 농도에서는 TNF-α/IFN-γ로 자극하지 않은 대조군에서보다 더 낮은 IL-6의 생성을 나타내었다.
mRNA 발현은 125㎍/㎖, 250㎍/㎖, 500㎍/㎖의 농도에서 농도 의존적으로 유의미하게 감소하였다.
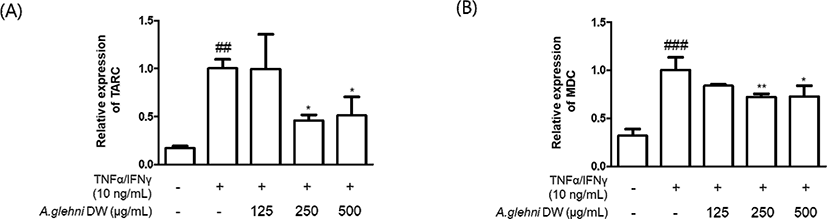
HaCaT 각질형성세포를 山白菊 열수추출물(125㎍/㎖, 250㎍/㎖, 500㎍/㎖)로 1시간 동안 전처리 한 후 TNF-α, IFN-γ(10ng/㎖)로 6시간 동안 자극하여 Th2-chemokine의 mRNA 발현을 확인하였다. (A)에서는 TARC(CCL17), (B)에서는 MDC(CCL22)를 측정하였고, qRT-PCR 시험법을 사용하였다.
그 결과 TNF-α, IFN-γ로 증가된 Th2-chemokine의 mRNA 발현은 山白菊 열수추출물의 처리로 (A) TARC의 경우 250㎍/㎖, 500㎍/㎖의 농도에서 유의미하게 감소하였고, (B) MDC의 경우에도 250㎍/㎖, 500㎍/㎖의 농도에서 유의미하게 감소하였다.
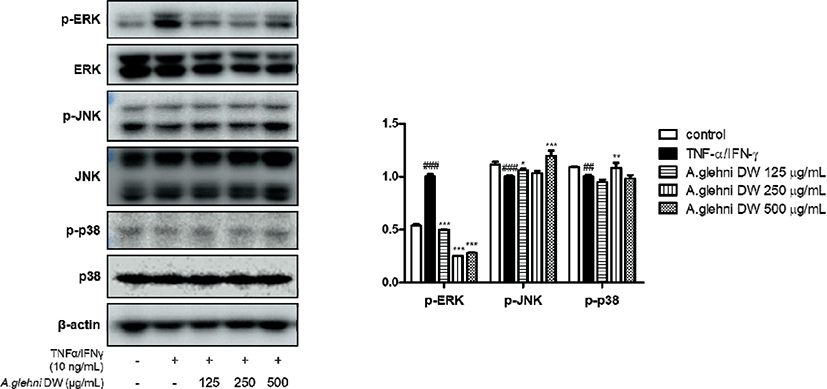
HaCaT 각질형성세포를 山白菊 열수추출물(125㎍/㎖, 250㎍/㎖, 500㎍/㎖)로 1시간 동안 전처리 한 후 TNF-α/IFN-γ(10ng/㎖) 혼합물로 20분 동안 자극한 뒤 단백질을 추출하여 MAPKs의 인산화에 대한 효과를 확인하였다. p-ERK, ERK, p-JNK, JNK, p-p38, p-38, β-actin에 대하여 western blotting analysis를 진행하였다. 그 결과 TNF-α/IFN-γ로 증가된 p-ERK의 단백질 발현은 山白菊 열수추출물의 처리로 유의하게 감소하였다. p-JNK, p-p38의 발현에서는 유의한 결과를 나타내지 않았다.
Ⅳ. 고 찰
피부는 인체와 외부 환경을 구분하는 물리적 장벽으로, 가장 표면층에 해당하는 표피의 80%를 차지하는 피부각질형성세포는 피부각질을 형성하고 외부 환경적 요인에 따라 인체를 보호한다20). 각질형성세포는 전염증성 사이토카인인 Tumor necrosis factor(TNF)-α와 interleukin(IL)-6 을 생산하여 염증 반응과 면역 반응에 관여한다. 그러나 전염증성 사이토카인의 과도한 생성은 세포 증식 속도 감소, 피부 세포 손상, 피부 노화, 아토피 피부염, 건선 등 여러 피부 염증 질환을 발생시키기도 한다21-3).
피부각질형성세포의 전염증성 사이토카인의 과도한 생성으로 인한 질병 중 아토피 피부염(atopic dermatitis, AD)은 유아나 소아기에 주로 발병하는 만성, 재발성 염증성 피부질환이다. 심한 가려움증과 홍반, 부종, 피부건조 등의 증상을 수반하며3,4) 수면장애, 정서불안 등의 증상을 동반한다5,6). 최근 국내 소아, 청소년의 23.3%가 아토피 피부염 의사진단을 받았을 만큼 매우 흔한 질병이다24,25).
아토피 피부염의 대표적인 치료법은 스테로이드 요법 이나 칼시뉴린 억제제와 같은 국소치료제 및 만성 아토피 피부염에 사용하는 사이클로스포린(cyclosporine)과 같은 전신 면역 억제제의 경구 투여 및 광선치료요법 등이 있다. 이러한 요법들은 장기적으로 사용할 경우 부작용의 우려가 있어9,10), 인체 친화적인 생약 성분을 기반으로 한 새로운 치료 물질의 발견의 필요성이 대두되고 있으며, 한약 제제 혹은 천연물 제제를 소재로 하는 새로운 치료방법이 연구되고 있다11,12).
한의약에서 Aster속에 속하는 식물들은 항염증, 항독 효능으로 사용되고 있다. 山白菊 역시 감기로 인한 고열, 가래를 동반한 기침, 뱀이나 벌레 등에 물린 상처 등에 좋은 효능을 갖고 있다14,15). 본 연구는 山白菊이 피부의 각질형성세포에 대해서도 항염증 효능을 나타내는지 연구하였다.
山白菊(Aster glehni)은 여러해살이풀로 울릉도의 양지바른 산지에서 자생하며 국화과 개미취속, 모양은 취나물과 비슷하게 생겼다. 줄기는 100㎝정도의 높이로 자라고 온몸에 잔털이 있어 깔깔하고 잎의 양쪽 면에 잔털이 많고 모양이 참깨잎과 비슷하여 胡麻菜라고도 한다26).
현재까지 山白菊에 관하여 알려진 물질로는 β-amyrin acetate, phytol, alismol, α-tocopheryl, quinone, α-spinasterol, 10-O-methyl-alismoxide, alismoxide, 3-O-[6'-O-palmitoyl-β-D- glucosyl]- spinasta, 7, 22-diene27)과 α-pinene, limonene, δ-elemene, β-pienene, cis-3-hexenol, myrcene 외 25종과 살초활성 물질인 coumarin28)이 있으며, 山白菊은 수분 5.72%, 단백질 29.0%, 지방 3.5%, 조섬유 5.82%로 국내산 산채류 중 단백질 함량이 가장 높은 것으로 보고된다29).
山白菊에 대한 기존 연구에서는 山白菊의 물과 에탄올 추출물을 이용한 실험에서 DPPH와 ABTS+를 이용하여 항산화 활성을 비교 분석하여 山白菊이 항산화 효과와 항비만 효과가 있음을 검증한 바 있고15,16), 주름 개선과 미백에 대한 효과도 연구된 바가 있으며17), 비슷한 식물인 쑥부쟁이(Aster yomena)의 항천식 항염증 효과에 대한 연구가 보고된 바 있다18). 또한, 최근 山白菊이 LPS로 유도된 RAW 264.7 대식세포에서 NO, iNOS, COX-2 및 p-ERK, p-p38, p-JNK의 활성을 억제하여 항염증 작용함이 연구되었다19). 이에 본 연구에서는 山白菊이 인체 피부각질세포에서 염증성 사이토카인인 IL-6, TNF-α의 생성량과 mRNA 발현량을 줄이는지 확인하였다. 염증성 사이토카인은 세균이나 바이러스 감염, 조직 손상 등에 의한 염증 반응에 관여하는 사이토카인으로, IL-1, IL-6, TNF-α 등이 이에 해당한다30). 사이토카인으로 인해 염증 반응이 유도되면 인체는 체온을 올리고 병원성 물질을 죽여 고름을 만드는 등의 면역 반응을 일으킨다7). 따라서 사람 피부각질형성세포에서 山白菊의 열수추출물이 TNF-α, IL-6 등의 염증성 사이토카인의 생성을 억제시킨다면 아토피 피부염의 치료제로 사용할 수 있는 가능성을 나타내는 것이기 때문에 지표로 선정하였다. 실험 결과 山白菊 열수추출물은 TNF-α와 IL-6의 생성 및 mRNA의 발현을 유의하게 감소시켰다.
Chemokine이란 주화성 사이토카인이라고도 하며 화학주성을 유발하는 세포분비물이다18). 아토피 피부염을 유발하는 주요 인자로, 백혈구 유주능을 활성화시켜 상처, 감염이 발생한 조직으로 백혈구를 이동할 수 있도록 자극한다. 본 실험에서 사용된 지표 중 TARC와 MDC는 체액성 면역에 관여하는 Th2-chemokine12)에 속하며, 염증 부위로 Th-2 세포의 이동과 침윤을 유도한다. 실험 결과 山白菊의 열수추출물이 TARC와 MDC의 mRNA 발현을 유의미하게 감소시키는 것을 확인하였다.
MAPKs 인산화반응은 세포의 증식, 분화, 세포 자멸에 중추적인 기능을 하며, 상위 단계의 인산화 효소가 하위 단계의 인산화 효소에 인산 그룹을 전달하여 생성되는 신호전달체계이다32-4). 이 과정에서 p-JNK(Jun N-terminal Kinase), JNK, p-ERK(Extra-signal Response Kinase), ERK, p38 kinase, p-p38, p-38, β-actin 등은 세포의 소멸에 관여하여 염증 반응을 일으키는 주요 물질이 되므로, 지표로 선정하고 실험을 진행하였다. 실험 결과 山白菊 열수추출물은 p-ERK의 mRNA 발현을 유의미하게 감소시켰다.
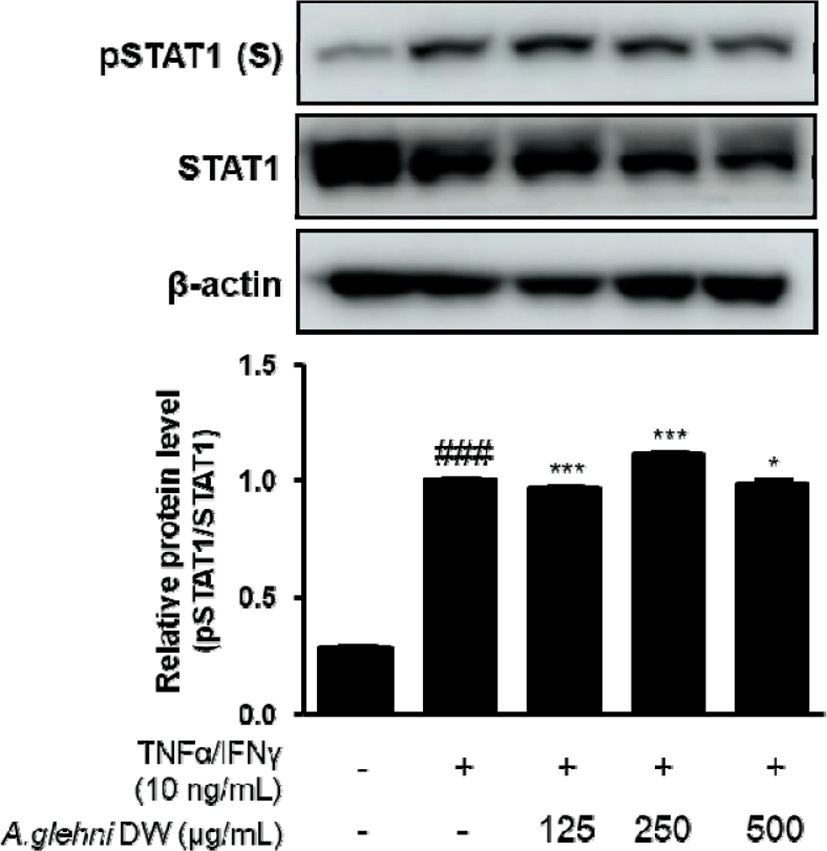
STAT(Signal transducer and activator of transcription)은 신호변환자-전사활성자라고도 하며 1, 2, 3, 4, 5a, 5b, 6로 구성된다. STAT은 세포질에 있는 전사 조절자로서 세포 외부로부터의 자극, 특히 성장호르몬이나 다양한 사이토카인에 의해 기능이 제어된다7). 인체 세포의 사멸과 관여하는 STAT1이 본 연구에서 지표의 하나로 선정되었고, 山白菊 열수추출물은 p-STAT1 단백질 발현을 유의미하게 감소시켰다.
이상의 결과는 山白菊 열수추출물이 TNF-α/IFN-γ로 자극된 HaCaT 각질형성세포에서 생성된 염증 인자들의 발현을 MAPKs 인산화 과정에서 p-ERK 단백질 발현을 억제하는 방법으로 감소시켜 항염증 효과를 가질 수 있다는 것을 보여준다. 또한 이 연구는 山白菊이 항염증 치료 물질 개발에 응용될 수 있음을 보여준다. 하지만 실제 치료제로서 개발이 진행되기 위해 추후 추가적인 관련 연구들이 필요할 것으로 보인다.
Ⅴ. 결 론
HaCaT 각질형성세포를 TNF-α, IFN-γ로 자극하였을 때 山白菊 열수추출물의 피부 염증완화 효과를 연구하여 다음과 같은 결론을 얻었다.
-
山白菊 열수추출물은 15,625-1,000㎍/㎖의 농도에서 세포 독성을 나타내지 않았다.
-
山白菊 열수추출물은 TNF-α, IFN-γ로 증가된 HaCaT 각질형성세포의 TNF-α, IL-6 생성과 mRNA 발현을 유의하게 감소시켰다.
-
山白菊 열수추출물은 TNF-α, IFN-γ로 증가된 HaCaT 각질형성세포의 Th2-chemokine mRNA 발현을 유의하게 감소시켰다.
-
山白菊 열수추출물은 TNF-α, IFN-γ로 증가된 HaCaT 각질형성세포의 p-ERK, p-STAT1의 단백질 발현을 유의하게 감소시켰다.
위의 결과를 종합해 보았을 때, 山白菊 열수추출물은 HaCaT 각질형성세포에서 TNF-α, IL-6, Th2- chemokine(TARC, MDC)과 MAPKs 중 ERK의 인산화와 p-STAT1의 활성을 억제함으로써 피부 염증완화 효과가 있음을 확인하였다.






