Ⅰ. 서 론
염증반응이란 생체의 조직이나 세포가 손상을 받으면 면역세포가 이를 인지하여 다양한 염증매개물질을 분비함으로써 생체를 보호하는 기전이다1,2). Lipopoly- saccharide(LPS)는 대식세포의 감염 초기에 반응하며, 숙주를 방어하는 그람 음성균의 외막 성분이다. 그러나 과도한 LPS 자극은 대식세포에서 interleukin-6(IL-6), nitric oxide(NO) 등을 분비시킨다3,4). 염증반응을 유발하는 nitric oxide synthase2(NOS2), cyclooxygenase -2 (COX-2), cytokines의 발현은 전사인자인 nuclear factor-κB(NF-κB)에 의해 조절이 된다고 알려져 있다5).
肉蓯蓉(Cistanche deserticola)은 열당과(列當科 : Orobanchaceae)에 속한 다년생 육질의 기생초본인 육종용, 염생육종용 및 동속 근연식물의 육질경이다6,7). 肉蓯蓉은 補陽藥에 속하며, 성미가 微溫하고 甘酸醎하고 독성이 없으며, 補腎陽, 益精血하는 효능이 있어 주로 五勞와 七傷에 쓰였으며, 莖中寒熱痛, 男絶陽不興, 遺精, 血尿, 遺尿와 女絶陰不産, 帶下, 陰痛을 치료한다고 하였다8,9). 선행 연구에서 연구된 肉蓯蓉의 효능으로는 補陽, 補腎, 신경세포 보호, 항산화, 진통, 진정 작용, elastase, colagenase and hyaluronidase의 억제 효과, 테스토스테론 생성 증가, 정자 보호, 세포 증식 촉진, 세포 생존율 증가, 기억력 증진, 항노화, 자유 라디칼 제거, 신경보호 등이 보고되었다10-9). 또한 肉蓯蓉에서 추출된 개별 성분들이 항산화, 항염증, 혹은 그 작용의 중간 단계를 매개하는 작용을 한다는 연구들도 있다20-43). 만성 간염이나 암과 같은 소모성 질환 및 만성 염증성 장질환 등의 만성 염증성 질환은 급성 질환에 비하여 이환기간 및 치료기간이 길며, 영양을 보충하면서도 염증을 치료해야 한다. 이러한 상황에서는 淸熱藥을 장기적으로 투여하기 어렵기 때문에 항염증 효능을 가진 補陽藥, 補陰藥 등의 補益藥의 사용을 고려해볼 수 있다. 따라서 저자는 補陽藥에 속하여 補腎陽하면서도 益精血 潤腸通便하는 효능이 있어 陰陽을 모두 補할 수 있는 肉蓯蓉7)을 만성 소모성 질환 및 만성 염증성 질환에 응용할 수 있을 것이라 생각하여 본 연구를 진행하였다.
肉蓯蓉의 항염증 효능에 대한 기전 연구는 미비한 실정이다. 본 연구에서는 肉蓯蓉의 염증성 질환에 대한 효과와 그 기전을 확인하기 위하여 肉蓯蓉 열수추출물(CDWE)을 RAW 264.7 세포에 전처리한 후, CDWE가 염증반응의 주요 신호전달 분자인 NF-κB의 활성을 차단하여 염증매개물질에 대한 염증반응을 억제할 수 있는지, 그리고 CDWE가 LPS로 유도한 NO 생성, NOS2와 COX-2 단백질의 발현, IL-6와 같은 염증성 cytokine 생성에 어떤 영향을 미치는지 관찰하였다.
Ⅱ. 재료 및 방법
Dulbecco’s modified Eagle’s medium(DMEM), fetal bovine serum(FBS), penicillin, and streptomycin을 Life Technologies Inc. Grand Island, NY, USA)에서 구입하여 사용하였다. 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT), N6-(1-Iminoethyl)lysin(NIL)은 Tokyo Chemical Industry Co.(Tokyo, Japan)과 Sigma Chemical Co.(St. Louis, MO, USA)에서 각각 구입하였다. 또한 Dimethyl sulfoxide(DMSO)는 Junsei Chemical Co. Ltd.(Tokyo, Japan)에서 구입하였다. cytokine 생성 확인을 위한 mouse IL-6 Enzyme-linked immunosorbent assay(ELISA) 분석을 위해 kit를 구입하였다(BD OptEIATM, BD Science, San Jose, CA, USA). 단백질 발현을 확인하기 위한 NOS2, Cox-2, IκB-α, β-actin 등의 1차 항체들은 Santa Cruz Biotechnology, Inc.(Dallas, TX, USA)에서 구입하였고 p-IκB-α, NF-κB p65, PARP 등의 1차 항체들은 Cell Signaling Technology, Inc.(Danvers, MA, USA) 에서 구입하였다. Horseradish peroxidase-conjugated secondary antibodies는 Jackson Immuno Research laboratories, Inc.(West Grove, PA, USA)에서 구입하였다.
肉蓯蓉은 전라남도 여수시 ㈜신흥제약으로 부터 구입하여 사용하였다. 肉蓯蓉 100g의 중량을 측정한 뒤 증류수 1ℓ와 함께 넣은 뒤 탕액이 끓는 시점으로부터 2시간 동안 가열하여 추출한 다음 추출액을 filter paper로 감압 여과하였다. 그 다음 추출액을 동결건조기(FDU-1200, EYELA, Tokyo, Japan)를 이용하여 건조한 분말을 시료로 사용하였다. 수득율은 27.5%였다.
마우스로부터 유래된 대식세포주인 Raw 264.7 세포는 한국세포주 은행(Seoul, Republic of Korea)에서 분양받아 사용하였다. RAW 264.7 세포는 10% FBS(Gibco, Big Cabin, OK, USA)와 1% penicillin/streptomycin(Hyclone, Logan, UT, USA)이 포함된 DMEM(Dulbecco’s Modified Eagle Medium) 배지를 사용하여 37℃, 5% CO2 조건에서 배양하였다.
RAW 264.7 세포에 대한 CDWE의 세포생존율을 평가하기 위해 MTT assay를 실시하였다. Raw 264.7 세포를 96 well plate에 1×105cells/㎖의 밀도로 seeding하고, 24시간 동안 37℃, 5% CO2 incubator에서 배양한 후, 다양한 농도의 CDWE를 세포에 처리하였다. 24시간 이후 3-(4, 5-Dimethylthiazol- 2-yl)-2, 5-diphenyl tetrazolium bromide(MTT) 용액을 처리하였으며, 4시간 후 상등액을 제거하고 dimethyl sulfoxide(DMSO)을 이용하여 비수용성 formazan product을 용해하였다. 세포 생존율은 Epoch® microvolume spectrophotometer system(BioTek Instruments Inc., Winooski, VT, USA)을 이용하여 540㎚ 파장대에서 측정하였다.
RAW 264.7 세포를 24 well plate에 1×105cells/㎖의 밀도로 seeding하고, 24시간 동안 37℃, 5% CO2 incubator에서 배양하였다. RAW 264.7 세포에 다양한 농도의 CDWE를 1시간 동안 전처리한 후, 1㎍/㎖의 LPS를 처리하여 48시간 동안 배양시킨 후 배양 상등액을 분리하였다. 그 다음 배양 상등액을 96 well plate에 옮겨준 후, 동량의 Griess 시약을 처리하여 실온에서 반응시킨 후 540㎚ 흡광도에서 측정하였다.
RAW 264.7 세포를 6 well plate에 4×105의 밀도로 seeding하고, 24시간 동안 37℃, 5% CO2 incubator에서 배양하였다. RAW 264.7 세포에 250, 500, 1,000㎍/㎖의 CDWE를 1시간 동안 전처리한 후, 1㎍/㎖의 LPS를 처리하여 24시간 동안 배양시켰다. 분리된 배양 상등액 내 IL-6 농도는 ELISA kit를 이용하여 540㎚ 파장대에서 측정하였다.
배양이 끝난 세포를 수집하여 2-3회 PBS (phosphate buffered saline)로 세척한 후 Pro-prep®(iNtRON biotechnology Inc, 경기도) 용액을 사용하여 RAW 264.7 세포로부터 단백질을 추출하였다. 분리된 단백질을 20-30㎍ 양으로 정량한 뒤 8–12% gel을 이용하여 전기영동을 실시하고 단백질 크기별로 분리하였다. Gel로부터 단백질을 polyviny- lidine fluoride(PVDF) membrane으로 이동시킨 뒤, 2.5-5% skim milk로 배양한 후 특정 단백질 검출을 위한 1차 항체를 사용하여 4℃에서 overnight하였다. 하룻밤이 지난 뒤 tween 20/tris-buffered saline (T/TBS)으로 충분히 세척하고 2차 항체를 이용하여 상온에서 2시간 반응시켰다. 반응이 끝난 후 T/TBS로 충분히 세척하고 형광시약을 넣어 감광작업을 진행하여 특정 단백질의 양을 분석하였다.
Ⅲ. 결 과
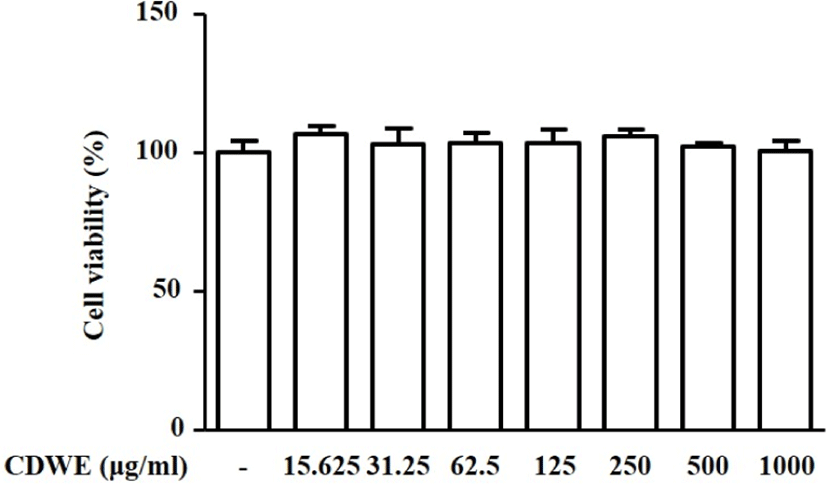
CDWE를 각각 15.625, 31.25, 62.5, 125, 250, 500, 1,000㎍/㎖의 농도로 처리한 RAW 264.7 세포의 생존율을 MTT assay로 확인해 본 결과 각각 106.54 ±2.97, 103.04±5.68, 103.38±3.58, 103.44± 4.79, 105.73±2.73, 102.15±1.39, 100.36±3.98%로 나타났다. RAW 264.7 세포에서 CDWE는 15.625~1,000㎍/㎖의 농도범위 내 세포 독성이 없음 을 확인하였다(Fig. 1).
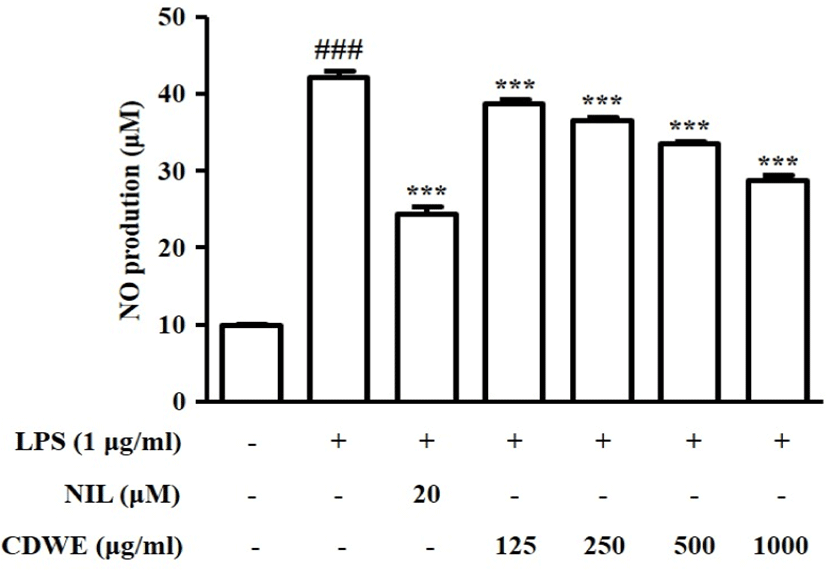
LPS로 유도된 RAW 264.7 세포에서 CDWE의 NO 생성 저해능을 관찰하기 위하여 CDWE를 125, 250, 500, 1,000㎍/㎖의 농도로 세포에 처리한 후 생성되는 NO의 양을 측정하였다.
LPS군에서는 NO의 생성량이 42.14±0.85μM으로 Control군(9.95±0.10μM)에 비교하여 유의하게 증가하였다. NO 저해제인 N6-(1-Iminoethyl)lysin(NIL)을 처리한 군에서는 NO의 생성량이 24.14±0.85μM으로 유의하게 감소하였다. CDWE를 125, 250, 500, 1,000㎍/㎖의 농도로 전처리한 군에서의 NO 생성량은 각각 38.79±0.49, 36.58±0.50, 33.616±0.19, 28.92±0.53μM으로 LPS 자극에 의해 증가한 NO 생성량이 CDWE 처리에 의해 농도 의존적으로 감소되었음을 확인하였다(Fig. 2).
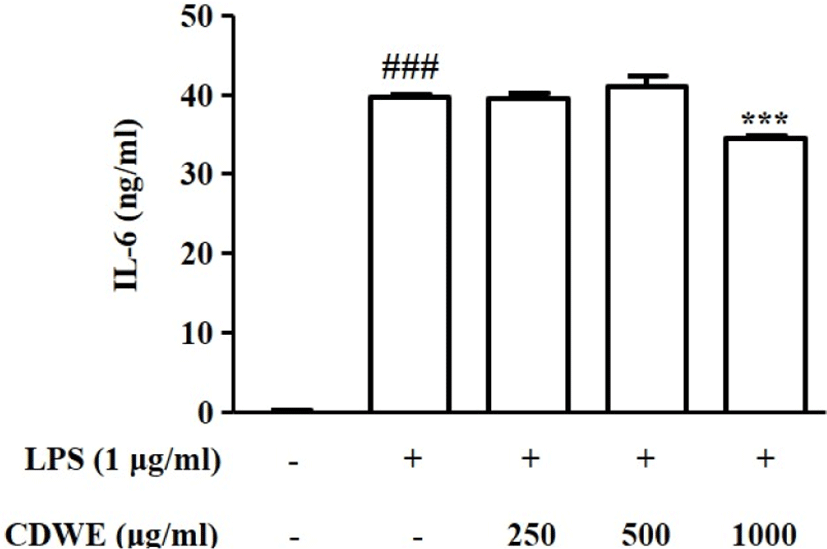
CDWE가 IL-6의 억제에 미치는 영향을 확인하기 위하여 250, 500, 1,000㎍/㎖의 농도의 CDWE를 1시간 동안 전처리한 후 LPS를 처리하여 IL-6의 생성량을 측정하였다.
IL-6는 LPS 처리에 의해 39018±369ng/㎖으로 유의하게 증가하였다. 반면, CDWE 250, 500, 1,000㎍/㎖의 전처리군의 IL-6의 생성량은 각각 3,8856±548, 40,333±1,389, 33,819±229ng/㎖으로, CDWE 1,000㎍/㎖에서 LPS 단독 처리군에 비해 유의하게 감소하였다(Fig. 3).
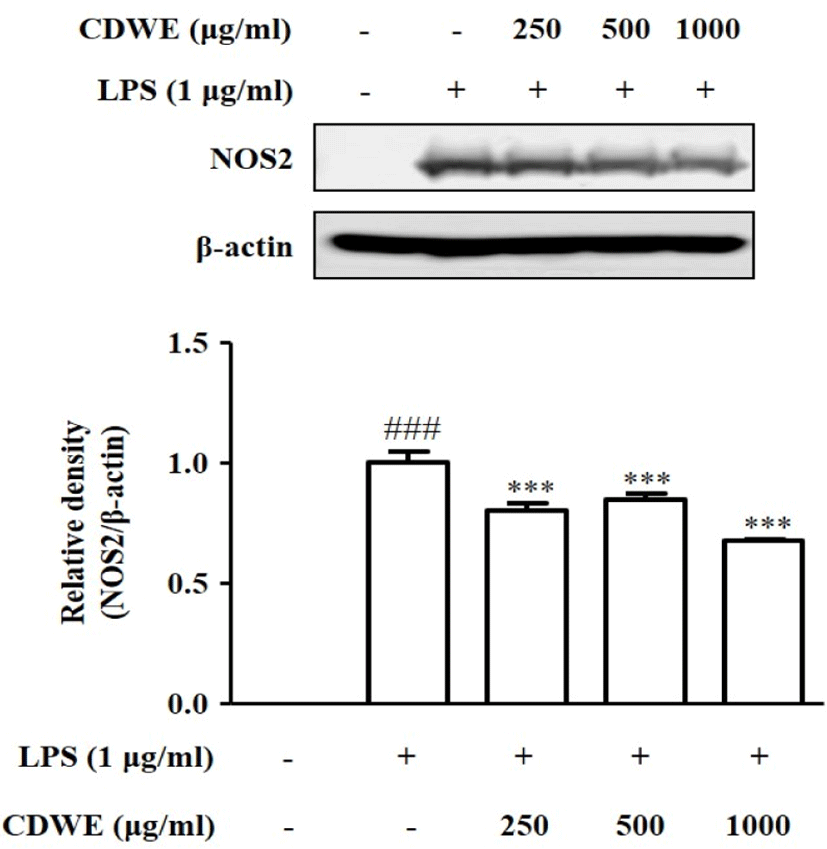
NO 생성 저해에 관한 NOS2의 관련성을 관찰하기 위하여 Western blot을 통해 NOS2의 발현을 조사하였다. CDWE 250, 500, 1,000㎍/㎖ 농도가 NO의 생성을 유의하게 억제한 것이 CDWE의 NOS2 조절과 관 계가 있는지 확인하기 위하여, CDWE 250, 500, 1,000㎍/㎖의 농도로 1시간 처리한 후 RAW 264.7 세포에 LPS를 처리하여 NOS2 수준을 측정하였다.
LPS 단독 처리 결과를 1±0.048로 하였을 때, CDWE 250, 500, 1,000㎍/㎖의 농도에서 각각 0.80±0.031, 0.85±0.025, 0.68±0.008으로 통계적으로 유의하게 감소하였다(Fig. 4). 이를 통해 CDWE가 NO 생성을 억제하는 것은 CDWE의 NOS2 발현 억제와 관련이 있음을 확인할 수 있었다.
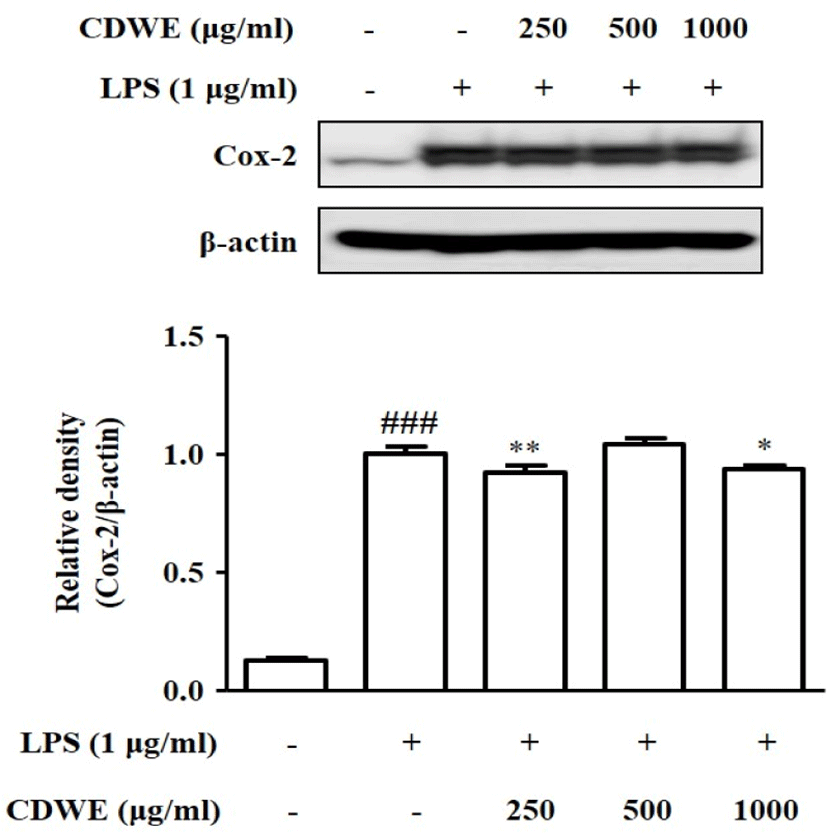
Western blot을 통해 염증 매개 단백질인 COX-2를 측정하였다. LPS 처리군을 1±0.032라고 놓을 때, control군은 0.13±0.006의 수치를 보였고, CDWE 250, 500, 1,000㎍/㎖의 농도에서 각각 0.92±0.027, 1.04±0.026, 0.94±0.017이라는 수치를 기록했으며, 이중 CDWE 250과 1,000㎍/㎖의 농도에서 통계적으로 유의한 감소를 보였다(Fig. 5).
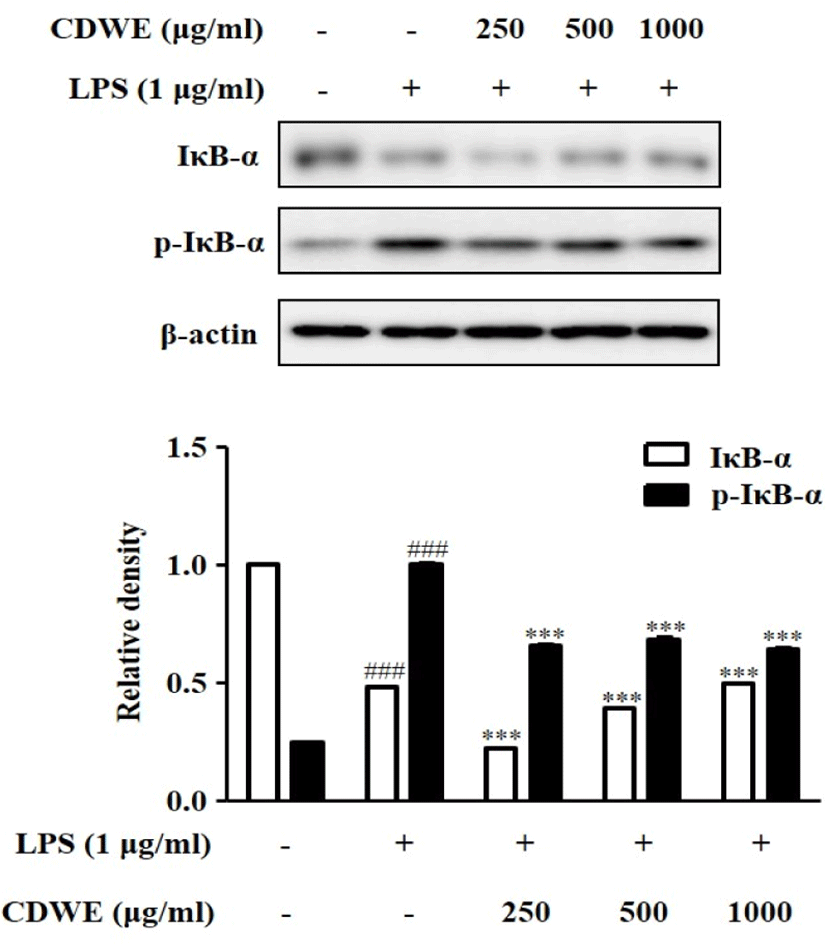
Western blot을 통해 염증반응에 관여하는 IκB-α와 IκB-α의 인산화 형태인 p-IκB-α의 단백질 발현 정도를 관찰하였다. IκB-α의 발현은 Control군이 1±0.001일 때 LPS에 의하여 0.48±0.001로 감소하였고, 250, 500, 1,000㎍/㎖의 CDWE 전처리에 의한 IκB-α의 발현은 각각 0.22±0.001, 0.39±0.001, 0.49±0.002로 250, 500㎍/㎖에서 LPS 처리군에 비 해 감소하였으나 농도 의존적으로 증가하는 경향을 보였다. p-IκB-α의 발현은 Control군이 0.25±0.001일 때 LPS에 의하여 1±0.003로 증가하였고, 250, 500, 1000㎍/㎖의 CDWE 전처리에 의한 p-IκB-α의 발현은 각각 0.65±0.007, 0.68±0.008, 0.64±0.005로 유의미하게 감소하였다(Fig. 6).
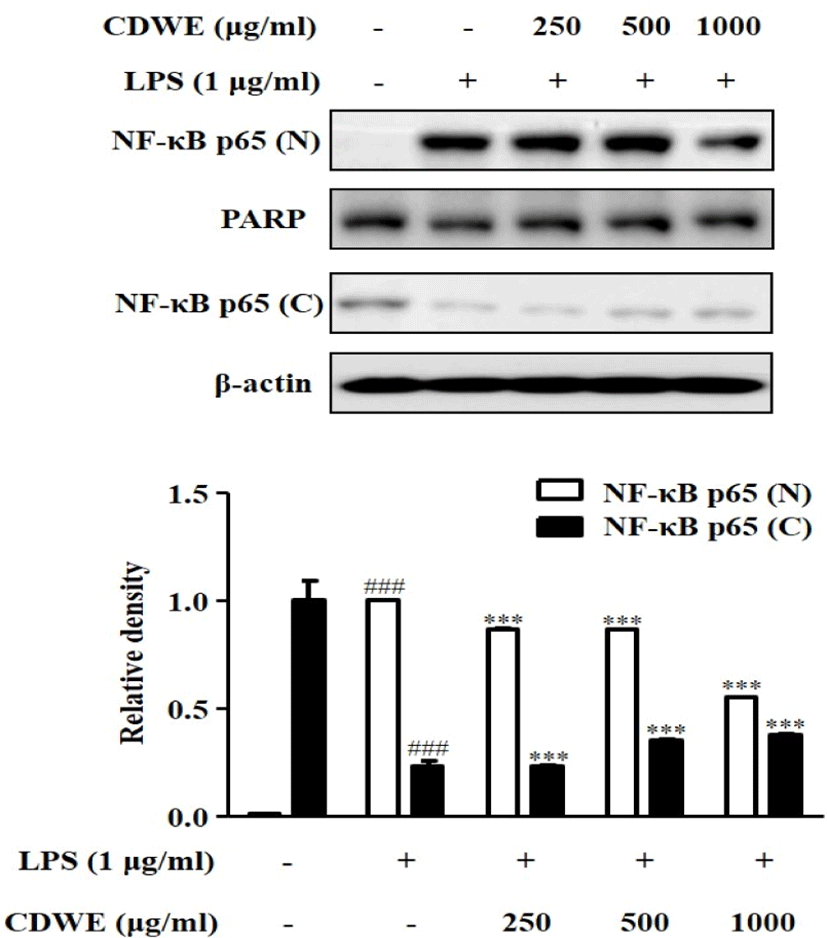
Nuclear에서 측정한 NF-κB p65(N)의 경우 LPS에 의해 증가한 정도가 1±0.002일 때, CDWE를 250, 500, 1,000㎍/㎖ 전처리한 군에서 각각 0.87±001, 0.87±002, 0.55±0.000으로 유의미하게 감소하였다.
Cytosol에서 측정한 NF-κB p65(C)의 경우 LPS에 의해 0.23±0.03으로 감소하였는데, CDWE를 500, 1,000㎍/㎖ 전처리한 군에서 각각 0.35±0.01, 0.38±0.01으로 유의미하게 증가하였다(Fig. 7). 이러한 결과는 대식세포에서 LPS에 의해 활성화되는 NF-κB 신호 네트워크를 CDWE로 억제할 수 있음을 보여준다.
Ⅳ. 고 찰
肉蓯蓉은 益精血, 補腎陽, 潤腸通便하는 효능이 있어, 陽痿, 不孕, 腰膝酸軟, 筋骨無力, 腸燥便秘를 치료한다. 滋養精血하고 補腎壯陽하는 효능으로 精血不足 및 腎虛陽痿으로 인한 不孕에 사용할 수 있고, 甘溫質潤한 성질로 인해 燥烈하지 않아 潤燥滑腸하고 溫養精血하는 효능이 있어 노인이나 허약자의 津枯便秘가 陽虛를 겸할 때 사용할 수 있으며, 溫腎補陽하므로 淫羊藿과 배오되어 陽痿치료의 主藥이 된다8). 최근 肉蓯蓉에 대한 연구에서 補陽, 補腎, 신경세포 보호, 항산화, 진통, 진정 작용 등의 효과가 보고되었다10-4).
肉蓯蓉은 補陽藥에 속하여 상기 효능들 위주로 연구되었으나, 항염증 효과에 대한 가능성을 보여준 연구들이 있다. 현재까지 肉蓯蓉에 함유된 성분들에 대한 연구가 각각 진행되었는데, 여러 성분들 중 acteoside는 암세포에 대하여 세포독성을 보였고, 항산화, 항염, 세포사멸 억제 작용이 있으며, 이전부터 식물에 존재하는 acteoside를 포함하는 phenylpropanoid 화합물은 염증과 관련된 질병의 치료에 사용되었다고 알려져 있다23-6). 2-acetylacteoside 항염, 항산화, 신경 보호, 간 보호, 면역 증진 및 항노화 작용 등이 있다고 보고되었다27,28). Betaine은 TNF-α, IL-6, COX-2, NOS2의 발현을 억제하여 항염증 효과를 나타냈다고 보고되었다29). Echinacoside는 신경보호, 간보호, 세포자연사의 억제, 항노화 및 면역조절 작용 등이 있음이 보고되었다30-4). Liriodendrin은 간보호, 진통, 항염증 효과 등이 있다는 것이 보고되었다35,36). N, N-Dimethyl- glycine은 호모시스테인과 글루타치온 합성에 관여하며 항산화 작용이 있는 것으로 보고 되었다37-9). Triacontanol은 COX-2와 VEGF(vascular endothelial growth factor)를 억제하여 암세포의 전이 및 확산을 억제할 수 있다고 보고되었다40). β-sitosterol은 항바이러스, 항염증, 항암 효과 등이 있다고 보고되었다41-3). 특히 항염 효능과 관련하여서는, acteoside, 2-acetylacteoside는 LPS로 자극된 J774.1 대식세포에서 NO 생성을 저해하였고44), betaine은 AOM/DSS로 자극하여 대장암을 유발한 mouse model에서 TNF-α, IL-6, iNOS, COX-2 발현을 억제하였고, LPS로 자극된 RAW 264.7 cell에서 NF-κB, p50, NF-κB p65, COX-2, iNOS를 감소시키는 효과를 보였다29). 또한, Echinacoside는 IEC-6 cells에서 LPS로 유도된 TNF-α, IL-6의 발현을 억제하고 IL-10, TGF-β1의 발현은 증가시키며, mTOR/STAT3 pathway를 비활성화하여 항염효과를 나타냈으며45), Liriodendrin 가수분해물은 대식세포에서 LPS에 의하여 유도된 NO, PGE2, TNF-α의 생성을 억제하였고, iNOS, COX-2 또한 감소시켜 항염 작용을 함이 연구되었다36). N, N-Dimethylglycine은 mouse model에서 궤양의 개수, 크기 및 지표를 감소시켰으며, glutathione 수치 또한 유의미하게 낮추어 항산화 및 항염 작용의 가능성을 제시하였다39). Triacontanol은 누드마우스모델에서 COX-2, VEGF 생성을 억제하였고40), β-sitosterol은 LPS로 인한 NO의 생성을 억제하여 항염 작용이 있음이 연구된 바 있다42). 이러한 연구들을 종합하면 肉蓯蓉의 개별 성분은 항산화, 항염증 효능, 혹은 그 작용의 중간 단계를 매개하는 작용을 한다. 본 연구는 RAW 대식세포에서 LPS에 의하여 유도되는 염증관련 지표들인 NO, NOS2, IL-6, COX-2, p-IκB-α, NF-κB에 肉蓯蓉 열수추출물(CDWE)이 미치는 영향을 평가하여, 肉蓯蓉의 항염증 효능과 기전을 알아보고자 하였다.
NO는 혈관확장, 면역조절, 신경전달체계 등 생체 내 작용에 관여하여 염증반응을 조절하는 인자로, 세포내에서 2차 전달자로서 중요한 역할을 담당한다. NO는 혈관 및 근육의 이완 조절에 관여하는 면역계 방어물질이나, 병리적으로 조직 손상이나 감염으로 인한 염증반응을 매개하는 인자로 작용하기도 한다46). 과도하게 생성된 NO는 조직손상이나 세포독성 등 염증반응을 촉진함은 물론 IL-6, TNF-α 등의 전염증성 cytokine 과 COX-2 등의 염증 매개물질들의 생합성을 촉진하여 과도한 면역반응을 일으키고 다양한 질병을 초래한다47). 따라서, NO의 발생을 억제하는 것이 염증반응의 억제와 치료에 중요하다48).
RAW 264.7 세포에서 CDWE의 NO 생성 저해 정도를 관찰하기 위해 CDWE를 125, 250, 500, 1,000㎍/㎖의 농도로 세포에 전처리하여 생성되는 NO의 양을 측정하였다. 24시간의 LPS는 NO 생성량을 유의하게 증가시켰으며, CDWE는 LPS에 의해 증가된 NO 생성을 유의하게 저해하였다(Fig. 2). LPS로 유도된 NO 생성의 감소가 세포독성에 의한 것은 아닌지 평가하기 위하여 MTT assay를 실시한 결과 CDWE에 의한 세포 독성은 관찰할 수 없었다(Fig. 1).
IL-6과 같은 전염증성 cytokine은 다양한 염증매개체들의 유도와 면역반응의 조절 과정에서 중요한 역할을 한다. 이런 전염증성 인자들은 면역세포를 활성화하여 세균의 침입에 효과적으로 방어하도록 한다49). 특히 IL-6는 대식세포, T cell 등에서 주로 분비되고 B cell을 활성화하여 항체의 생성을 촉진하며, 면역반응, 숙주방어, 신경세포의 기능 등에서 중요한 역할을 한다50-2). 또한 IL-6는 염증성 질환에서 주요 역할을 하며, 패혈증과 같은 염증성 질환이 생겼을 때 장기로 유입되어 장기 손상이나 부전을 일으킨다고 보고되었다49). 이런 염증성 cytokine을 조절하면 염증반응으로 유도된 다양한 질병을 조절할 수 있음을 알 수 있다. 본 연구에서 LPS는 IL-6의 생성을 유의하게 증가시켰으며, CDWE 1,000㎍/㎖에서 LPS로 유도된 IL-6의 생성을 유의하게 감소시켰다(Fig. 3).
NOS는 크게 cNOS와 NOS2(iNOS) 두 가지로 분류된다. 이 중 NOS2는 면역독성에 관여하여 LPS, IL-1, TNF-α, interferon-γ(IFN-γ) 등의 다양한 자극에 의해 활성화되며, 대식세포, 혈관평활근세포, 간세포, 심근세포 등에서 다량의 NO를 장시간에 걸쳐 생성하는 것으로 알려져 있다53). 본 연구에서는 CDWE에 의한 NO 생성 저해가 NO 생성에 관여하는 NOS2의 발현조절에 따른 것인지 평가하기 위하여 NOS2를 관찰하였다.
COX는 prostaglandins, prostacyclin, throm-boxanes 등의 prostanoids의 형성에 관여하는 속도조절 단계 효소로, COX-1과 COX-2가 있다. COX-1은 항상성을 조절하기 위한 prostaglandin의 합성에 관여한다. 반면에 COX-2는 염증반응을 매개하는 pros- taglandin의 합성에 관여하여, 정상 상태에서 발현하지는 않으며, PGE₂를 생성하여 혈관 확장, 발열 등을 유발하는 대표적인 염증 지표물질이다54,55). 따라서 이러한 COX-2 선택적 저해제의 개발은 염증 치료제 개발의 주요 목표가 되고 있다.
NF-κB는 정상 환경에서 불활성화된 상태로 저해 단백질인 IκB-α와 복합체의 형태로 존재한다. 염증신호를 포함한 외부자극은 I-κB kinase를 활성화시켜 IκB-α를 인산화한다. NF-κB/IκB-α복합체에서 IκB-α가 분해되면 NF-κB는 세포질에서 유리되어 핵으로 이동하여 NOS2, COX-2 등의 전사를 유도한다56,57).
본 연구에서는 앞서 나타난 NO와 cytokines의 억제 효과가 어떤 기전에서 작용하여 나타나는지 알아보기 위하여 NOS2, COX-2, p-IκB-α, NF-κB의 발현 억제 효과를 측정하였다. RAW 264.7 세포에 CDWE를 250, 500, 1,000㎍/㎖ 농도로 각각 전처리하고 Western blot을 통해 LPS에 의한 NOS2, COX-2, p-IκB-α, NF-κB p65(N) 단백질 발현 증가에 대한 억제 효과를 관찰하였다. NOS2 발현량은 CDWE. 250, 500, 1,000㎍/㎖의 농도에서 유의하게 감소하였고, COX-2의 발현량은 CDWE 250과 1,000㎍/㎖의 농도에서 유의하게 감소하였으며, p-IκB-α의 발현량은 CDWE 250, 500, 1,000㎍/㎖의 농도에서 유의하게 감소하였고, NF-κB p65(N)의 발현량은 CDWE 250, 500, 1,000㎍/㎖의 농도에서 유의하게 감소하였다(Fig. 4-7).
이러한 결과를 종합해볼 때, CDWE가 LPS에 의해 유도된 염증반응에서 NF-κB의 활성화를 억제하고, 그에 따라 NOS2와 COX-2의 발현을 억제함으로 NO와 cytokine의 분비를 효과적으로 저해한 것으로 보인다. 그러나 저용량보다 고용량에서 유의미한 효과를 보여준 지표가 있었고, 肉蓯蓉이 補益藥에 속하면서 항염 작용이 있는 것을 고려할 때, 급성 염증보다는 만성 염증성 질환이나 소모성 질환에 응용될 수 있다고 생각된다. 또한, 肉蓯蓉의 성분 중 PhGs에 속하는 cistanoside A에 대한 연구에서 ovariectomized(OVX) mice model에서 TRAF6는 감소되고, NF-κB가 억제되었으며 PI3K/Akt pathways는 활성화되어, OPG/RANKL ratio를 증가시켜 골형성에 도움이 될 수 있는 연구가 시행되었다58). 이는 肉蓯蓉의 개별 성분이 항염 작용을 함과 동시에 補骨하여, 만성 염증성 질환 및 소모성 질환에서 나타날 수 있는 골다공증과 같은 치료에 응용될 수 있을 가능성을 제시한다. 본 연구는 추후 肉蓯蓉 의 다른 항염증 기전이나 급성, 만성 염증에 대한 효과를 비교하는 연구의 토대가 될 수 있을 것이다.
Ⅴ. 결 론
본 연구는 RAW 264.7 대식세포를 이용하여 LPS에 의해 활성화된 염증 매개 물질과 관련 신호 네트워크의 변화에 肉蓯蓉 열수추출물이 미치는 영향을 평가하여 다음과 같은 결과를 얻었다.
-
CDWE는 RAW 264.7 대식세포에서 세포독성을 관찰한 결과 실험에 사용한 250-1,000㎍/㎖의 농도에서 세포 독성은 관찰되지 않았다.
-
NO 생성을 측정한 결과 CDWE는 LPS에 의해 증가된 NO 생성을 농도 의존적으로 억제하였다.
-
LPS에 의하여 증가된 NOS2, IL-6의 발현 또한 감소시켰다.
-
CDWE는 LPS에 의해 증가한 COX-2, p-IκB-α, NF-κB의 발현을 유의하게 감소시켰다.
결론적으로 CDWE는 IκB-α의 인산화를 억제하며, NF-κB의 핵으로의 이동을 억제함으로 항염증효과를 나타냈다. 이러한 CDWE의 항염증 효능은 肉蓯蓉을 활용한 염증성 질환의 예방과 약물 개발 가능성을 보여준다.






