Ⅰ. 서 론
최근 생활환경 및 식습관의 변화로 인해 전 세계적으로 고혈압 및 혈관성 질환, 당뇨병, 암, 비만 등의 질병이 차지하는 비율이 매년 증가하고 있다. 이와 더불어 급격한 환경변화 및 이에 따른 스트레스 증가 등 다양한 요인들로 인하여, 면역 조절 이상으로 염증이 유발되고 지속되어 다양한 질환들이 증가하고 있다1).
염증반응은 물리적, 화학적 자극에 의해서 활성화되는 생체의 필수적인 방어 작용이다2,3). 그러나 과도한 염증반응은 관절염, 다발성 경화증, 또는 암과 같은 질병을 유발한다4,5). 이러한 과도한 염증 반응을 억제하기 위해 기존에 이용하던 합성 항염증제 같은 경우, 과량으로 사용했을 때 위궤양, 위염 및 심혈관질환 등의 부작용을 일으키므로 염증 반응을 완화시킬 수 있는 천연 소재에 대한 연구가 활발하게 진행되고 있다6,7).
山白菊(Aster glehni)은 국화과(Composiae) 다년생 본초로 뿌리가 달린 全草로, 섬쑥부쟁이라고도 하며, 祛風, 淸熱, 解毒, 祛痰, 止咳의 효능이 있어 風熱感氣, 扁桃腺炎, 氣管支炎, 疔, 瘡, 毒蛇咬傷, 벌에 쏘인 刺傷을 치료하는데 사용된다고 알려져 있다8).
山白菊의 효능에 대하여 항산화9,10), 항염10), 지방생성 억제 작용11), 항경련 작용 및 진정 작용12) 등이 연구되었다. 그 중 항염 작용과 관련하여, 메탄올 추출물로 용매 분획한 섬쑥부쟁이 분획물이 lipopolysaccharide (LPS)로 자극한 대식세포에서 NO 생성억제 및 iNOS의 발현을 억제한다는 연구가 있었다. 그러나 아직까지 山白菊을 열수추출하여 제조한 시료를 대상으로 LPS로 자극된 대식세포의 NO, iNOS, COX-2, ERK, p38, JNK에 대하여 보고한 연구는 없었다.
본 연구에서는 山白菊의 항염효과를 확인하기 위해 山白菊을 열수추출하여 lipopolysaccharide(LPS)로 자극한 RAW 264.7 대식세포에서 전처리하였을 때 nitric oxide(NO), inducible nitric oxide synthase (iNOS), cyclooxygenase-2(COX-2)와 Mitogen activated protein kinase(MAPK) 신호전달 경로인 extracellular-signal-regulated kinase(ERK), p38, c-Jun N-terminal kinase(JNK) 단백질의 인산화에 어떠한 영향을 미치는지 알아보았다.
Ⅱ. 재료 및 방법
Dulbecco’s modified Eagle’s medium(DMEM), fetal bovine serum(FBS), penicillin, and streptomycin을 Life Technologies Inc.(Grand Island, NY, USA)에서 구입하여 사용했다. 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT), N6-(1-Iminoethyl)lysin(NIL)은 Tokyo Chemical Industry Co.(Tokyo, Japan)과 Sigma Chemical Co.(St. Louis, MO, USA)에서 각각 구입하였다. 또한 Dimethyl sulfoxide(DMSO) 시약은 Junsei Chemical Co. Ltd.(Tokyo, Japan)에서 구입하였다. iNOS, COX-2, 및 β-actin 항체는 Santa Cruz Biotechnology, Inc.(Dallas, TX, USA)에서 구입하였으며, p-ERK, ERK, p-p38, p38, p-JNK 및 JNK 1차 항체는 Cell Signaling Technology, Inc.(Danvers, MA, USA)에서 구입하여 사용하였다. Horseradish peroxidase-conjugated secondary antibodies는 Jackson Immuno Research laboratories, Inc.(West Grove, PA, USA)에서 구입하였다. 그 외의 시약은 Sigma-Aldrich Co. LLC(St. Louis, MO, USA)에서 구입하였다.
山白菊은 울릉도에서 직접 채취하여 구해온 것을 사용하였다. 증류수 1ℓ에 山白菊 100g을 넣어 3시간 전탕하여 얻은 액을 여과시키고 동결건조(FDU-1200, EYELA, Tokyo, Japan)하였으며 수득율은 32%였다. 동결건조한 시료는 3차 증류수에 녹여 여과 후 사용하였다.
마우스로부터 유래된 대식세포주인 Raw 264.7 세포는 한국세포주은행(Seoul, Republic of Korea)에서 분양받아 사용하였다. RAW 264.7 세포는 10% FBS(Gibco, Big Cabin, OK, USA)와 1% penicillin/streptomycin(Hyclone, Logan, UT, USA)이 포함된 DMEM(Dulbecco’s Modified Eagle Medium) 배지를 사용하여 37℃, 5% CO2 조건에서 배양하였다.
RAW 264.7 세포에 대한 山白菊 열수추출물의 세포독성을 평가하기 위해 MTT assay를 실시하였다. Raw 264.7 세포를 96 well plate에 1×105cells/㎖의 농도로 seeding하고 24시간 동안 배양한 후, 여러 가지 농도의 山白菊 열수추출물을 세포에 처리하였다. 다시 24시간 동안 배양한 뒤 3-(4, 5-Dimethylthiazol-2-yl) -2, 5-diphenyl tetrazolium bromide(MTT) 용액을 처리하였으며, 4시간 후 상등액을 제거하고 dimethyl sulfoxide(DMSO)을 이용하여 비수용성 formazan product을 용해하였다. 세포 생존율은 Epoch® microvolume spectrophotometer system(BioTek Instruments Inc., Winooski, VT, USA)을 이용하여 540㎚ 파장대에서 측정하였다.
RAW 264.7 세포를 24 well plate에 1×105cells/㎖의 농도로 seeding하고 24시간 동안 배양한 후, 여러 가지 농도의 山白菊 열수추출물을 1시간 동안 전처리하였다. 그 후, 1㎍/㎖의 LPS를 처리하여 48시간 동안 다시 배양시킨 후 배양 상등액을 분리하였다. 그 다음 배양 상등액을 96 well plate에 옮겨준 후, 동량의 Griess 시약을 처리하여 실온에서 반응시킨 후 Epoch® microvolume spectrophotometer system (BioTek Instruments Inc., Winooski, VT, USA)을 이용하여 540㎚ 흡광도에서 NO 생성량을 측정하였다.
배양이 끝난 세포를 수집하여 2-3회 PBS(phosphate buffered saline)로 세척한 후 Pro-prep®(iNtRON biotechnology Inc, 경기도) 용액을 사용하여 세포로부터 단백질을 추출하였다. 분리된 단백질을 20-30㎍ 양으로 정량한 뒤 8–10% gel을 이용하여 전기영동을 실시하고 단백질 크기별로 분리하였다. gel로부터 단백질을 polyvinylidine fluoride(PVDF) membrane으로 이동시킨 뒤, 2.5% skim milk로 배양한 후 특정 단백질 검출을 위한 1차 항체를 사용하여 4℃에서 overnight하였다. 하룻밤이 지난 뒤 tween 20/tris- buffered saline(T/TBS)으로 충분히 세척하고 2차 항체를 이용하여 상온에서 2시간 반응시켰다. 반응이 끝난 후 T/TBS로 충분히 세척하고 형광시약을 넣어 감광작업을 진행하여 특정 단백질의 양을 분석하였다.
Ⅲ. 결 과
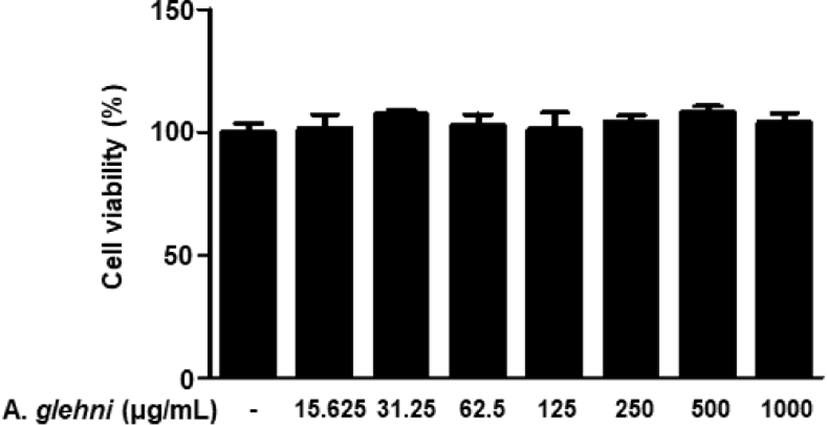
山白菊 열수추출물을 농도별로(15.625, 31.25, 62.5, 125, 250, 500, 1,000㎍/㎖) RAW 264.7 대식세포에 처리하여 세포 생존율에 미치는 영향을 MTT assay를 통해 조사하였다. 그 결과 대조군과 비교하였을 때 山白菊 열수추출물의 처리는 세포 생존율에 대한 유의미한 차이를 나타내지 않았다(Fig. 1). 따라서 15.625㎍/㎖부터 1,000㎍/㎖까지의 山白菊 열수추출물의 농도를 이용하여 다음 실험을 진행하였다.
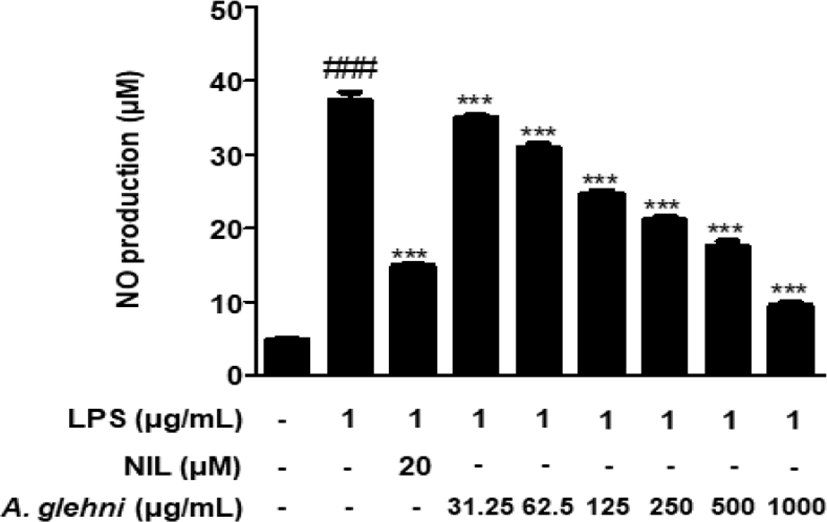
LPS로 염증이 유발된 RAW 264.7 대식세포에서 山白菊 열수추출물의 NO 생성 억제효과를 조사하였다. 대조군에 비하여 LPS로 자극한 RAW 264.7 대식세포에서는 NO 생성이 유의적으로 증가하였고, 31.25, 62.5, 125, 250, 500, 1,000㎍/㎖ 농도의 山白菊 열수추출물을 처리한 세포에서는 LPS에 의한 NO 생성이 농도의존적으로 억제되었다. 특히 1,000㎍/㎖의 山白菊 열수추출물 농도에서는 NO 억제제인 NIL(N6- (1-iminoethyl)-L-lysine, dihydrochloride)보다 우세한 억제 효과를 보였다(Fig. 2).
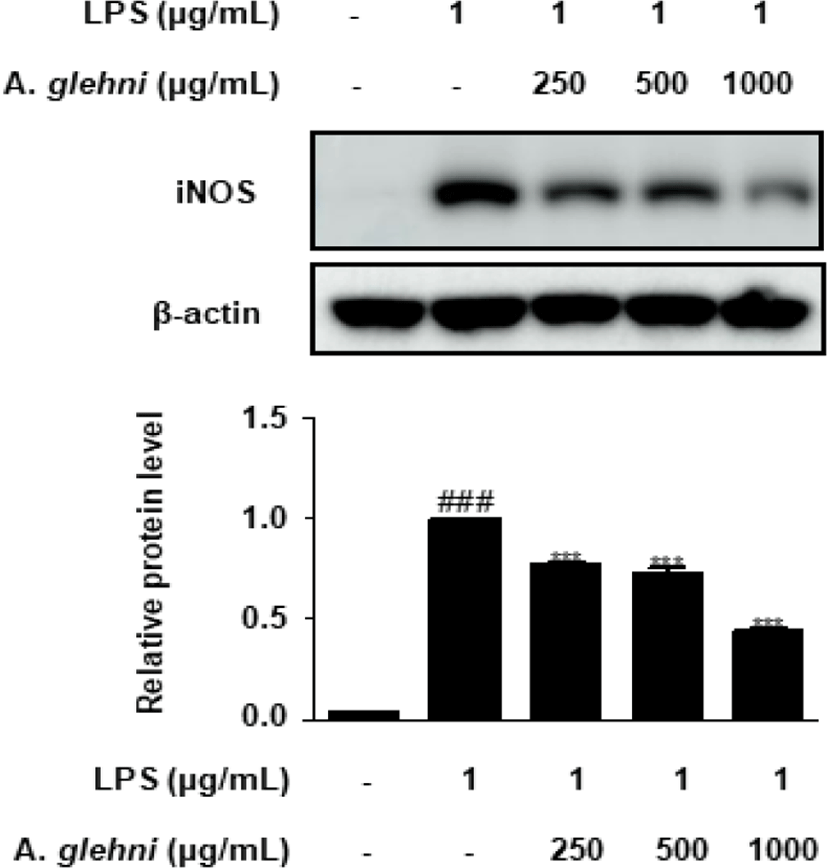
山白菊 열수추출물이 iNOS 발현에 미치는 영향을 western blot assay를 통해 조사하였고 그 결과 250, 500, 1,000㎍/㎖ 농도의 山白菊 열수추출물은 LPS에 의해 증가된 iNOS 발현을 유의하게 억제하였다(Fig. 3).
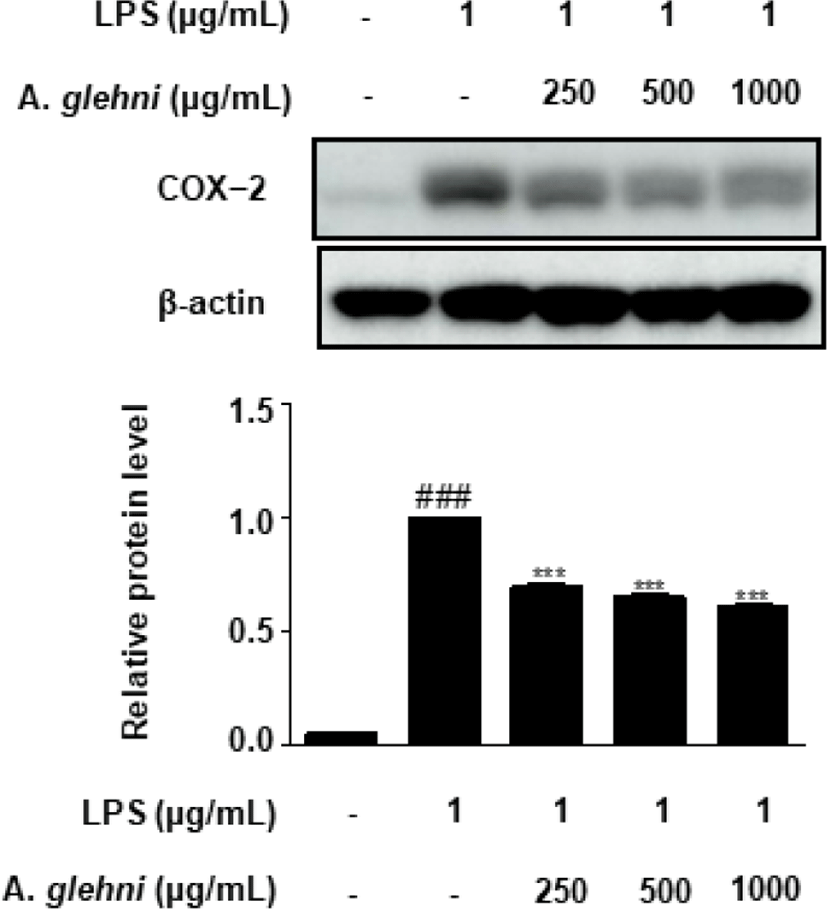
山白菊 열수추출물이 COX-2 단백질 발현에 미치는 영향을 western blot assay를 통해 조사하였다. 그 결과 250, 500, 1,000㎍/㎖ 농도의 山白菊 열수추출물은 LPS에 의해 증가된 COX-2 발현을 유의하게 억제하였다(Fig. 4).
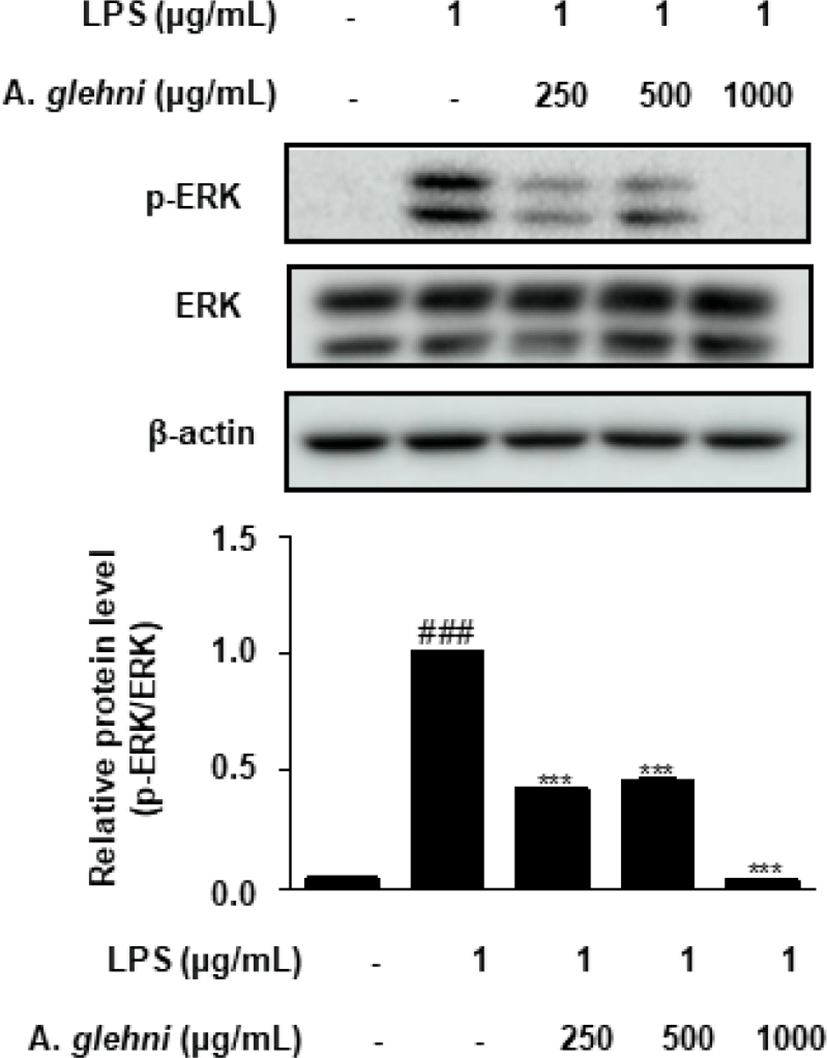
山白菊 열수추출물이 p-ERK 발현에 미치는 영향을 western blot assay를 통해 조사하였다. 그 결과 250, 500, 1,000㎍/㎖ 농도의 山白菊 열수추출물은 p-ERK의 발현을 유의하게 억제하였으며, 특히 1,000㎍/㎖ 농도의 山白菊 열수추출물은 LPS를 자극하기 전과 같은 상태에 이르는 억제효과를 나타내었다(Fig. 5).
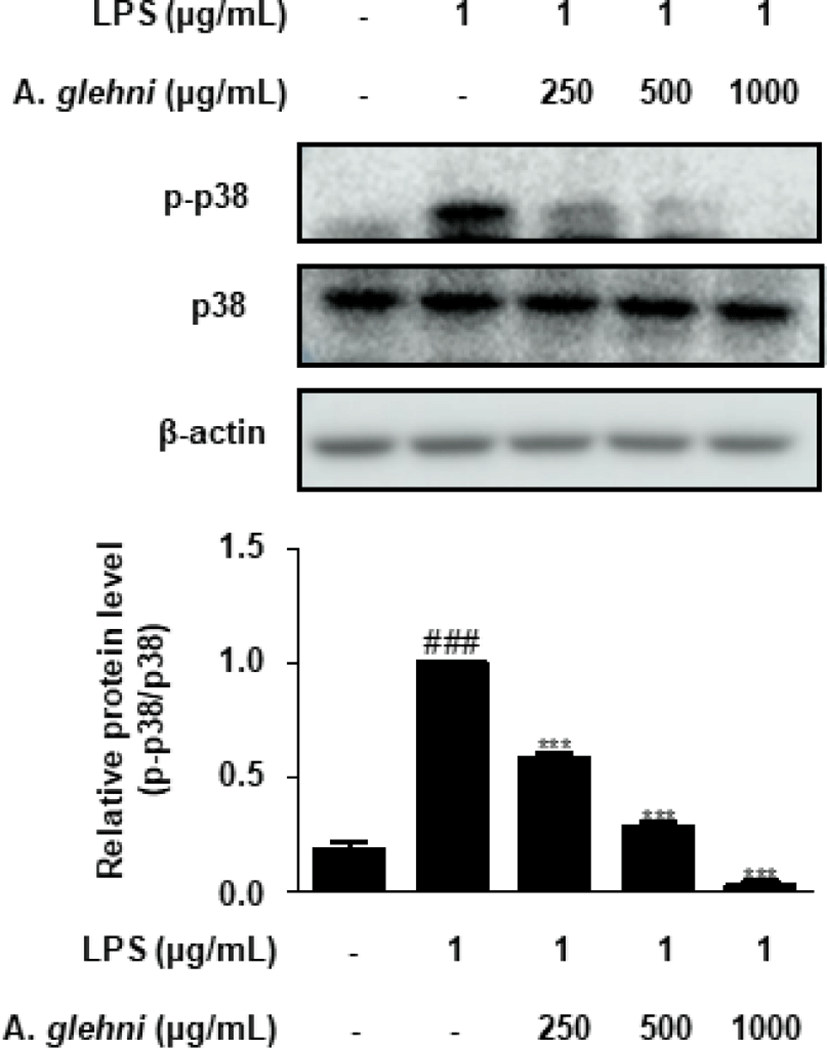
山白菊 열수추출물이 p-p38 발현에 미치는 영향을 western blot assay를 통해 조사하였다. 그 결과 250, 500, 1,000㎍/㎖ 농도의 山白菊 열수추출물은 p-p38의 발현을 농도 의존적으로 억제하였으며, 특히 1,000㎍/㎖ 농도의 山白菊 열수추출물은 LPS를 자극하지 않은 대조군의 p-p38 단백질 발현을 밑도는 수준의 억제효과를 나타내었다(Fig. 6).
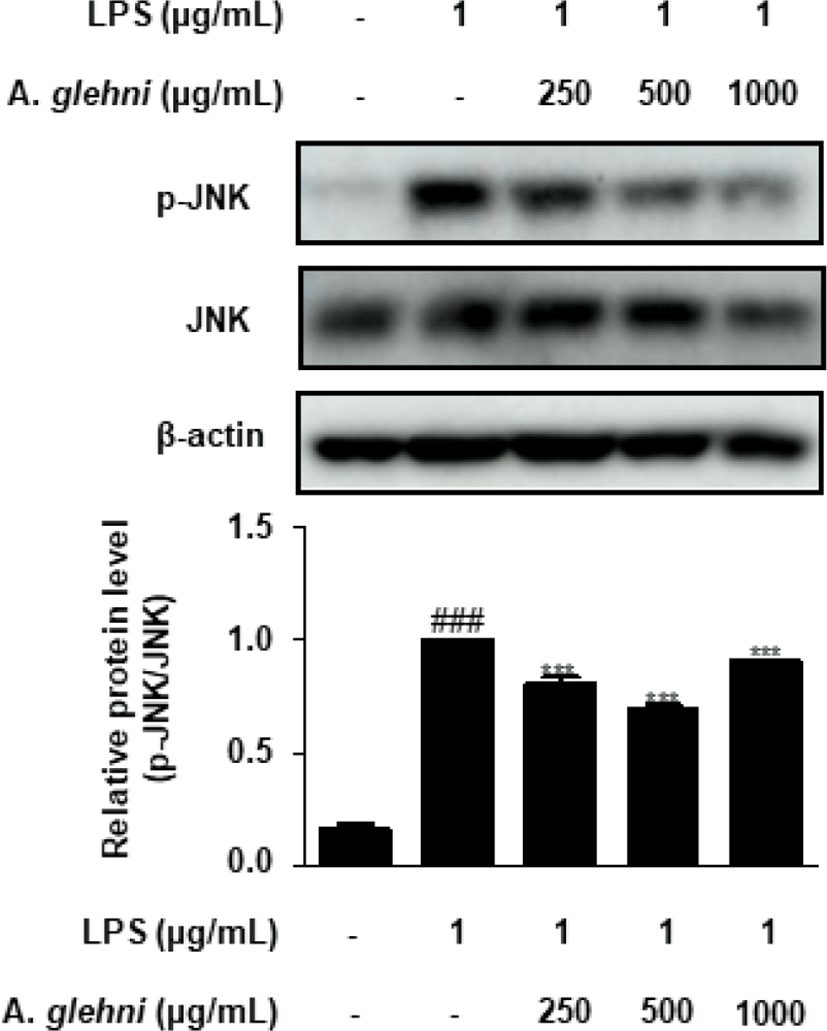
본 연구에서는 山白菊 열수추출물이 p-JNK 발현에 미치는 영향을 western blot assay를 통해 조사하였다. 그 결과 250, 500 , 1,000㎍/㎖ 농도의 山白菊 열수추출물은 LPS로 증가된 p-JNK 발현을 농도의존적이지는 않지만 유의하게 감소시켰다(Fig. 7).
Ⅳ. 고 찰
山白菊은 대한민국 울릉도에 넓게 분포하고 있는 전통적인 한약재로 최근 山白菊에 대한 여러 약리학적 연구가 나오고 있다. 山白菊은 페놀산과 플라보노이드 등을 포함하고 있어 항산화 및 항염 효과를 가지고 있으며, 이외에도 지방생성 억제 효과, 항경련작용, 진정작용 등 다양한 효능이 연구를 통해 밝혀졌다9-12).
한의학적으로 山白菊은 性味가 苦辛하고 凉하여 肺經과 肝經에 들어가 鎭咳, 祛痰, 抗菌 및 항바이러스작용을 한다. 또한 煎劑는 황색포도구균과 나이세리아균 및 카타르구균에 대해 유의미한 억제작용(in vitro)을 보였으며 Influenza virus(아시아 A형 冮西地方 株昌醫 58-3株)에 대해서도 억제작용(in vitro)이 있다고 밝혀졌다8). 山白菊의 항염 작용에 관하여, 2010년에 시행된 연구에서 LPS로 유도된 RAW 264.7 대식세포에서 NO 활성 저해 및 iNOS 발현 억제를 통하여 항산화 및 항염(in vitro) 작용을 하는 것이 규명되었다10).
이에 저자는 山白菊을 열수추출하여 제조한 시료를 대상으로 LPS로 유발된 RAW 264.7 대식세포에서 NO, iNOS, COX-2의 생성 및 ERK, p38, JNK activation에 미치는 영향에 대하여 연구하였고, 유의미한 결과를 얻었다.
염증반응은 활성화된 면역세포에 의해 일어나는 일련의 면역반응으로, 생체 조직이 손상을 받았을 때 손상을 최소화하고 정상으로 회복시키려는 생체의 방어기전이다13,14). 하지만 염증반응이 과도하면 만성염증 질환, 종양 등이 발생하여, 이를 억제할 수 있는 새로운 치료제의 개발이 이어지고 있다15).
LPS는 그람 음성균의 세포외막에 존재하는 내독소로써 대식세포를 활성화시키며, 대식세포를 자극하여 다양한 염증매개성 cytokine들의 분비를 촉진하여 LPS로 자극한 RAW 264.7 세포는 항염증 작용 연구를 위한 in vitro 실험모델로 확립되어 있다16,17). 이에 본 연구는 山白菊 열수추출물의 항염증 효과를 평가하기 위해, LPS로 자극한 RAW 264.7 대식세포에서 NO, iNOS, COX-2, p-ERK, p-JNK, p-p38 등의 염증 매개물질 억제효과를 연구하였다.
적절한 양의 NO는 혈관확장, 신경전달, 면역조절 등의 긍정적인 역할을 하지만, 과도한 NO 생성은 염증반응의 유발과 연관되어있다18,19). 山白菊 열수추출물의 처리는 LPS로 자극한 대식세포에서 NO 생성의 증가를 효과적으로 억제하였는데, 이는 山白菊 열수추출물이 과도한 염증반응을 억제할 수 있는 가능성을 보여주었다(Fig. 2).
iNOS는 NO 합성효소로, 대식세포의 자극으로 인해 생성되어 L-arginine을 NO로 합성하는 작용을 통하여 염증반응을 일으키게 되는데20-2), 山白菊 열수추출물은 LPS에 의해 증가된 iNOS 발현을 유의하게 억제하였다(Fig. 3).
COX-2는 대표적인 염증매개물질로, arachidonic acid을 염증매개물질인 prostaglandin E2로 전환시킨다23-5). 따라서 COX-2 발현을 억제한다면 염증반응 또한 감소시킬 수 있을 것으로 사료되며, 山白菊 열수추출물은 COX-2의 생성을 농도 의존적으로 억제하였다(Fig. 4).
MAPK는 ERK, JNK, p38 MAPK 세 가지로 분류되며, 세포의 외부자극을 세포막에서 세포핵까지 전달하여, 대표적인 신호전달 경로가 된다26). ERK, JNK, p38은 인산화에 의하여 활성화 되는데27,28), 위 실험 결과들을 보았을 때 山白菊 열수추출물은 대식세포에서 ERK, JNK, p38의 인산화를 저해하였고(Fig. 5-7), 이는 앞선 山白菊 열수추출물의 NO 및 COX-2 억제 활성과도 관련성이 있다. 따라서 본 연구는 山白菊 열수추출물이 MAPK 신호전달을 억제하여 과도한 염증 반응을 차단할 수 있음을 제시하였다.
山白菊 열수추출물의 위와 같은 작용은 천식, 류마티스 관절염 등의 자가면역질환, 대장염 및 췌장염 등의 소화기관 염증 등 여러 가지 염증질환에 효과적일 것으로 생각된다. 위의 실험 결과를 바탕으로 하여, 山白菊 열수추출물의 항염증 효과에 대한 in vivo 연구가 이루어져야 할 것으로 사료된다. 또한 다양한 경로를 통한 추가적인 염증 조절의 기전 연구가 이루어져야 할 것이다.
Ⅴ. 결 론
RAW 264.7 대식세포를 LPS로 자극하였을 때 山白菊 열수추출물의 항염증 효과를 연구하여 다음과 같은 결론을 얻었다.
-
山白菊 열수추출물은 RAW 264.7 대식세포에서 세포독성을 관찰한 결과 15.625-1,000㎍/㎖의 농도에서 세포독성이 없었다.
-
山白菊 열수추출물은 LPS에 의해 유도된 RAW 264.7 대식세포에서 NO생성량 및 iNOS, COX-2의 발현을 유의하게 감소 시켰다.
-
LPS로 자극한 RAW 264.7 대식세포에서 p-ERK, p-p38, p-JNK의 발현 또한 유의하게 감소시켰다.
위의 연구 결과를 보았을 때, 山白菊 열수추출물은 RAW 264.7 대식세포에서의 염증 발생에 있어 NO, iNOS, COX-2 및 MAPK 신호전달 경로인 p-ERK, p-p38, p-JNK의 활성을 억제함으로써 항염증 작용을 가진다는 것을 알 수 있었다.






