Ⅰ. 서 론
Reactive oxygen species(ROS)는 홀수 전자를 가지는 O2·-· OH와 같은 산소 라디칼과 H2O2, HOCl 등을 포함한다1). ROS는 호기성 대사의 필수 부산물로 적정량의 ROS는 세포 생존 및 세포 신호 전달에 필수적이며 세포 손상을 방지하는 역할을 한다. 하지만 농도가 높아지면 DNA 및 단백질을 손상시키며 세포 사멸을 유발한다. ROS의 억제는 비효소적 분자인 glutathione, vitamin C 등과, 효소적 항산화제인 superoxide dismutase(SOD), catalase 등에 의해 이루어진다2-4). 생체는 활성 산소의 생성과 제거를 통해 항산화 방어계를 형성하여 생체를 산화적 스트레스로부터 보호하는 역할을 한다. 하지만 과도한 산화적 스트레스는 단백질 분해 효소의 활성화, DNA 산화 등을 일으키고 면역기능을 억제시켜 암을 유발한다5,6).
ROS는 DNA 손상의 매개체로 알려져 있다. ROS의 증가는 미토콘드리아 DNA의 장애와 분해를 유발한다. DNA 손상은 세포 내에서 DNA의 물리적 또는 화학적 변화를 말하는 것으로 DNA는 ROS 외에도 화학 물질, 방사선 등의 다양한 외인성 및 내인성 요인에 의해 손상될 수 있다. 손상된 미토콘드리아의 DNA에 의해 다양한 질병이 야기되고 노화가 가속화된다7,8).
Heme oxygenase-1(HO-1)은 heme을 carbon monoxide(CO), biliverdin, free iron으로 분해하는 반응을 촉진하는 효소이다. HO-1은 자외선, 내독소, 과산화수소 등에 의해 유도된다. 이 유도제들은 ROS를 생성하며, 포유류 세포에서 HO-1의 활성을 증가시킨다. HO-1은 산화 스트레스를 유발하는 물질에 의해 유도될 수 있고, 그에 따른 손상으로부터 세포 보호 효과를 나타낸다9,10).
淸肺瀉肝湯(Chungpyesagan-tang, CPSGT)은 《東醫壽世保元》11)에 수록되어 있는 熱多寒少湯에 大黃을 가한 처방으로, 太陰人 肝受熱裡熱病證편에 제시된다. 太陰人 肝受熱裡熱病證은 항진된 吸聚之氣로 인해 內鬱이 裏熱化되며 발생하는 병증으로 熱病과 燥熱病으로 이루어진다. 熱病은 裏熱만 치성하는 상황으로 頭面部 熱證과 皮膚의 紅, 腫, 熱, 痛의 증상을 보인다. 燥熱病은 裏熱이 지속됨에 따라 氣液이 소모되어 燥證까지 병발한 것으로 熱病의 증상에 大便秘燥, 皮膚毛髮爪甲乾燥도 같이 보인다. 熱病에서 燥熱病으로 진행되는 양상을 이제마는 “澁枯涸皺揭”으로 기술하는데, 이는 신체를 구성하는 요소들이 소모되는 과정, 즉 인체 기능저하의 과정으로 볼 수 있다12-14). 인체 기능저하는 과잉 생산된 활성 산소로 인한 산화적 스트레스가 DNA 산화, 단백질 분해 활성 등을 유발하여 세포 손상 및 기능저하를 촉발하는 것15)과 유사한 측면이 있어 보이기에, 燥熱病에 사용하는 처방 중 “燥熱病 熱多寒少湯 藁本⼆錢 加⼤⿈⼀錢 不可不早治豫防11)”의 처방으로 제시된 CPSGT이 항산화 효과가 있을 것으로 판단하였다. 그러나 지금까지 CPSGT의 국내 연구 동향은 중풍16-18), 허혈/재관류 세포 손상에 대한 보호 효과19), 저산소/재관류에 대한 세포 보호 효과20), 혈소판 응집 억제 작용21), 항염증 효과22), 당뇨23), 관절염24), lipase 활성 저해 및 체중 감량, 혈장 지질25)에 대한 연구만 있을 뿐 항산화에 관한 연구는 미비한 실정이다. 이에 본 연구는 RAW 264.7 세포에서 CPSGT의 항산화 효과에 대한 유의한 결과를 얻었기에 보고하는 바이다.
Ⅱ. 재료 및 방법
CPSGT은 ㈜HMAX(Korea)에서 한약재 규격품을 구입하여 제조되었다. 사용된 약재는 다음 표와 같다(Table 1).
약재를 증류수 2ℓ와 함께 heating mantle (MS-DM607, M-TOPS, Korea)로 100℃에서 4 시간 동안 추출하였다. Filter paper로 여과한 뒤, 감압 농축하고 초저온 냉동고에서 보관 후 동결 건조하였다. 얻어진 분말을 시료로 사용하였다. 추출물은 17.9g을 얻었고 수율은 약 14%였다.
본 연구에서는 American Type Culture Collection (ATCC)에서 구입한 RAW 264.7 세포를 사용하였다. 배양 시 10%의 FBS(GenDEPO, USA)와 1% penicilin/streptomycin (GenDEPO, USA)을 포함한 Dulbecco’s Modified Eagle Medium(DMEM, GenDEPO, USA) 배지를 이용해 37℃, 5% CO₂ 조건에서 배양하였고 주기적으로 계대배양하였다.
CPSGT의 세포 생존율 측정을 위해 MTT assay를 진행하였다. RAW 264.7 세포를 96 well-plate에 5×10⁴cells/well가 되도록 100㎕씩 분주한 뒤 37 ℃, 5% CO₂ 조건에서 24시간 동안 배양하였다. 상층액을 제거하고 CPSGT를 25, 50, 100, 200, 400㎍/㎖의 농도로 100㎕씩 처리하고 24시간 동안 배양하였다. 그 후 MTT(5㎎/㎖) 를 10㎕ 처리하고 4시간 동안 반응시킨 후 상층액을 제거하고 DMSO를 이용하여 세포를 용해시켰다. 용해한 후 spectrophotometer를 이용하여 570㎚에서 흡광도를 측정하였다.
CPSGT의 radical 소거능 측정을 위해 DPPH assay를 진행하였다. 증류수를 이용하여 CPSGT의 최종 농도가 50, 100, 200, 400㎍/㎖가 되도록 제조하였다. 각각 만들어진 시료를 250mM의 DPPH 용액과 1:1로 혼합한 뒤 실온에서 빛을 차단하고 30분 동안 반응 후 spectrophotometer를 이용하여 517㎚에서 흡광도를 측정하였다. 이때 대조군으로 200㎛의 Ascorbic acid(Sigma, USA)를 사용하였다.
CPSGT의 radical 소거능 측정을 위해 ABTS assay를 진행하였다. 7mM 2,2-azino-bis(3-ethylbenzo- thiazoline-6-sulfonic acid) diammonium salt와 2.45mM potassium persulfate를 혼합하여 암실에서 24시간 동안 반응하였다. 양이온을 형성한 후, ABTS 용액의 흡광도 값이 0.7-0.8 사이의 값이 되도록 조정하였다. 증류수를 이용하여 CPSGT의 최종 농도가 50, 100, 200, 400㎍/㎖가 되도록 제조한 후, ABTS 용액 100㎕와 농도별 시료 20㎕를 빛이 차단된 실온에서 30분 동안 반응 후 spectrophotometer를 이용하여 734㎚에서 흡광도를 측정하였다. 이때 대조군으로 200㎛의 Ascorbic acid(Sigma, USA)를 사용하였다.
CPSGT의 ROS 소거 능력을 측정하기 위해 DCF-DA를 실시하였다. RAW 264.7 세포를 6 well-plate에 5×10⁵cells/well이 되도록 분주한 뒤 37℃, 5% CO₂ 조건에서 24시간 동안 안정화시켰다. CPSGT의 최종 농도가 50, 100, 200, 400㎍/㎖가 되도록 1㎍/㎖의 LPS와 동시에 처리하고 24시간 동안 배양하였다. 이후 10㎛의 DCF-DA를 처리한 후 10분 동안 반응시킨 뒤 형광현미경을 통해 확인하였다.
RAW 264.7 세포를 6 well-plate에 3×10⁵cells/well이 되도록 분주한 뒤 37℃, 5% CO₂ 조건에서 24시간 동안 안정화시켰다. CPSGT의 최종 농도가 50, 100, 200, 400㎍/㎖가 되도록 1㎍/㎖의 LPS와 동시에 처리하고 24시간 동안 배양하였다. 1㎍/㎖의 DAPI를 처리한 후 20분 동안 반응시킨 뒤 methanol로 1회 세척하였다. PBS를 첨가한 뒤 형광현미경을 통해 확인하였다.
RAW 264.7 세포를 6 well-plate에 3×10⁵cells/well이 되도록 분주한 뒤 37℃, 5% CO₂ 조건에서 24시간 동안 안정화시켰다. CPSGT의 최종 농도가 50, 100, 200, 400㎍/㎖가 되도록 1㎍/㎖의 LPS와 동시에 처리하고 24시간 동안 배양하였다. PBS로 세포를 세척하고 scraper를 이용해 수확하였다. 수확한 1×10⁵ cells/㎖ 세포를 low melting agarose와 1:10(v/v) 비율로 혼합한 뒤 50㎕를 comet slide(Trevigen, USA)에 분주하였다. 4℃에서 응고시킨 뒤 lysis solution으로 4℃에서 20분 동안 용해시켰다. 상온에서 20분 동안 Alkali unwinding solution에 담가 DNA를 unwinding 시켰다. 4℃의 전기영동 tray에 슬라이드를 올린 뒤 21V에서 30분 동안 전기 영동한 후, 증류수로 2회, 70% ethanol로 1회 세척하였다. 슬라이
드를 37℃에서 건조한 후 100㎕의 SYBR green 용액으로 30분 동안 염색하고 증류수로 세척하였다. 염색된 슬라이드는 건조시킨 뒤 형광현미경으로 관찰하였다.
RAW 264.7 세포를 6 well-plate에 7×10⁵cells/well이 되도록 분주한 뒤 37℃, 5% CO₂ 조건에서 24시간 동안 안정화시켰다. CPSGT의 최종 농도가 50, 100, 200, 400㎍/㎖가 되도록 1㎍/㎖의 LPS와 동시에 처리하고 24시간 동안 배양하였다. Trizol reagent(Ambion, USA)를 이용하여 RNA를 추출한 후 diethylpyrocarbonate(DEPC treated water, Sigma, USA)로 용해하고 Nano Drop 2000(Thermo fisher, USA)으로 정량하였다. 정량된 RNA는 cDNA 합성 kit(Revertra ACE-⍺-, Toyobo, Japan)를 이용해 cDNA로 합성하였다. cDNA와 Taqman master mix(Thermo fisher, USA)를 혼합하여 real-time RT-PCR을 진행하였으며, 실시간으로 유전자별 발현량을 확인하였다. 실험에 사용된 probe들은 다음 표와 같다(Table 2).
| Symbol | Gene name | Assay ID |
|---|---|---|
| GAPDH | Glyceraldehyde-3-phosphate dehydrogenase | Mm99999915_g1 |
| HO-1 | heme oxygenase-1 | Mm00516005_m1 |
RAW 264.7 세포를 6 well-plate에 7×10⁵cells/well이 되도록 분주한 뒤 37℃, 5% CO₂ 조건에서 24시간 동안 안정화시켰다. CPSGT의 최종 농도가 50, 100, 200, 400㎍/㎖가 되도록 1㎍/㎖의 LPS와 동시에 처리하고 24시간 동안 배양하였다. 그 후 RIPA Lysis Extraction Buffer(Thermo fisher, USA)에 Halt™ Protease and Phosphatase Inhibitor Cocktail, EDTA-free(Thermo fisher, USA)를 첨가 한 용액을 사용하여 세포를 용해시킨 후 4℃, 12000rpm의 조건으로 20분 동안 원심분리하였다. 얻은 단백질은 Pierce™ BCA Protein Assay Kit(Thermo fisher, USA)를 이용하여 정량하였다. 정량된 단백질을 5X SDS-PAGE Loading dye을 사용하여 염색해준 뒤 전기영동 시켰다. Gel을 membrane으로 transfer 시킨 뒤 5%의 skim milk로 1시간 동안 blocking을 진행한 후 1차 항체로 overnight 하였다. Tris Buffered Saline with Tween 20(TBST)로 5분 간격으로 3회 세척한 뒤 secondary antibody를 3시간 동안 처리하였다. TBST로 세척한 후 단백질의 발현을 확인하였다.
Ⅲ. 실험 결과
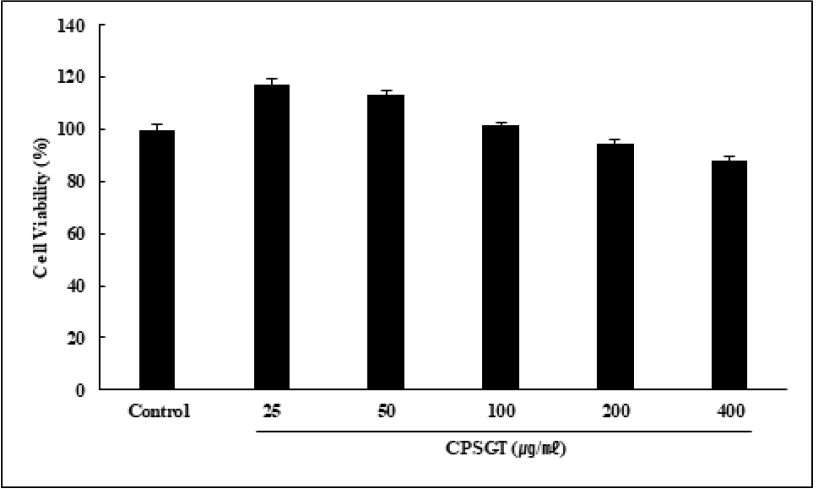
CPSGT를 25, 50, 100, 200, 400㎍/㎖의 농도로 처리한 RAW 264.7 세포에서 세포 독성 평가를 실시한 결과 RAW 264.7 세포에서 CPSGT이 25-400㎍/㎖의 농도 범위에서 독성이 없음을 확인하여 본 연구에서는 50-400㎍/㎖의 농도로 실험을 진행하였다(Fig. 1).
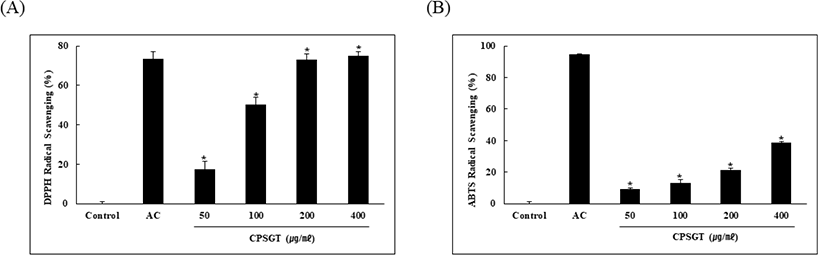
CPSGT의 radical 소거능을 알기 위해 DPPH 및 ABTS를 실시하였다. CPSGT를 50, 100, 200, 400㎍/㎖의 농도로 처리하였을 때, radical 소거능이 농도 의존적으로 증가하였다(Fig. 2).
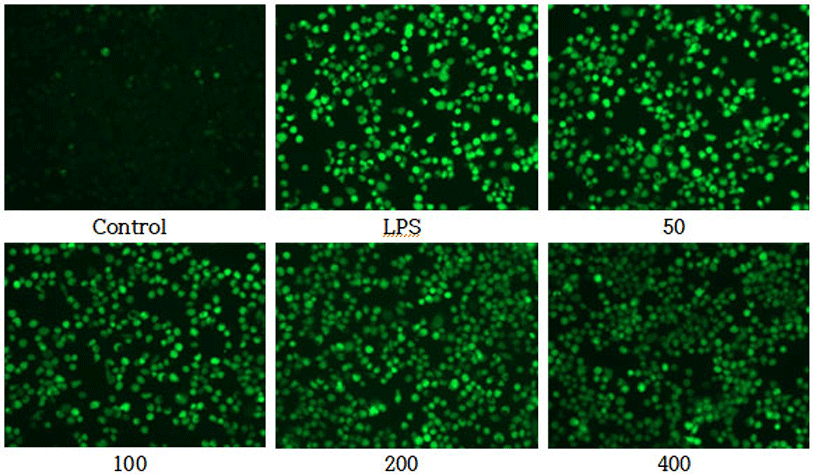
DCF-DA를 이용하여 LPS로 유도된 RAW 264.7 세포에서 CPSGT의 ROS 소거능을 측정한 결과, LPS 처리군과 비교하였을 때, 농도 의존적으로 형광의 세기가 감소하였다(Fig. 3).
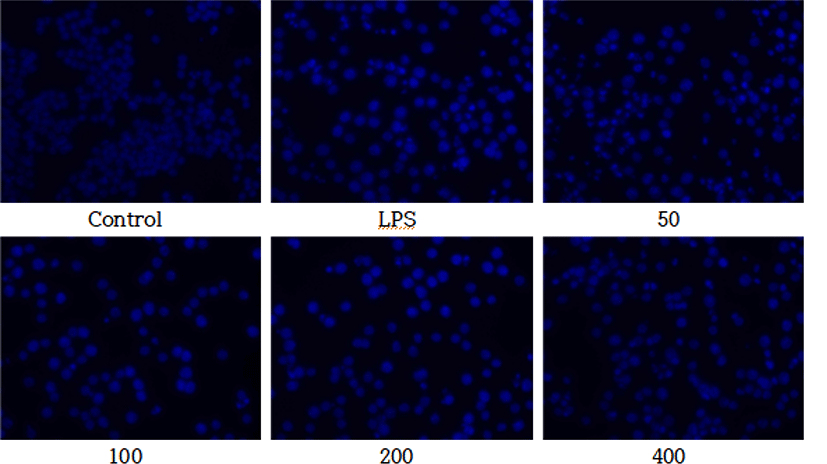
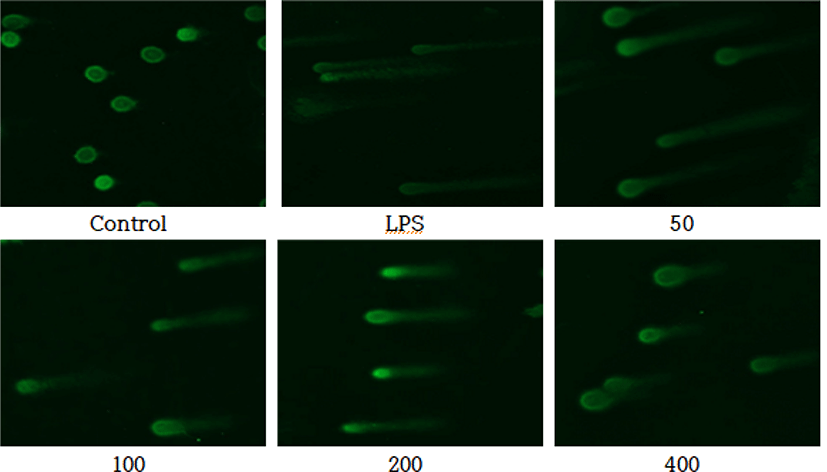
DAPI staining을 이용하여 LPS로 유도된 RAW 264.7 세포에서 CPSGT의 DNA 손상에 대한 회복력을 측정한 결과, LPS로 처리한 대조군과 비교하였을 때, 농도 의존적으로 형광의 세기가 감소하였다(Fig. 4).
Comet assay를 이용하여 LPS로 유도된 RAW 264.7 세포에서 CPSGT의 DNA 손상에 대한 회복력을 측정한 결과, LPS로 처리한 대조군과 비교하였을 때, 농도 의존적으로 꼬리 길이가 감소하였다(Fig. 5).
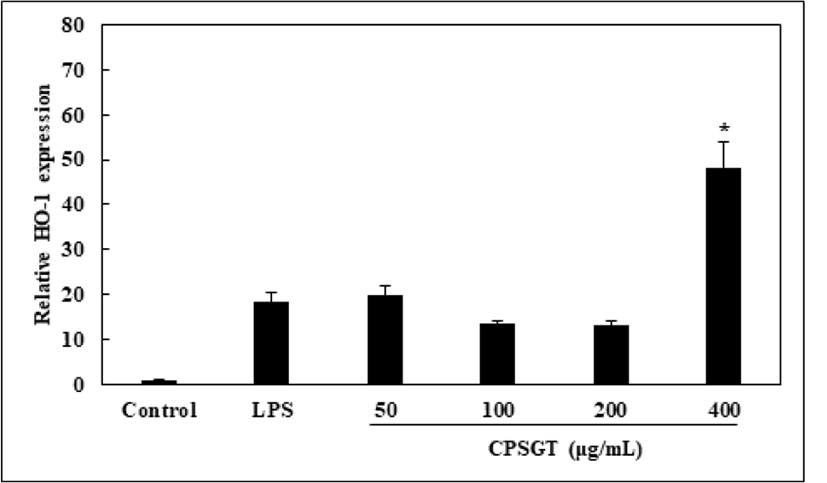
LPS로 유도된 RAW 264.7 세포에서 CPSGT에 대한 HO-1의 mRNA 발현량을 확인하였다. LPS를 처리한 군과 비교하여 HO-1 유전자 발현은 400㎍/㎖의 농도에서 증가하였다(Fig. 6).
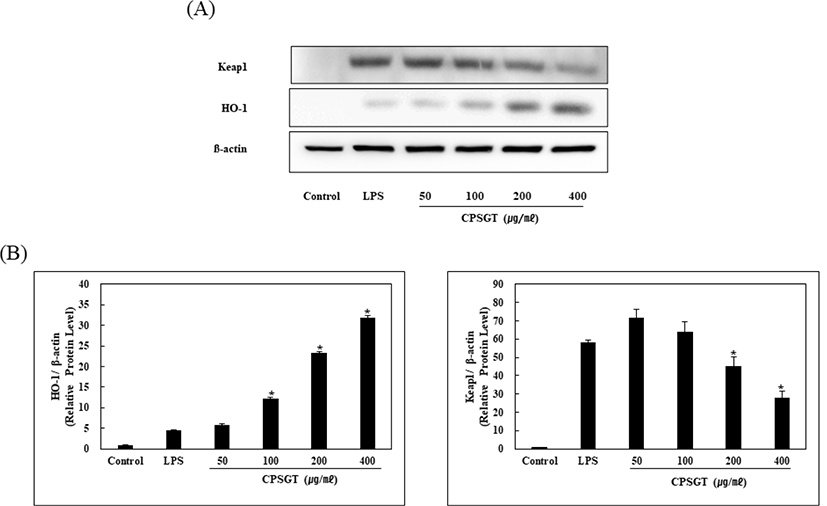
LPS로 유도된 RAW 264.7 세포에서 CPSGT에 대한 Keap1과 HO-1의 발현량을 확인하였다. LPS를 처리한 군과 비교하였을 때, 농도 의존적으로 Keap1의 발현이 감소하였고, HO-1의 발현이 증가하였다(Fig. 7).
Ⅳ. 고 찰
활성 산소는 분자 혹은 원자의 최외각의 전자 궤도에 쌍을 이루지 않은 전자를 가진 불안정한 화합물을 통칭하는 것으로, O2·- · OH 등을 포함한다. 활성 산소는 산소 호흡 시에 부수적으로 생성되는 것으로 정상 상태에서도 생성된다26). 활성 산소는 불안정하고 반응성이 높기 때문에 핵과 세포막에서 DNA, 지질 등의 분자들을 손상시킬 수 있다27). 그에 따라 산화를 억제하는 항 산화제에 대한 연구가 증가하고 있다. 항산화제는 일반적으로 천연 항산화제와 합성 항산화제로 구분된다. 가장 널리 이용되고 있는 합성 항산화제로는 phenolic compound로서 인공 합성물인 butylated hydro- xyanisole(BHA), butylated hydroxytoluene(BHT) 등이 알려져 있다. 하지만 이들은 과량 섭취 시 독성의 유해성이 염려되어 인체에 무해하고 항산화력이 뛰어난 천연 항산화제에 대한 관심이 커지고 있다28,29).
CPSGT은 《東醫壽世保元》11)에 수록되어 있는 熱多寒少湯에 大黃을 가한 처방으로 太陰人 肝受熱裡熱病證편의 熱多寒少湯 치험례에서 처음 제시되며, 후대의 《東醫四象新編》30)에서부터 淸肺瀉肝湯이라는 독립된 처방명으로 사용되었다. 肝受熱裡熱病證은 太陰人의 항진된 吸聚之氣가 內鬱을 유발하며, 內鬱이 通外하지 못하고 裏熱化 되어 발생하는 병증으로 熱病단계와 燥熱病단계로 이루어진다. 熱病은 裏熱만 치성하고 燥證이 없는 상태 로 潮熱, 有汗, 口渴, 腹滿, 皮膚의 紅, 腫, 熱, 痛, 面赤斑, 目疼, 頭面項頰赤腫, 咽喉腫痛의 증상을 보인다. 燥熱病은 裏熱이 지속됨에 따라 氣液이 소모되어 燥證까지 병발하여 大便秘燥, 皮膚毛髮爪甲乾燥, 斑瘡, 肌肉無力, 耳聾目暗, 脚弱腰痛까지 보인다12-14). 韓方病理學에서는 氣機陰陽均衡상태에서 七情鬱火, 勞倦奪精 등에 의하여 陽亢陰虛가 됨에 따라 口渴飮冷, 面紅目赤 등의 증상을 야기하는 熱이 발생하며, 熱이 지속됨에 따라 傷陰하여 津液耗損이 되면 皮膚乾燥皺揭瘙痒, 咽鼻焦乾, 便結閉 등의 증상을 야기하는 燥가 속발적으로 발생하는 것으로 본다31). 《東醫壽世保元》11)에서도 이와 같은 병리적 양상으로 熱病에서 燥熱病으로 진행됨을 內經 燥病機를 인용하여 ‘澁枯涸皺揭“으로 기술하고 있다. 熱病에서 燥熱病으로의 병리적 진행 양상은 인체의 陰津이 耗損되어 濡養滋潤의 기능이 점진적으로 저하 되는 과정, 즉 인체 기능저화의 과정으로 볼 수 있다12,14,31). 이와 같은 인체 기능저하 과정은 과잉 생산된 활성 산소로 인해 유발된 산화적 스트레스가 지질과산화, RNA 산화, DNA 산화 등을 야기하여 세포 괴사 및 퇴화가 속발적으로 발생하는 것32)과 유사한 측면이 있어 보인다. 이에 燥熱病에 사용된 처방들이 항산화 효과가 있을 것으로 생각하였고, 그 중 “燥熱病 熱多寒少湯 藁本⼆錢 加⼤⿈⼀錢 得效矣 凡太陰人 ⼤便秘燥 ⽽引飮者 不可不早治豫防11)”으로 燥熱病의 豫防藥으로 이제마가 제시한 CPSGT이 항산화 효과가 있을 것으로 우선적으로 판단하였다. 그러나 CPSGT에 대한 국내 연구 동향은 급성기 중풍16), 중대뇌동맥 영역의 뇌경색17), 뇌허혈 손상18), 허혈/재관류 세포 손상에 대한 보호 효과19), 저산소/재관류에 대한 세포 보호 효과20), 혈소판 응집 억제 작용21), 항염증 효과22), 당뇨23), 관절염24), lipase 활성 저해 및 체중 감량, 혈장 지질, UCP 1,2 발현25)이 있으나, 항산화에 관한 연구는 미비한 실정이었다. 이에 본 연구에서는 LPS로 ROS를 유도하여 RAW 264.7 세포에서 CPSGT 처리에 따른 항산화 효과를 평가하였다.
농도별 CPSGT 처리에 따른 세포 생존율을 평가하기 위해 MTT assay를 실시하였다. 그 결과 CPSGT는 최고 농도인 400㎍/㎖의 농도에서도 87.37%의 생존율을 보였으므로 세포독성을 나타내지 않았음을 확인하였다(Fig. 1). 따라서 이후의 실험은 50-400㎍/㎖의 농도로 진행하였다. CPSGT의 radical 소거능을 확인하기 위해 DPPH, ABTS assay를 수행하였다. 그 결과, DPPH는 400㎍/㎖ 농도에서 74.96%의 소거능을, ABTS는 400㎍/㎖ 농도에서 38.55%의 소거능을 보였으며 둘 다 농도 의존적으로 radical 소거능이 증가함을 확인하였다(Fig. 2). 내독소인 Lipopolysaccharide(LPS)는 그람음성균 외막의 주요성분으로 Toll-like receptor 4(TLR4)에 결합하여 여러 신호 전달 경로를 활성화한다. 대식세포는 미생물의 감염에 반응하는 식세포 활동의 중요한 매개체로 ROS를 생성하고 방출한다33). ROS 소거능을 확인하기 위해 LPS로 ROS를 유도한 후 DCF-DA를 진행하였다. LPS 처리군과 비교하여 CPSGT을 처리함에 따라 농도 의존적으로 형광의 세기가 감소하였다(Fig. 3).
수많은 내인성 및 외인성 물질에 의해 세포의 DNA가 손상된다. DNA 손상은 세포 사멸을 일으키고 돌연변이를 유발할 수 있다. ROS는 DNA 단편화를 증가시켜 DNA 손상을 일으키나, 항산화제로 처리하면 DNA 손상을 줄일 수 있다는 연구가 보고되었다34,35). LPS로 ROS를 유도하여 DNA 손상을 일으킨 뒤, CPSGT를 처리하고 LPS군과 비교하여 DNA 손상에 대한 보호 효과의 가능성을 확인하였다. 그 결과, DAPI staining은 LPS군과 비교하여 CPSGT를 처리하였을 때 형광의 밝기가 감소하였다(Fig. 4). Comet assay는 LPS군과 비교하여 CPSGT를 처리하였을 때 꼬리의 길이가 감소하였다(Fig. 5).
세포 방어 항산화 효소로 알려진 HO-1을 유도하는 것은 산화적 스트레스를 방어하는 중요한 기전 중의 하나이다. HO-1은 산화적 스트레스를 유도하는 자극에 의해 합성되며 세포 내의 산화-환원 균형을 유지하는데 기여한다. HO-1은 상위 전사 인자인 Nuclear factor erythroid-2-related factor 2(Nrf2) 에 의해 생성이 유도되는 것으로 알려져 있다. Nrf2는 Keap1과 결합하여 세포질에 존재하다가 자극에 의해 Keap1에서 방출되어 핵으로 이동해 Antioxidant reactive element (ARE)에 결합하여 항산화 효소인 HO-1, NAD(P)H: quinone oxidoreductase(NQO1) 등의 발현을 조절한다. 그중 HO-1은 산화적 손상을 받은 세포를 완화시키는데 중요한 역할을 하는 항산화 효소라고 알려져 있다36-39).
HO-1을 LPS로 유도한 후 CPSGT를 농도별로 처리하여 mRNA 및 단백질의 발현량을 확인하였다. 그 결과 농도 의존적으로 HO-1의 mRNA 발현량이 증가하였다(Fig. 6). Keap1 단백질의 발현량은 감소하였고, HO-1 단백질 발현량은 증가하였다(Fig. 7). 이를 통해 CPSGT의 항산화 효과를 확인하였다. 향후 CPSGT를 이용한 HO-1의 전사 인자인 Nrf2 발현과 또 다른 항산화 효소인 NQO1에 대한 추가적인 연구가 필요할 것으로 생각된다.
Ⅴ. 결 론
본 연구에서는 LPS로 유도된 RAW 264.7 세포에서 CPSGT의 항산화 효과를 연구하였으며 다음과 같은 결론을 얻었다.
-
CPSGT를 처리하였을 때 농도에 따른 세포 독성을 확인한 결과 25-400㎍/㎖에서 독성이 없음을 확인하였다.
-
CPSGT를 처리하였을 때 농도에 따른 radical 소거능을 확인한 결과 DPPH 및 ABTS에서 농도 의존적으로 radical 소거능이 증가했다.
-
CPSGT를 처리하였을 때 농도에 따른 ROS 소거능을 확인한 결과 LPS를 처리한 군에 비하여 CPSGT의 농도가 증가함에 따라 형광 정도가 감소했다.
-
CPSGT를 처리하였을 때 농도에 따른 DNA 손상에 대한 세포 보호 효과를 확인한 결과 LPS를 처리한 군과 비교하여 농도 의존적으로 형광세기가 감소했다.
-
CPSGT를 처리하였을 때 농도에 따른 DNA 손상에 대한 세포 보호 효과를 확인한 결과 LPS를 처리한 군과 비교하여 농도 의존적으로 꼬리 길이가 감소했다.
-
CPSGT를 처리하였을 때 농도에 따른 HO-1의 mRNA 발현량을 확인한 결과 LPS를 처리한 군과 비교하여 농도 의존적으로 발현량이 증가하였다.
-
CPSGT를 처리하였을 때 농도에 따른 HO-1의 단백질 발현량을 확인한 결과 LPS를 처리한 군과 비교하여 농도 의존적으로 발현량이 증가하였다.






