Ⅰ. 서 론
피부는 표피 및 진피로 이루어져 있으며 외부의 자극으로부터 신체를 보호하는 생리학적 장벽이다1,2). 피부의 노화는 시간이 경과함에 따라 발생하는 내인성 노화와 외부 자극으로 인한 외인성 노화로 분류되며, 외부자극에는 자외선이 대표적이다3). 외부 자극을 받은 피부는 세포 내에 활성산소종(reactive oxygen species, ROS)을 생성한다. ROS는 자유라디칼을 포함하는 불안정한 산소로 과도하게 증가되면 산화적 스트레스를 일으켜 염증성 cytokine의 분비를 촉진시킨다4,5). 분비된 cytokine은 세포막과 세포를 구성하는 단백질을 손상시키거나 염증 반응을 일으키게 되는데, 이 반응이 피부에 적용되면 피부의 주요 성분 중 collagen을 분해하는 matrix metalloproteinase-1(MMP-1)의 발현을 증가시킨다고 알려져 있다6-8). MMP-1은 세포외 기질(extracellular matrix, ECM)의 분해를 초래하는 matrix metalloproteinases(MMPs)의 종류 중 하나이며, MMPs는 특이성에 따라 collagenases, gelatinases, stromelysins, elastase 등으로 분류되며 현재까지 24개의 MMPs가 존재한다고 알려져 있다9). MMP-1의 발현이 증가되면 collagen이 절단되고 이어 절단된 collagen 조각은 MMP-3 및 MMP-9에 의해 추가로 절단되며 분해된다. 이 과정이 반복되면서 피부의 탄력, 보습이 감소되어 노화가 일어나게 된다10). 따라서 세포 내의 활성산소종을 감소시켜 산화적 스트레스를 방어하는 항산화 물질의 중요성이 커지고 있다. 본 연구에서 사용한 內疎黃連湯(Naesohwangryun-tang, NSHRT)은 癰疽를 치료하는 처방으로, 《東醫寶鑑 雜病篇 癰疽》11)에는 "治癰疽, 脉洪一作沈實, 發熱煩躁, 藏府秘澁, 當先通利, 宜用此."라고 기록되어 있다. NSHRT은 임상에서 주로 체표에 발생하는 급성 瘡瘍12), 즉 화농성 피부 질환을 치료하는데 사용되고 있다. NSHRT은 《東醫寶鑑 雜病篇 癰疽》11에서 “治內癰疽大法, 內證宜疏導, 宜內疏黃連湯”으로 기록되어 있으며, 瘡瘍을 회복하게 하는 데에 있어 섬유아세포가 상처부위 회복에 있어서 중요한 collagen 관련된 항노화 효과가 있을 것으로 생각된다. NSHRT에 대한 대식세포에서의 항산화 및 항염증 효능의 주제로 한 선행 연구13,14)는 있으나, 항노화와 관련된 항산화 효능에 대한 실험적 연구는 미흡한 실정이다. ROS 억제를 통한 NO 억제의 항염증 효능 외에도 ROS 억제를 통해 MMP-1을 억제하는 항노화의 효과가 기대되어 섬유아세포에서의 항산화 및 항노화 효능에 대한 실험적 연구를 시행하였다. 본 연구에서는 NSHRT의 항산화 효과를 기반으로 산화 스트레스를 통해 발생하는 피부 주름에 관해 연구하고자 하였으며, 항노화와 항산화 효과에 대한 세포 내 신호 전달 기전에 대해서도 관찰하고자 한다.
Ⅱ. 재료 및 방법
NSHRT에 사용되는 약재는 ㈜HMAX(Jecheon, Korea)에서 규격품을 구매하여 사용하였다. 구입한 약재들은 다음과 같다(Table 1).
약재를 각각 정량하여 3차 증류수 2,000㎖과 함께 heating mantle(MS-DM607, M-TOPS, Korea)을 이용하여 4시간 동안 추출하였다. 추출물을 6시간 냉각시킨 후 거즈와 filter paper(Advantec, Tokyo, Japan)로 2번에 걸쳐 여과한 다음, 여과액을 감압농축기(CH-9230 Flawil 1, BUCHI Switzerland)로 농축하여 100㎖의 농축액을 얻었다. 농축액은 초저온 냉동고에서 24시간 냉각시킨 후 동결 건조기를 이용하여 건조분말 40g을 얻었다. 이 때 수율은 약 20.8%이다.
인간 피부 섬유아세포인 Hs68세포는 American Type Culture Collection(ATCC; Manassas, USA)에서 분양 받아 사용하였으며, 10% fetal bovine serum(FBS)과 1% penicillin-streptomycin을 첨가한 Dulbecco’s modified eagle medium(DMEM)을 사용하여 37℃, 5% CO2조건의 배양기에서 배양하였다.
Hs68세포에서 NSHRT의 세포 독성과 생존율을 알아보기 위하여 3-(4,5-dimethylthiazole-2-yl)-2,5-diphenyl-tetrazolium bromide(MTT) assay를 진행하였다. 96 well plate에 Hs68세포를 5×103cells/well이 되도록 하여 24시간 동안 37℃, 5% CO2조건에서 배양하였다. 24시간 후 NSHRT를 농도별(100, 200, 400 및 800㎍/㎖)로 처리하였다. 24시간 배양 후에, MTT 용액(4㎎/㎖)을 20㎕ 처리한 다음 4시간 동안 반응시켰다. 반응 후 상층액을 제거하고 DMSO 100㎕로 세포를 용해시켰다. 생성된 formazan은 spectrophotometer(SpectraMax 190; Molecular Devices, Sunnyvale, California, USA)를 이용하여 570㎚에서 흡광도를 측정하였다.
MMP-1의 유전자 발현량에 대한 NSHRT의 억제 효과를 확인하기 위해 60㎜ plate에 Hs68세포를 5×105cells/well이 되도록 하여 37℃, 5% CO2incubator에서 24시간 동안 배양하였다. 그 후 NSHRT를 농도별(100, 200, 400 및 800㎍/㎖)로 45분간 전처리한 다음, TNF-α(20ng/㎖)를 24시간 동안 배양하고 Trizol reagent(Ambion, USA)를 사용하여 RNA를 추출하였다. RNA는 diethyl pyrocarbonate (DEPC treated-water; Sigma, USA)로 희석하여 Nano Drop 2000(Thermo fisher, USA)으로 정량하였다. Total RNA는 2㎍으로 정량한 다음, cDNA 합성 kit(ReverTra ACE-α-; Toyobo, Japan)를 사용해 cDNA로 합성하였다. 이렇게 합성된 cDNA와 primer, Tagman master mix(Thermo fisher, USA)를 혼합하여 real-time PCR을 수행하였다.
MMP-1 단백질 분비량 측정은 Hs68세포에 NSHRT를 농도별(100, 200, 400 및 800㎍/㎖)로 45분간 전처리한 다음, TNF-α(20ng/㎖)를 24시간 동안 처리하였다. 그 후 Hs68세포의 상층액에서 MMP-1 Human ELISA kit(GE healthcare Life Sciences, USA)를 사용하여 확인하였다.
NSHRT의 항노화 및 항산화 효과에 대한 신호 전달 경로를 확인하기 위해 mitogen-activated protein kinase(MAPKs), NQO1 및 Keap1 단백질의 발현을 we stern blot을 통해 확인하고자 하였다. 60㎜ plate에 Hs68세포를 6×105cells/well이 되도록 하여 37℃, 5% CO2incubator에서 24시간 동안 배양하였다. 24시간 후 MAPKs 신호 전달 경로를 확인할 세포에는 NSHRT를 농도별(100, 200, 400 및 800㎍/㎖)로 45분간 전처리 후 TNF-α(20ng/㎖)를 15분간 추가로 처리하였고, 항산화 신호전달 경로를 확인할 세포에는 NSHRT를 농도별(100, 200, 400 및 800㎍/㎖)로 24시간 처리하였다. 그 후 phosphatase inhibitor와 protease inhibitor가 포함된 RIPA buffer를 사용하여 세포를 용해하고, 얻은 단백질은 BCA assay(Thermo fisher, USA)를 이용하여 정량하였다. 정량한 단백질에 loading dye를 첨가한 뒤 3분간 열처리하여 전하를 일치시켜주고, 10% Tris HCI gel에 단백질을 넣어 전기 영동한 다음 membrane에 transfer를 진행하였다. 단백질이 이동한 membrane은 5% skim milk로 blocking 해준 후 각각의 1차 항체를 냉장 보관의 조건에서 하룻밤 동안 부착해주었다. 그 후 membrane을 Tris Buffered Saline with Tween 20(TBST)로 5분간 5회 세척 후 2차 항체를 2시간 동안 부착해주었고, 다시 membrane을 TBST로 5분간 5회 세척한 다음 단백질을 측정하였다.
| Symbol | Gene name | Assay ID |
|---|---|---|
| GAPDH | Glyceraldehyde-3-phosphate dehydrogenase | Hs02786624_g1 |
| MMP-1 | matrix metalloproteinases-1 | Hs00899658_m1 |
Ⅲ. 실험 결과
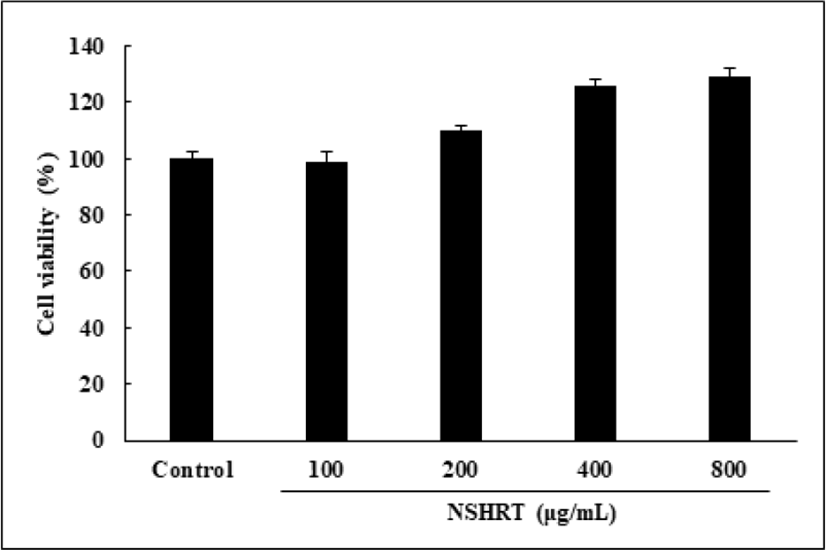
NSHRT가 Hs68 세포에서 독성을 갖는지 평가하기 위해 MTT assay를 진행하였다. Hs68 세포에 NSHRT(100, 200, 400 및 800㎍/㎖)를 24시간 동안 처리한 다음 세포 생존율을 확인한 결과, Control군에 비해 NSHRT는 99.1±3.25%, 110.1±1.62%, 125.7±2.35%, 129.2±3.11%로 나타났다. 따라서 NSHRT는 Hs68 세포에서 세포 독성을 나타내지 않았음을 확인하였다(Fig. 1).
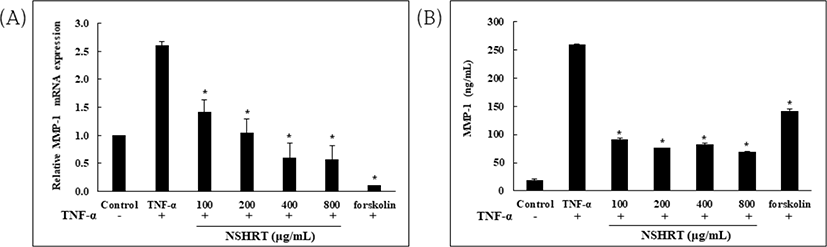
TNF-α로 유도된 MMP-1 mRNA 발현 및 단백질 분비에 대한 NSHRT의 억제 효과를 확인하였다. real-time PCR 및 ELISA kit로 측정한 결과, NSHRT의 모든 농도에서 TNF-α로 증가된 MMP-1의 mRNA 발현 및 단백질 분비를 억제한다는 것을 보여주었다(Fig. 2).
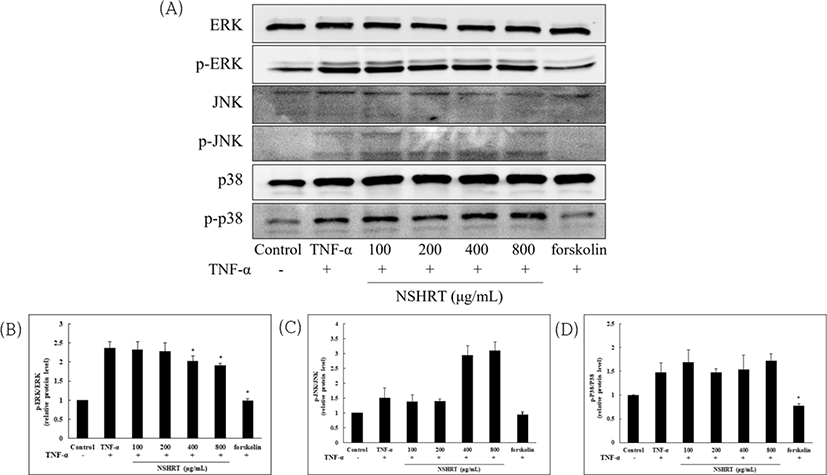
MMP-1 유전자 발현 및 분비에 MAPKs 신호 전달 경로가 중요한 역할을 한다고 알려져 있다. 따라서 Hs68 세포에서 TNF-α로 자극 된 MAPKs의 활성화에 대한 NSHRT의 효과를 조사하였다. MAPKs의 종류 중 TNF-α으로 인산화된 ERK 경로를 NSHRT(800㎍/㎖)가 유의하게 억제하였고 p38 및 JNK의 경로에는 영향을 미치지 않는 것으로 확인되었다(Fig. 3).
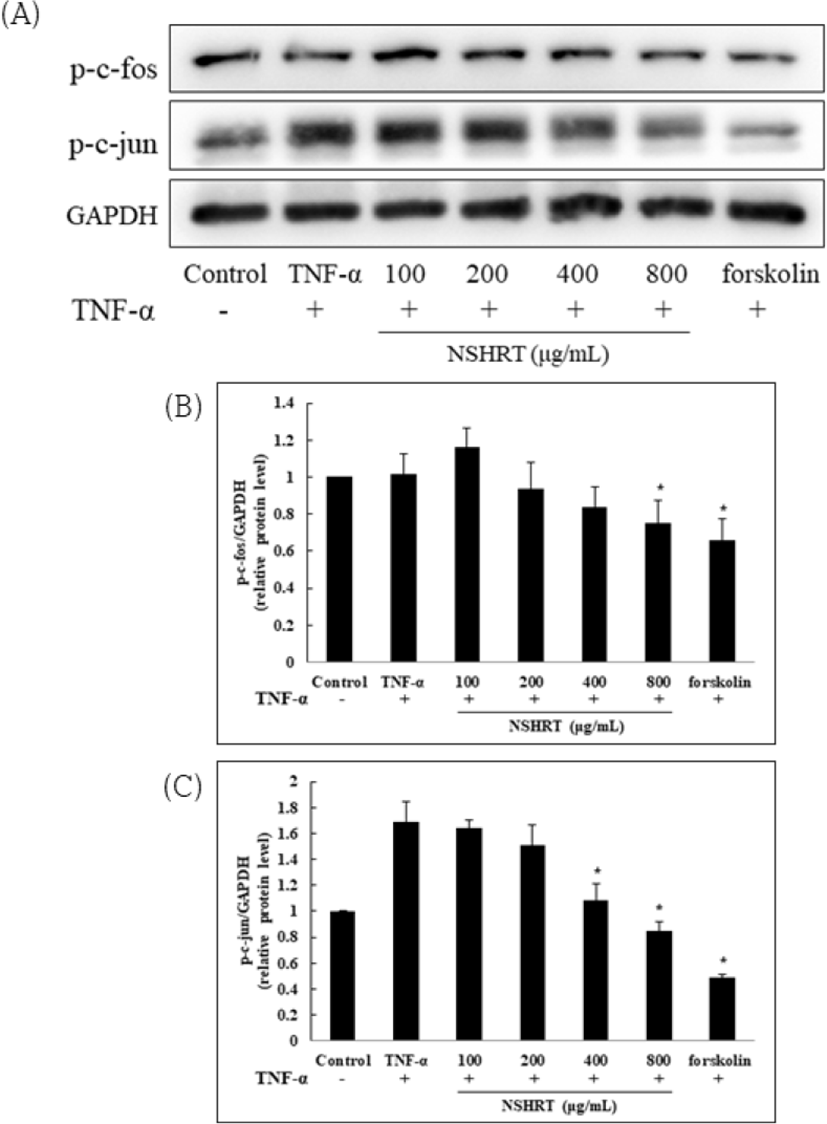
MAPKs의 하위 인자이자 MMP-1의 전사 인자인 AP-1(c-fos 및 c-jun)에 대한 NSHRT의 억제 효과를 확인하였다. 그 결과, NSHRT은 TNF-α에 의해 인산화된 c-fos 및 c-jun을 400-800㎍/㎖의 농도에서 유의하게 감소시켰음을 확인하였다. 이 결과는 NSHRT이 MAPKs경로를 따라 핵 안에서 작용하는 AP-1의 활성을 감소시킨 것으로, MMP-1에 대한 억제 효과를 확립할 수 있다(Fig. 4).
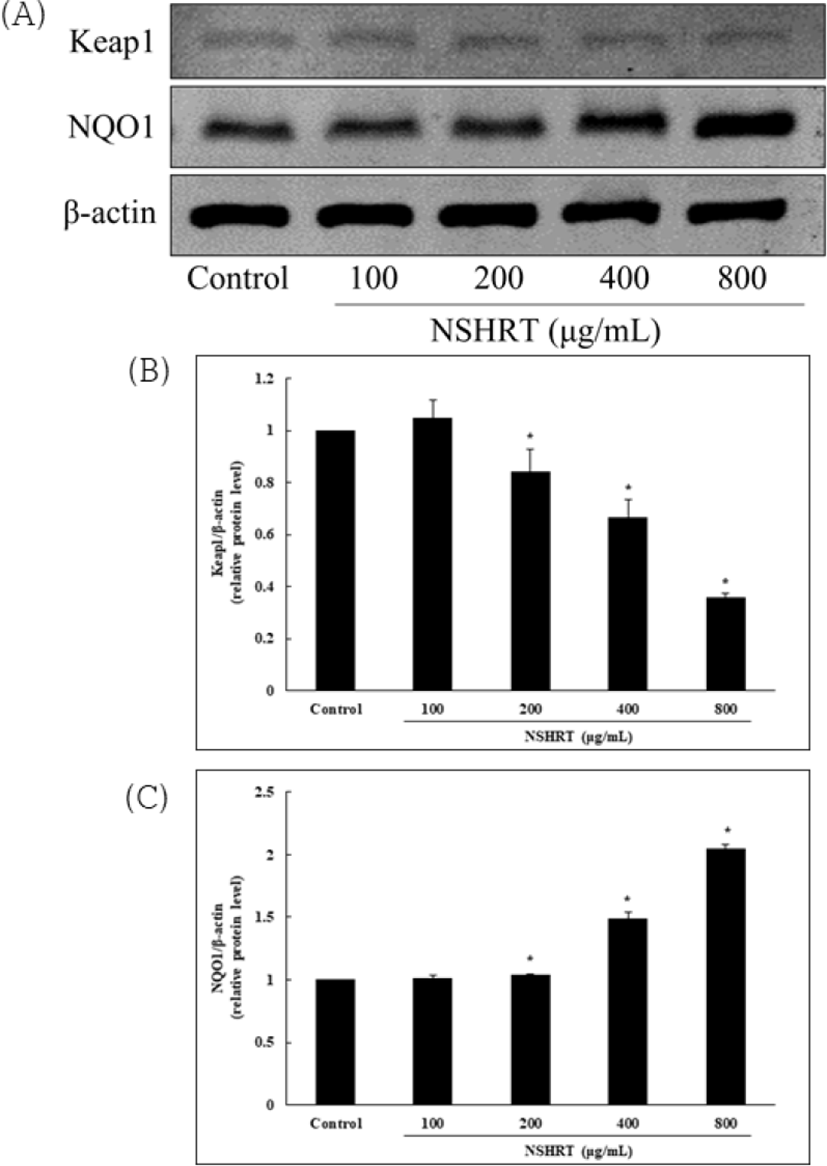
Hs68 세포에서 western blot을 통해 Keap1 및 NQO1의 단백질 발현 수준을 확인하였다. Keap1의 발현은 NSHRT의 농도가 증가함에 따라 감소하는 경향을 보였고, NQO1의 발현은 NSHRT의 농도가 증가함에 따라 증가하는 형태를 보였다. 이러한 결과는 Hs68 세포에서 Nrf2와 복합체를 이루고 있는 Keap1 단백질을 활성화시켜 감소되는 형태를 보이고, 항산화 효소인 NQO1의 발현이 증가함에 따라 NSHRT가 항산화 효과가 있음을 나타냈다(Fig. 5). Western blot을 통하여 단백질의 발현 정도를 측정하기 위해 image J(Wayne Rasband National Institutes of Health, USA)를 이용한 image analysis를 통해 확인하였다.
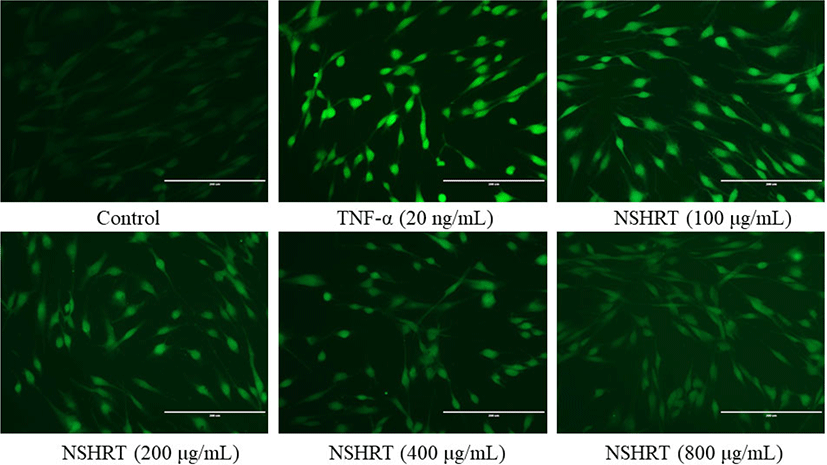
NSHRT의 ROS 억제 효과를 확인하기 위해 2’,7’-dichlorodihydrofluorescein diacetate(DCF-DA) 염색법을 진행한 결과 control군에 비해 TNF-α군에서 ROS의 생성량이 증가되었고, TNF-α와 함께 NSHRT를 농도별로 처리한 군에서는 농도가 증가함에 따라 ROS 생성량이 감소하는 것을 확인하였다(Fig. 6).
Ⅳ. 고 찰
內疎黃連湯(Naesohwangryun-tang, NSHRT)은 朝 鮮代 許浚의 《東醫寶鑑 雜病篇 癰疽》11)에 수록되어 있으며 "治癰疽, 脉洪一作沈實, 發熱煩躁, 藏府秘澁, 當先通利, 宜用此."라고 기록되어 있다. 當歸, 連翹, 赤芍藥, 大黃, 檳榔, 梔子, 黃芩, 黃連, 甘草, 桔梗, 木香, 薄荷로 구성되어 있으며 구성된 처방으로 개별 약재들의 항산화 및 항노화에 대해 다음과 같은 연구가 보고되어 있다. 當歸는 collagen의 합성 증가, MMP-1을 발현을 억제시켜 피부 노화를 유의미하게 억제하는 것으로15), 連翹는 arctigenin과 matairesinol을 함유하는 連翹 추출물이 DPPH와 superoxide radical을 소거, MMP-1의 발현을 저해하는 것으로16), 赤芍藥은 세포내 ROS 생성 억제와 NO 생성을 억제, MMP-1의 발현을 억제하는 것으로17), 大黃은 DPPH와 superoxide radical을 소거, MMP-1의 발현을 저해하는 것으로18)연구되어져 있다. 檳榔은 DPPH radical을 소거, FRAP을 활성화, 세포내 멜라닌 합성을 억제하는 것으로19), 梔子는 Tyrosinase 활성 억제를 통한 멜라닌 합성 및 생성을 억제하는 것으로20), 黃芩은 주요 flavonoid인 baicalin, wogonin, baicalein이 MMP-1의 발현 억제하는 것으로21), 黃連은 주성분인 berberine가 활성산소종을 억제, TIMP-1과 -2의 발현 조절에 의한 MMP-2,-9을 감소시키는 것으로22)연구되어져 있다. 甘草는 DPPH와 superoxide radical을 억제, MMP-1의 활성을 저해, elastase 저해를 활성하는 것으로20), 桔梗은 DPPH와 superoxide의 산화를 억제, MMP-1의 활성을 저해하는 것으로20), 木香은 ABTS와 DPPH radical을 소거, SOD 유사 활성 효과가 있는 것으로23), 薄荷는 DPPH와 superoxide 모두 억제하는 항산화 소거 활성의 효과가 있는 것으로20) 연구되어져 있다.
이 중 NSHRT의 君藥, 臣藥에 해당하는 大黃의 Chrysophanol, Emodin, Rhatannin18), 連翹의 Arctigenin과 Matairesinol16), 赤芍藥의 Astragalin17)이 collagen 합성 및 MMP-1의 합성을 저해한다는 연구결과가 있다. 이에 collagen 합성 및 MMP-1의 합성을 저해함에 따른 주름개선 등의 항노화 효능이 있을 것이라 생각되어 본 연구에서는 NSHRT의 항노화 및 항산화 기전과 효능을 연구 및 평가하였다.
콜라겐은 피부에 결합성과 탄력을 부여하여 외부의 자극으로부터 피부를 보호하는 역할을 한다. 피부 구조 중 진피층의 90%를 차지하고 있기 때문에 콜라겐의 감소는 피부의 노화와 밀접한 관계를 가진다24). 피부는 UV와 같은 자극을 받으면 피부 내 산화 스트레스의 발생으로 인해 다양한 cytokine(TNF-α, IL-1α, IL-1β, IL-8 및 IL-10)이 발현된다25). Cytokines 중 TNF-α는 대표적인 pro-inflammatory cytokine으로서 염증 반응의 매개체로 작용하며, 과발현 시 MMP-1의 활성이 증가되어 피부 내 콜라겐을 감소시킴으로서 피부 노화에 중요한 역할을 한다고 보고된 바 있다26,27). 따라서 본 연구는 TNF-α로 자극된 Hs68세포에서 ROS 생성 및 MMP-1에 대한 NSHRT의 억제 효과를 확인하기 위해 진행되었다. 먼저, Hs68세포에서 NSHRT 농도별(100-800㎍/㎖) 처리에 따른 세포 생존율을 확인한 결과 진행된 모든 농도에서 점차 증식하는 경향을 보이며, 세포 독성이 나타나지 않았음을 확인하였다(Fig. 1). 이 후 NSHRT의 항노화 효과를 확인하기 위해 MMP-1에 대한 mRNA 발현량과 단백질 분비량을 real-time PCR 및 ELISA로 확인하였다. 그 결과 NSHRT는 TNF-α로 증가된 MMP-1의 mRNA 발현 및 단백질 분비를 유의하게 억제시켰다(Fig. 2). 이를 통해 NSHRT가 항노화 효과가 있음을 입증하였고, 결과에 따라 MMP-1 발현에 대한 신호 전달 경로를 western blot으로 평가하였다.
MMP-1이 발현되는 기전의 중심에는 MAPKs가 있다. MAPKs는 extracellular-regulated protein kinase(ERK), Jun-N-terminal kinase(JNK) 그리고 p38 kinase로 구성된 신호 전달 경로로, 세포 성장과 사멸에 관여하고 cytokine 및 MMP-1의 생성을 조절한다. MAPKs의 억제제가 MMP-1의 발현을 억제한다는 연구가 있듯 노화에서도 중요한 신호 전달 경로로 알려져 있다24,28,29). MAPKs의 활성화는 전사 인자인 AP-1을 활성화 시키는데, AP-1은 c-fos, c-jun으로 구성된 복합체로 핵 안에서 MMP-1의 프로모터에 존재하기 때문에 자극이 오면 활성화되어 MMP-1을 생성시킨다30,31). 따라서 western blot 기법을 통해 MAPKs 및 AP-1의 활성화를 확인한 결과 TNF-α는 MAPKs 및 AP-1의 발현을 증가시켰으며, NSHRT의 농도별 처리는 MAPKs 경로 중 ERK의 발현만을 농도 의존적으로 감소시켰음을 확인하였다(Fig. 3). AP-1의 발현 또한 NSHRT에 의해 감소하였다(Fig. 4). 이 결과를 통해 NSHRT의 MMP-1 억제 효과를 확립하였다.
TNF-α로 인한 세포 내 ROS는 산화 스트레스를 일으켜 지질의 과산화를 유발하고, 콜라겐 및 엘라스틴 섬유의 절단 등을 일으켜 피부 노화를 가속화한다32). 따라서 산화 스트레스에 대응하기 위해서는 항산화능을 보유한 생리 활성 소재의 개발이 중요하다33). NSHRT의 경우 기존 연구에서는 NSHRT의 처리에 따른 라디칼 소거능을 확인하여 항산화 효과를 입증하였다34). 본 논문에서는 기존 연구에서 더 나아가 항산화 효소의 발현량과 TNF-α로 유도된 ROS의 생성량을 western blot 및 DCF-DA를 통해 확인하였다.
대표적으로 세포를 보호하는 기전은 주로 nuclear factor E2-related factor2(Nrf2)에 의해 조절된다. 정상 상태에서의 Nrf2는 세포질에서 Kelch-like ECH associated protein 1(Keap1) 단백질과 결합되어 있다가 산화 스트레스를 받으면 Nrf2가 Keap1에서 유리되어 핵 안으로 이동한다35). 핵 안으로 이동한 Nrf2는 전사 인자로서 작용하며 이 때 antioxidant response element(ARE)와 상호 작용하여 ARE 의존성 항산화 효소의 발현을 유도한다36). 항산화 효소는 heme oxygenase-1(HO-1), NAD(P)H dehydrogenase1 (NQO1)이 존재하며 이 효소들이 항산화 및 세포 보호 효과를 나타내는 것이다. 따라서 항산화 기전 중 Keap1 단백질과 항산화 효소인 NQO1의 발현을 확인한 결과, Control군에서는 Nrf2를 조절하는 Keap1이 존재하다가, NSHRT의 농도별 처리에 의해 Nrf2가 발현되면서 농도 의존적으로 Keap1이 감소하는 것을 확인할 수 있었다. 또한 NQO1의 발현은 NSHRT의 농도 의존적으로 유의하게 증가하는 것으로 보아 NSHRT가 항산화 효소의 생성에 도움을 주는 것으로 보인다(Fig. 5). 또한 TNF-α로 유도된 세포 내 ROS는 DCF-DA를 만나 형광을 발하는데, NSHRT의 농도별 처리에 따라 형광이 감소하는 것을 확인할 수 있었다(Fig. 6). 위 결과를 바탕으로 NSHRT는 TNF-α로 유도된 MMP-1 및 ROS를 감소시키고, 항산화 효소의 생성을 증가시켜 항산화 및 항노화 효과를 확인할 수 있었다. 향후 MAPKs의 상위 신호 전달 경로, 세포질 및 핵에서의 Nrf2 발현에 대한 추가적인 연구가 필요할 것이라 생각된다.
Ⅴ. 결 론
본 연구에서는 TNF-α로 유도된 Hs68 섬유아세포에서 NSHRT의 항노화 및 항산화 효과에 대한 기전을 연구하였으며, 다음과 같은 결론을 얻었다.
-
NSHRT에 대한 Hs68세포의 세포 생존율을 농도별(100-800㎍/㎖)로 확인한 결과, 모든 농도에서 독성이 없음을 확인하였다.
-
TNF-α로 유도된 MMP-1의 mRNA 및 단백질 분비에 대한 NSHRT의 억제효과를 확인한 결과, 농도 의존적으로 억제하였음을 확인하였다.
-
MAPKs 신호 전달 경로 활성화에 대한 NSHRT의 효과를 확인한 결과, MAPKs 경로 중 ERK 경로의 활성화를 억제하였음을 확인하였다. 또한 MAPKs의 하위 인자 및 MMP-1의 전사 인자인 AP-1의 인산화도 NSHRT의 농도 의존적으로 억제하였음을 확인하였다.
-
항산화 기전에 대한 protein을 확인한 결과, NSHRT이 항산화 효소 생산을 막는 Keap1 단백질은 농도 의존적으로 감소시키고, 항산화 효소인 NQO1 단백질은 농도 의존적으로 증가시켰음을 확인하였다.
-
NSHRT에 대한 세포 내 ROS 억제능을 확인한 결과, 세포 내 ROS가 NSHRT의 농도 의존적으로 억제하였음을 확인하였다.






