Ⅰ. 서 론
건선은 은백색의 인설을 동반한 홍반, 구진과 판을 특징으로 하는 질환이다1). 유전적 소인이 있는 사람에게 생활·환경적 요인 등의 다양한 인자가 작용하여 발병하거나 악화2)될 수 있는 건선은 국내 통계에 의하면 2015년 기준 233,909명으로 10만 명당 450명의 유병률을 보였는데, 2011년에서 2015년까지 매년 연평균 약 2%씩 증가하는 추세를 보이고 있다3). 과거에는 각질형성세포의 과각화로 인해 발생하는 피부질환으로 인식되었으나, 건선에 대한 이해도가 높아지면서 현재는 면역계 조절 이상으로 인해 발생하여 다양한 조직과 기관의 손상과 관련되는 전신 질환으로 개념이 확장되었다4).
전체론적 인체관을 가지고 있는 한의학이 비교우위를 지닐 수 있는 영역임에도 불구하고, 건선에 대한 한의계의 표준화된 치료 방법론은 존재하지 않는 실정이다. 건선에 대한 임상 진료 지침은 아직 확립되어 있지 않고, 중국의 임상 진료 지침을 바탕으로 風熱證, 血虛證, 血瘀證의 한의학적 변증 분류를 사용할 것이 2018년에서야 건선 치료용 한약제제에 대한 임상시험 가이드라인5)에서 제안된 바 있다. 이러한 현실을 반영하듯 지난 20년간 나온 한의학 임상 보고들은 모두 개별 환자별 변증을 바탕으로 한 다양한 치료 방법을 사용하고 있었다.
치료의 기준 수립을 위해 향후 변증 분류의 표준화, 처방의 표준화에 관한 연구가 시행되어야 할 것이나, 이에 앞서 치료 접근 방향의 정립이 필요하다고 보았다. 환자에 따라 건선이 발현되는 구체적 양상은 차이를 보일 수 있으나, 질환 특유의 특성 때문에 발생하는 공통점 역시 존재한다. 이러한 보편적 특성을 바탕으로 치료 접근법의 기준을 수립해 놓으면, 연구 분야 혹은 임상 현장에서 보다 합리적이고 효과적으로 치료 방법 및 치료계획을 구성할 수 있을 것이라고 보았다. 이에 건선의 병태생리 및 치료 관리에 관한 포괄적인 문헌 조사를 바탕으로 건선의 치료 접근법에 대해 탐색하고 분석하였는데, 건선의 보편적이고 종합적인 치료 방향성을 도출하여 본 논문을 통해 보고하고자 한다.
Ⅱ. 연구 대상 및 방법
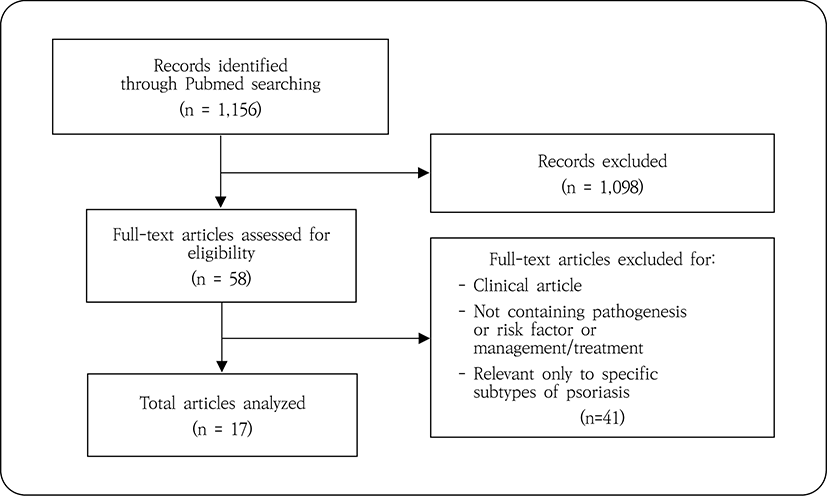
Pubmed에서 ‘Psoriasis’[MeSH Terms]를 검색어로 2016년 1월에서 2020년 6월 사이에 발표된 최신 논문을 검색하였다. 출판 언어는 영어로 한정하였으며, 건선의 발병 기전, 위험요인 또는 치료 관리법에 관한 내용을 싣고 있는 종설 논문을 선정하였다. 임상 논문, 건선의 특정 아형만을 다룬 논문은 제외하였으며, 이러한 기준에 의해 선정·배제된 논문을 대상으로 건선 치료 접근법을 탐색하였다.
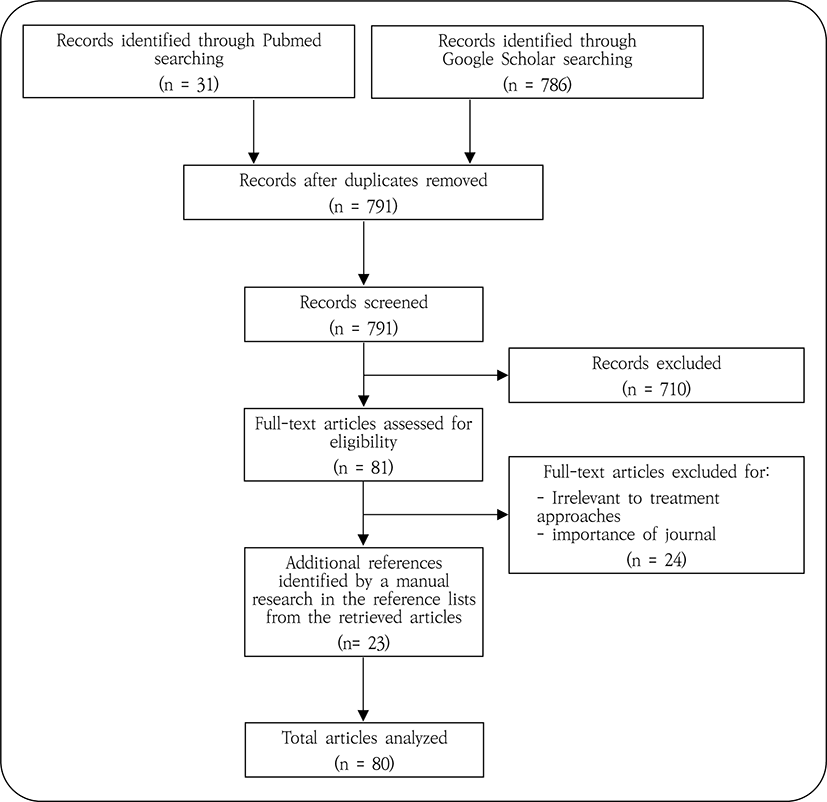
앞선 탐색 결과에 따른 건선 치료 접근법에 대한 추가적인 분석을 시행하고자 Pubmed 및 Google Scholar에서 'psoriasis' AND ('chronic inflammation' OR 'systemic inflammation'), 'psoriasis' AND ('lipid’ OR 'metabolic syndrome'), 'psoriasis' AND ('skin barrier' OR 'cutaneous barrier' OR 'epidermal barrier'), 'psoriasis' AND 'adverse effect', 'epidermal lipids' 등을 검색어로 논문 제목 검색을 시행하였다. 건선 치료 접근법과 관련된 주제를 다룬 논문들을 선별하였으며, 해당 논문들 및 앞선 치료 접근법 탐색 단계에서 선정되었던 종설 논문들의 참고문헌을 검토하여 관련성 있는 것을 추가 선정하였다. 이들 중 가능하면 2000년 이후 출판된 최신 논문을 활용하여 건선 치료 접근법에 대한 추가적인 분석 및 고찰을 시행하였다.
Ⅲ. 결과 및 고찰
건선은 선천 면역 및 적응 면역의 문제로 인해 발생하는데 그 과정에서 각질형성세포, 수지상세포, T 세포가 중요한 역할을 담당한다. 유전적 취약성을 가진 사람에게 물리적 자극, 감염, 약물 복용 등의 자극이 가해지면 항원 제시, NF-κB 신호 경로의 활성화, Th17 세포의 분화 및 IL-17의 반응성 등에 이상이 발생하여 면역반응과 면역 세포의 침윤이 촉진된다4). 그 결과 TNF-α, IL-1, IL-6, IL-17, IL-22, IL-23, VEGF, IFN-γ 등의 다양한 전염증성 매개체들이 과다 생산된다6-8). 이러한 초기 염증 반응은 피드백 신호 증폭을 통해 만성 고리와 염증기로 이어지는데, 이 기저 신호 경로는 자가 지속성을 가지기 때문에 TNF나 IL-17과 같은 핵심적인 매개체가 억제되지 않는 한 만성적으로지속되게 된다. 그리하여 건선 환자가 임상적으로 활성화된 피부 병변을 보이지 않을 때도 주요 염증 경로의 비정상적인 활성화 상태를 나타낼 수 있다9).
이러한 건선의 병태생리를 고려하였을 때, 건선 관련 보조 T 세포의 활성 혹은 염증성 사이토카인을 직접 조절할 수 있는 치료법을 건선의 치료에 활용할 수 있다. 현재까지의 연구에 의하면 IL-17 억제 효과를 보이는 청대10-13), 그리고 IL-17, IL-22, IL-23, TNF-α, IFN-γ, NF-κB 등의 조절효과를 보이는 다수의 한약14-17)이 보고된 바 있다. 또한, 건선 환자를 관리함에 있어서 피부병변이 소실 된 이후에도 추가적인 관리 기간이 필요할 수 있다는 점을 치료계획 수립 시 고려해야 한다.
건선은 피부뿐만 아니라 다른 기관계의 염증과도 밀 접한 관련이 있다고 알려져 있다. 예를 들어 염증성 장 질환(Inflammatory bowel disease, IBD) 환자의 7-11%가 건선으로도 진단된다는 연구가 있으며18-20), 건선과 크론 병의 보정 교차비(adjusted Odds ratio, aOR)는 2.49, 궤양성 대장염과는 aOR이 1.64라고 보고되기도 하였다21). 이외에도 셀리악병, 구강 점막 이상 등이 건선과 역학적 관련이 있는 것으로 알려져 있다22). 건선 환자들은 위장관계의 임상 증상이 없을 때도 현미경적 장내 염증 및 핵주위항중성구세포질항체(Perinuclear anti-neutrophil cytoplasmic antibody, pANCA)의 상승 소견을 보일 수 있다는 보고가 있었는데23-25) 이는 피부 증상이 없을 때도 염증 경로가 활성화 상태를 보일 수 있다는 앞선 연구와 상통하는 결과이다. 뿐만 아니라 위장관 증상이 없는 건선 환자의 장 점막에 대한 조직검사를 시행한 결과, 점막 고유판에서 비만세포, 형질세포, 림프구의 침윤을 발견하였고, 더불어 호중구 침윤, 선 위축, 점막 표면 이상 등의 소견이 관찰되었다는 보고가 있었다26,27). 이는 건선과 위장관 염증 간에 강한 연관성이 있음을 시사한다.
위장관계 치밀 결합의 조절인자인 claudin-3 및 장상피세포의 손상 정도를 반영하는 지표인 장지방산결합단백(Intestinal fatty acid-binding protein, I-FABP)의 혈청 농도를 측정한 결과, 건선 환자가 대조군에 비해 해당 두 지표의 수치가 높게 나타났다고 보고된 바 있는데 이는 건선 환자의 장 점막 치밀 결합이 약해져 투과성이 증가될 수 있음을 보인 것이다28). 이를 바탕으로 생각해보면 장관투과성의 증가가 건선과 염증성 장질환을 잇는 병리 기전일 수 있을 것으로 생각한다.
위장관 점막은 인체에서 가장 큰 숙주-환경 경계면을 이루고 있으며, 여기에서 각종 음식, 미생물, 기타 외부물질에 대한 방어작용을 위해 선천 면역 및 적응 면역반응이 활발히 일어나고 있다29,30). 이러한 측면들을 종합적으로 생각해보면, 건선의 치료 방법을 구성함에 있어 소화기계를 치료하는 방법을 고려할 수 있다.
건선이 복부비만, 고혈압, 이상지질혈증, 제2형 당뇨, 비알코올성 지방간 등 대사증후군과 관련이 있다는 사실은 여러 연구로부터 비교적 널리 알려져 있다31). 전 세계 20개국 46,714명의 건선 환자를 포함한 총 1,450,188명을 대상으로 한 35개 연구의 메타분석 결과 건선과 대사증후군의 aOR의 범위는 1.22-5.14였으며 pooled OR은 2.14 (95% CI 1.84-2.48)이었다32). 이는 모든 35개 연구에서 대사증후군이 있는 사람이 없는 사람에 높은 비율로 건선이 발생하는 경향을 보인다는 것을 의미함과 동시에, 종합하였을 때 그 경향성은 약 2배에 달한다는 것을 의미한다. 대사증후군과 경도, 중등도, 중증 건선의 aOR이 각각 1.22, 1.56, 1.98임을 보고한 연구도 있었고33), 이외에도 Psoriasis Area and Severity Index (PASI)와 대사증후군의 유병률 간 유의한 연관성을 보고한 여러 연구33-38)가 있었다. 한 전향적 연구39)는 건선 발병 확률이 대사증후군이 있을 경우 1.66배 높아지고 (95% CI 1.3-2.14), 허리둘레가 클 경우 1.68배, 혈청 총 콜레스테롤(serum Total Cholesterol, TC)이 높을 경우 1.26배 높아진다고 결론 내린 바 있다.
대사증후군을 이루는 하위 상태와 건선의 관계와 관련해서도 많은 선행연구가 있었다. 많은 연구들이 건강인에 비해 건선 환자의 TC, 저밀도지단백(Low Density Lipoprotein, LDL), 중성지방(Triglyceride, TG)이 유의미하게 높으며40-53), 고밀도지단백(High Density Lipoprotein, HDL)은 감소되어 있음을44,47,49,52,54,55) 보고하였다. 건강인에 비해 건선 환자가 비알코올성 지방간의 유병률이 높다는 보고도 있었으며56-58), 건선과 비알코올성 지방간은 상호 위험요인으로 작용한다는 연구가 있었다59). 또한, 비만과 건선이 상호 위험요인임을 보고한 연구도 있었다60).
이상에서 살펴본 바와 같이 건선과 대사증후군은 역학적으로 서로 연관되어 있으며 대사증후군은 건선의 위험요인으로 작용한다. 이러한 측면에서 대사증후군을 교정할 수 있는 치료법을 건선의 치료에 활용해볼 수 있다. 건선이 지속되게 되면 죽상동맥경화로, 최종적으로는 심근경색이나 뇌혈관 질환으로까지 이어질 수 있다는 건선 행진(Psoriatic march)의 개념이 제안된바 있다61). 건선과 대사증후군은 위험요인을 공유하기도 하지만, 상호 위험요인으로서도 작용한다는 것이다. 이 때문에 최근에는 건선 환자를 치료하는 데 있어 비만, 이상지질혈증, 비알코올성 지방간 등 동반 이환 질환에 대한 관리를 병행할 것이 권고되고 있다62). 이러한 측면에서 건선 환자에게 있어 대사증후군의 교정은 건선 자체의 치료뿐만 아니라, 동반 이환 질환에 대한 관리 목적으로서도 의의를 지닐 수 있다.
대사증후군과 건선의 상호관계에 대한 정확한 기전은 아직까지 명확하게 밝혀진 것이 없으나 병태생리 중 겹치는 영역이 있는 것으로 추정되고 있다. 특히 최근의 연구들은 건선과 대사증후군이 전신적인 만성 염증, 인슐린 저항성 등의 경로를 통해 병태생리가 공유되고 있다는 증거를 보고하고 있다. 건선과 대사증후군이 Th1, Th17 세포 그리고 IL-6, TNF-α와 같은 사이토카인의 과발현 같은 유사한 만성적인 염증 특성을 보인다는 것은 널리 알려진 사실이다63).
이 공통적인 병태생리의 중심에는 다시 과도한 지방의 축적이 주요 연결고리로서 작용하고 있다는 견해가 있다. 과도한 지방의 축적은 전염증성 사이토카인과 항염증성 사이토카인 간 불균형을 유발하는데, 지방조직에서 과도한 양의 TNF, IL-6, Leptin, Visfatin, Resistin과 같은 아디포넥틴이 분비되면 염증성 상태를 이루어 건선 환자에게 있어 각질형성세포 및 신생혈관의 과증식, Th1 세포의 과반응 등을 유발할 수 있다64). 이렇게 국소적으로 과생산된 전염증성 매개체는 전신 순환하며 인슐린 저항성을 높이고, 혈관 내피세포의 기능부전을 일으키고, 산화 스트레스를 높이며, 신생혈관의 생성을 촉진하고, 과응고를 촉진하는데 이들 모두는 염증성 상태를 대변한다65-67).
건선과 대사증후군의 병태를 잇는 연결고리 역할을 하는 것으로 추정되는 전신적 염증은 이미 앞서 논의한 바 있다. 그러나 건선 관련 보조 T 세포 혹은 염증성 사이토카인을 직접 조절하거나, 소화기계를 치료하는 방식이 아닌, 비만, 비알코올성 지방간, 지질 이상 등을 교정하는 방식으로도 건선의 치료에 접근해 볼 수 있을 것이다. 현재까지의 연구에 의하면 TG 감소68,69), LDL 감소69,70), 혈압 강하70), 지방간 호전68,71) 등의 효과가 생간건비탕과 관련하여 보고된 바 있다.
건선의 악화 인자 중 가장 대표적인 것 중의 하나는 물리적 자극이다. 건선 환자는 특징적인 징후로서 쾨브너 현상을 보이는데 이는 정상으로 보이는 부위가 물리적 손상을 받으면 병변이 발생하는 것이다. 실험적 연구에서 Tape stripping과 같은 경미한 자극만 가해져도 병변이 유발된다는 것이 보고되었고72), 표피에서의 Serine Palmitoyltransferase (SPT) 발현을 억제시킨 마우스 모델에서 피부장벽 기능 저하가 나타난 것은 물론이고, 생후 2주부터는 조직학적으로 각질세포의 과각화, 극세포증, 과립층의 소실, 염증 세포의 침윤과 같은 건선 병변과 매우 흡사한 상태를 보이게 되었다고 보고된바 있다73). 또한, 건선 환자의 병변부는 비병변부에 비해 경피수분손실량(Transepidermal water loss, TEWL)이 높고 장벽 회복 속도는 저하되어 있다는 연구74)가 있는데, 이러한 점을 종합해보면 피부장벽 이상은 건선의 임상 양상임과 동시에, 건선 병변 그리고 건선 특이 면역반응이 유발되는 과정에 있어 근본적인 원인으로 작용할 수 있음을 시사한다.
피부장벽의 이상은 피부장벽을 구성하는 지질 성분의 이상과 밀접한 관련이 있다. 건선 환자의 병변부에는 세라마이드 및 세라마이드 합성에 관여하는 SPT의 발현이 감소되어 있다는 연구가 있으며75), 세라마이드 성분의 변형이 발견된다는 보고도 있었다76). 건선 환자에서 표피의 총 지질, 인지질, 중성지방, 콜레스테롤이 증가한다는 것이 보고된바 있으며77,78), 기체-액체 크로마토그래피 상 현저히 낮은 스펙트럼의 단사슬지방산이 건선환자의 병변부와 비병변부에서 관찰되었다는 연구도 있었다79). 표피에서의 증가된 콜레스테롤, 인지질 수치와 건선의 중증도와의 상관관계를 밝힌 연구도 있었다79,80). 건강인은 하루에 약 85㎎의 콜레스테롤을 피부를 통해 분비하는 데 반해 건선 환자의 경우 12-23.5배 많은 양이 인설을 통해 소실된다고 알려져 있으며31), 이 때문에 과도한 콜레스테롤의 제거 수단 중 하나가 건선일 가능성이 제기되기도 하였다.
정상적인 표피의 세포 외 기질을 구성하는 지질은 세라마이드 50%, 콜레스테롤 25%, 유리지방산 15%로 이루어져있다. 이들은 층판소체 내에서 인지질, 글루코실세라마이드, 스핑고미엘린, 콜레스테롤 설페이트 등의 전구체 상태로 존재하다가 층판소체의 분비를 통해 세포 외 공간으로 이동한 뒤 SPT, HMG-CoA 환원효소(hydroxymethylglutaryl coenzyme A reductase) 그리고 지방산 합성효소(fatty acid synthase) 등의 효소에 의해 최종 형태로 변환된다.
층판소체 내부에 존재하는 지질은 주로 피부에서 자체 합성되나, 피부 외 공급원으로부터도 유래된다. 예를 들어, 필수지방산은 각질층에 많은 양 존재하는데81-83), 이는 오로지 식품 영양원으로부터만 얻을 수 있다. 또한, 글루코실세라마이드를 복용하는 경우 피부장벽 기능이 개선되었다는 연구84)가 있었다. 피부에서의 지질 합성을 인위적으로 억제하였는데도, 피부장벽의 복원이 비교적 정상적으로 이루어지는 것을 확인한 연구들이 있었는데85-87), 이는 층판소체의 형성 및 각질층의 세포간 지질층판을 복구하는데 있어 외부의 지질 자원이 활용된다는 것을 의미한다. 동물 및 임상연구에서 전신 투여한 콜레스테롤과 지방산이 표피로 이동하는 것이 확인되기도 하였으며88-91), 이 과정에는 각질형성세포에 존재하는 LDL 및 Scavenger receptor class B type 1 (SR-B1) 수용체, 그리고 표피에 존재하는 Fatty acid transport protein (FATP)과 CD36이 관여할 것으로 추정된다. 이러한 연구들을 통해 피부 외에서 유래한 지질이 표피 지질 구성에 영향을 주며, 피부장벽 항상성 유지에 기여한다는 점을 알 수 있다.
건선의 유발요인이자 악화요인으로 작용하는 피부장벽의 손상을 교정하기 위해서는 물리적 손상 방지, 보습제의 사용, 각질세포간 지질의 개선 등의 방법이 필요하다. 이 중 각질세포간 지질은 앞서 살펴본 바와 같이 전신 지질 대사와 관련이 있다. 따라서 건선의 치료 방법을 구성함에 있어 피부장벽의 회복을 목적으로 전신 지질대사를 개선하는 치료를 사용해 볼 수 있을 것이고 이는 앞서 살펴본 대사증후군의 치료와도 일부 연관될 수 있다.
2017년 국내에서 발표된 전국적인 다기관 단면 연구92)에 따르면, 건선 환자의 치료에 전신 혹은 국소 스테로이드 제제(82.3%), 국소 칼시포트리올 제제(78.3%), 전신 사이클로스포린 제제(29.1%), 전신 아시트레틴 제제(23.8%), 전신 메토트렉세이트(Methotrexate, MTX) 제제(22.2%), 생물학적 제제(5.7%)가 다용되고 있었다.
전신 스테로이드1)는 내분비계, 심혈관계, 면역계, 신경계 유해 효과 등을 보이며, 국소 제제는 이보다는 가벼운 국한된 부위의 유해 효과를 보이나 대신 발생 빈도가 높다. 국소 부작용으로서 표피·진피 위축이 흔히 나타나는데 이는 피부장벽 기능에 악영향을 끼칠 수 있다. 스테로이드는 투여 중지 시 리바운드 현상이 나타날 수 있다는 흔한 문제점을 가지고 있으며, 전신 스테로이드 복용 시 간기능 저하도 빈번하게 발생한다.
사이클로스포린1)의 가장 대표적인 유해 효과는 신기능 저하 및 고혈압이다. 또한 주로 피부에 발생하는 악성종양의 진행이 보고되어 있다. CYP3A4를 거쳐 간에서 대사되기 때문에 간기능을 저해할 수 있다.
아시트레틴1)은 비타민 A 유도체인 레티노이드로서 국소 부작용으로 피지분비 감소로 인한 건조증 등이 흔하게 발생하는데 이는 피부장벽의 기능을 저해할 수 있다. 가장 큰 유해 효과는 태아의 기형발생이다. 아시트레틴 자체는 반감기가 2-4일로 복용 2개월 뒤 체내 완전 배출이 이루어 지지만, 일부는 에트레티네이트로 변환 되는데 이는 반감기가 약 120일로 체내 완전배출까지 2년 이상이 걸린다. 이 때문에 아시트레틴 제제 복용 후 최대 3년까지는 임신 시 위험이 존재하게 된다. 이 뿐만 아니라 간에서 대사되는 레티노이드는 AST, ALT, 젖산탈수소효소(Lactate dehydrogenase, LD) 등 간 수치를 상승시키는 경향이 있으며, TG, TC, LDL, 초저밀도지단백(Very low density lipoprotein, VLDL)을 상승시키고 HDL을 감소시키는 작용력이 크다.
간에서 대사되고 신 배설되는 MTX1)는 신독성, 간독성이 대표적 유해 효과이다. 장기 복용 시93) 70% 환자에서 간기능 검사 수치의 상승이 나타났다는 보고가 있었다. 간 수치 상승, 황달, 지방간 등이 나타날 수 있으며 간조직 섬유화, 간경변이 나타날 수 있다.
생물학적 제제는 비교적 최근에 도입된 치료제로서 장기간에 걸친 인체에 대한 영향 평가 정보는 부족한 편이다. 앞서 살펴본 다른 제제에 비해 부작용에 대한 보고는 상대적으로 적으나, 건선의 치료에 사용하는 제제가 오히려 건선을 유발한 사례들이 종종 보고되고 있다. 예컨대 IBD 치료 목적으로 Etanercept, Infliximab, Adalimumab을 복용하던 중 의인성 건선이 발병한 경우가 상당수 보고된 바 있다94-96).
이상에서 살펴본 바와 같이 건선에 다용되어온 양약들은 간기능 저해, 간 섬유화, 지질 이상 등을 일으키는 경향이 있으며, 기형아 출산, 내분비계 교란, 발암 등의 중대한 유해 효과가 보고된 바 있어 보완 혹은 대체가 필요하다. 한방 단독 치료계획을 수립하는 경우, 양약 투여를 중단한 뒤 적절한 휴약기(wash-out period) 및 안정기(run-in period)가 필요할 수 있으며 이 기간은 약물의 반감기를 고려할 때 통상적으로 2-4주로 설정할 수 있다5). 건선은 만성 염증성 질환이기에 많은 수의 환자들이 이미 장기간 양약을 사용하다가 한방 의료기관에 내원하는 경우가 많으며, 한방치료를 시작하더라도 양약과의 병행 치료가 필요한 경우가 있다. 장기간에 걸친 양약 사용으로 인한 부작용을 고려하여, 환자 초기 평가 시 혈액학적 검사를 시행할 필요가 있을 것으로 생각하며, 한방치료를 선택하는데 있어 예컨대 간독성 등이 있다고 알려진 제제는 사용에 유의해야 할 필요가 있다. 양약과의 병행 치료 시행 시, 건선의 직접적 관리를 목표로 한방 치료방법을 구성할 수도 있을 뿐 아니라, 염증 상태에 대한 대증적 관리는 양약을 통해 시행하고 한방치료는 양약의 부작용을 줄여주는 방향으로 치료계획을 수립할 수도 있을 것으로 생각한다. 이와 관련하여 대표적으로 생간건비탕에 대해 간세포 보호68,97-100), 간 조직 재생99) 등의 작용이 보고된 바 있다.
Ⅳ. 결 론
건선은 단순한 피부질환을 넘어 여러 조직과 기관의 손상과 관련되는 전신 질환이기 때문에 종합적 치료 접근을 하는 것이 필요하다. 질병특유의 공통점을 바탕으로 건선의 보편적 치료 접근법을 수립하고자 포괄적인 문헌 고찰을 통해 다음과 같은 결론을 얻었다.
-
건선은 염증성 질환으로서 병태생리에 직접적으로 관여하는 Th17 세포 등의 활성 혹은 TNF-α, IL-1, IL-6, IL-17, IL-22, IL-23, VEGF, IFN-γ 등 다양한 전염증성 매개체를 조절하는 치료 방법을 사용할 수 있다.
-
건선 환자는 활성화된 피부 병변을 보이지 않을 때도 주요 염증 경로의 비정상적인 활성화 상태를 보일 수 있으므로, 건선 환자를 관리하는데 있어 피부병변이 소실 된 이후에도 추가적인 관리 기간이 필요할 수 있다는 점을 치료계획 수립 시 고려해야 한다.
-
건선과 위장관계 염증은 병리적 연관성이 있다. 건선의 치료에 위장관계에 대한 치료를 활용할 수 있다.
-
건선은 대사증후군과 상호 위험요인으로 작용한다. 건선의 치료에 대사증후군을 교정하는 치료 방법을 활용할 수 있으며, 이는 비만, 이상지질혈증, 비알코올성 지방간 등 동반 이환 질환에 대한 관리로서의 목적도 지닌다.
-
건선의 유발요인인 피부장벽 이상을 교정하기 위해서는 각질세포간 지질의 개선이 필요한데 이는 전신 지질 대사와 관련이 있다. 전신 지질 대사를 개선하는 치료 방법을 건선의 치료에 활용할 수 있다.
-
건선 치료에 다용되고 있는 양약들은 간독성, 간 섬유화, 지질 이상, 내분비계 교란 등의 유해 효과를 지니고 있다. 양약 투여를 중단한 뒤 적절한 휴약기 및 안정기가 필요할 수 있으며, 환자 초기 평가 시 혈액학적 검사를 시행하는 것이 필요할 수 있다. 양약과의 병행 치료 시, 양약의 유해 효과를 증대시킬 우려가 있는 치료법의 사용에 유의해야 하며, 양약의 유해 효과를 완화시키는 것을 목적으로 한방 치료계획을 수립할 수 있다.
건선의 병태생리에 대한 이해를 바탕으로 수립된 치료 접근법을 통해 변증 혹은 처방의 표준화와는 다른 측면에서의 한의학적 치료 방법의 기준을 세울 수 있을 것으로 기대한다.






