I. 서 론
아토피피부염(Atopic Dermatitis, AD)은 삼출물, 태선화, 소양감을 호소하고 호전과 재발을 반복하여 지속적인 관리가 필요한 만성 피부질환으로 스테로이드제, 항히스타민제, 항생제 등과 같은 약물이 사용되고 있으며1,2), 한방에서도 AD 치료제 개발을 강구하기 위해 黃連解毒湯3-7), 龍膽瀉肝湯8), 凉膈散火湯9,10) 등의 청열해독 처방을 이용한 실험연구 및 임상례가 보고되어 오고 있다.
防風通聖散(Bangpungtongseong-san, BTS)은 劉完素의 《宣明論方》11)에 처음 수록된 처방으로 모든 風熱을 치료하며, 口瘡, 痲疹, 급성 편도선염 등과 같은 上焦의 염증성 질환과 함께12) 表裏와 氣血을 조절한다13). BTS는 濕熱邪로 인한 AD에 多用되며14) 지루성피부염의 치험례15), 알레르기성 접촉 피부염16), AD에 미친 영향에 대한 실험논문17)과 같은 습진질환 연구 논문 외에도 직, 간접적으로 피부질환에 응용 가능한 논문들이 보고되어 오고 있다.
BTS의 구성 약재 중 滑石은 규산염류광물인 활석족 활석의 괴상체로 利水通淋, 祛濕斂瘡의 효능이 있어 熱淋, 石淋과 같은 비뇨기계 질환 이외에도 각종 濕疹, 濕瘡 등의 피부질환에도 다용하는 약재이다18). 발암위해성이 있는 석면형 섬유를 포함하지 않는 滑石(흡입노출)은 국제암연구소(International Agency for Research on Cancer, IARC)에서 인체발암물질로 분류할 수 없는 Group 3으로 명시했음에도 불구하고19), 2009년 식품의약품안전처의 《대한약전외한약(생약)규격집》 개정안20)에 의해 滑石 중 석면 등에 대한 수입 규격 기준이 강화되어 시중의 滑石 유통이 원활하지 못하게 되었다. 따라서 제약사의 판매용 과립 제제 및 실험목적용 구매 방법 이외에는 임상에서 전탕을 위한 滑石 약재에 대한 접근이 어려워진 실정이다.
이에 본 연구에서 저자들은 BTS의 다양한 滑石 대용법을 강구하고자 하였다. Chen21)의 연구에서 AD 및 건선에 다용하는 한약재 10가지 중에 金銀花와 地膚子를 꼽은 점, BTS의 변방으로 처방구성은 대동소이하며 각종 습진에 多用하는 加減通淸散에서 이미 滑石 대신 金銀花를 君藥으로 활용하고 있는 점22), 地膚子가 동일한 利水藥類로써 성미, 귀경, 효능 등 滑石과의 유사성을 가지고 있음18)에 착안하여, 金銀花와 地膚子가 BTS에서 滑石 대체 君藥으로 AD에 미칠 유의성 있는 결과를 보여줄 것으로 기대하였다. 또한, 간혹 임상에서 BTS의 滑石을 제외하고 피부질환에 활용하고 있음에 따라 滑石을 제외한 BTS의 효과에 대한 연구의 필요성을 느껴 본 실험을 진행하였다.
본 실험에서는 滑石을 제외, 또는 滑石을 金銀花나 地膚子로 대체하여 君藥으로 활용한 加減防風通聖散(GagamBangpungtongseong-san, GBTS)의 AD에 대한 효과를 비교, 관찰하고자 DNCB로 생쥐에 AD를 유발시킨 후, 체중 변화, 귀의 무게와 두께, 등의 피부 두께를 측정하였다. 또한 등 피부의 피부질환 증상 발현 정도를 살피기 위해 육안적 관찰을 시행하였으며, H&E stain, toluidine blue stain을 시행하여 생쥐의 등 피부를 조직병리학적 관찰을 하였다. In vitro와 in vivo 실험을 통해 비장세포, 흉선세포의 증식율을 측정하고, 혈청에서의 IL-4와 TNF-α, IgE 함량변화를 분석하여 유의성 있는 결과를 얻었기에 보고하는 바이다.
Ⅱ. 재료 및 방법
실험에 이용한 처방은 滑石을 제외한 BTS(GBT) (Table 1), 滑石을 제외하고 金銀花를 가미한 GBTS(加減防風通聖散 加 金銀花, GagamBangpungtongseong-sangageumeunhwa, GBTG)(Table 2), 滑石을 제외하고 地膚子를 가미한 BTS(加減防風通聖散 加 地膚子, GagamBangpungtongseong-sangajibuja, GBTJ) (Table 3)의 3종의 BTS 加減方이며, 구성 약물은 동신대학교 목포한방병원에서 구입하여 사용하였다. 그 처방내용 및 1첩 당 분량은 각각 아래와 같다.
BTS에서 변형된 3종의 복합처방 경구투여용 시료를 제조하기 위해 GBT, GBTG, GBTJ 각각의 처방을 증류수(D/W) 1,500㎖와 함께 100℃로 4시간 동안 열수 추출한 뒤 감압농축기 (Eyela, Japan)을 이용하여 침전물과 찌꺼기를 제거한 상층액을 농축하였다. 농축된 용액을 동결건조기 (Ilshin, Korea)로 동결 건조하였으며 수득율(Table 4)은 아래와 같다. 이를 생리식염수에 각각 희석하여 10일간 경구투여용 시료로 사용하였으며 투여량은 500mg/㎏/day 의 농도로 하였다.
| Prescription title | Total amount (g) | Freeze-dried weight (g) | Yield (%) |
|---|---|---|---|
| GBT | 147 | 25.4 | 17.3 |
| GBTG | 175 | 26.7 | 15.3 |
| GBTJ | 177 | 25.9 | 14.6 |
생쥐의 DNCB로 유발된 AD 부위에 사용할 도포용 시료 제조를 위해 GBT, GBTG, GBTJ 각각 처방을 70% 에탄올에 넣어 24 시간 추출하고 농축하였으며, 그 농축용액을 동결건조하여 얻은 수득율(Table 5)은 다음과 같다. 이를 에탄올에 녹인 뒤 AOO에 희석하여 도포용 시료로 사용하였다. 이때 1회 도포량은 혼합액 50㎕이며 4mg/㎖의 농도로 도포하였다. 도포 부위는 등 부위로 하고 도포시간은 오후 2시로 일정하게 시행하였으며, AD 유발액인 혼합용액을 바르는 시일이 겹치는 경우 최소 4시간 이상의 시간 격차를 두고 진행하였다.
| Prescription title | Total amount (g) | Freeze-dried weight (g) | Yield (%) |
|---|---|---|---|
| GBT | 220 | 28.37 | 12.9 |
| GBTG | 265 | 20.77 | 7.89 |
| GBTJ | 265 | 30.39 | 11.5 |
생쥐에게 AD 유발을 위하여 1% DNCB와 AOO액의 혼합용액을 먼저 귀 부위에만 3일간 30㎕을 1일 1회 도포하였고, 3일 후 등 부위의 AD 유발을 위하여 제모를 시행하였다. 호흡 마취제인 isoflurane(Hana Pharm. Korea)과 O2를 2.5% 농도로 혼합하여 흡입 마취시킨 뒤 마취된 생쥐의 등 부위를 중심으로 전기면도기(Panasonic ER806A, Japan)를 사용한 1차 제모하였다. 도포용 주걱으로 크림용 제모제(Veet, Rerckitt Benckiser, France)를 도포하고 5-10분 방치한 다음 온수를 거즈에 묻혀 제모제를 제거하여 2차 제모를 한 뒤, 24시간 방치하였다.
제모 시행 24시간 후 isoflurane(Hana Pharm. Korea)을 이용하여 호흡 마취를 시킨 생쥐의 등, 귀 부위에 3일간 1% DNCB와 AOO액의 혼합용액을 도포하였으며, 등 부위에는 혼합용액 50㎕, 귀 부위에는 30㎕씩 1일 1회 도포하였다. 도포 후 3일간의 경과관찰을 한 뒤 등 부위에 GBT, GBTG, GBTJ 도포를 시작하였고, 동시에 2일 간격으로 총 5회 AOO와 DNCB의 혼합 용액을 귀에 30㎕, 등에 50㎕씩 각각 도포하였다.
DNCB 혼합용액 도포 및 3종의 GBTS 투여 및 도포의 과정을 표로 정리하면 다음과 같다(Table 6.).

3종의 GBTS의 효능을 관찰하기 위해 실험군의 설정은 Normal(AD를 유발하지 않고 식염수를 도포한 후 식염수 경구투여한 군), Control(AD 유발 후 식염수 경구투여와 AOO 도포를 시행한 군), GBT(AD 유발 후 GBT 시료를 경구투여 및 도포한 군), GBTG(AD 유발 후 GBTG 시료를 경구투여 및 도포한 군), GBTJ(AD 유발 후 GBTJ 시료를 경구투여 및 도포한 군)로 총 5개 군으로 분류하였다. 실험군의 개체수는 normal군은 5마리, control군은 9마리, GBT, GBTG, GBTJ군은 각각 10마리로 실험하였다.
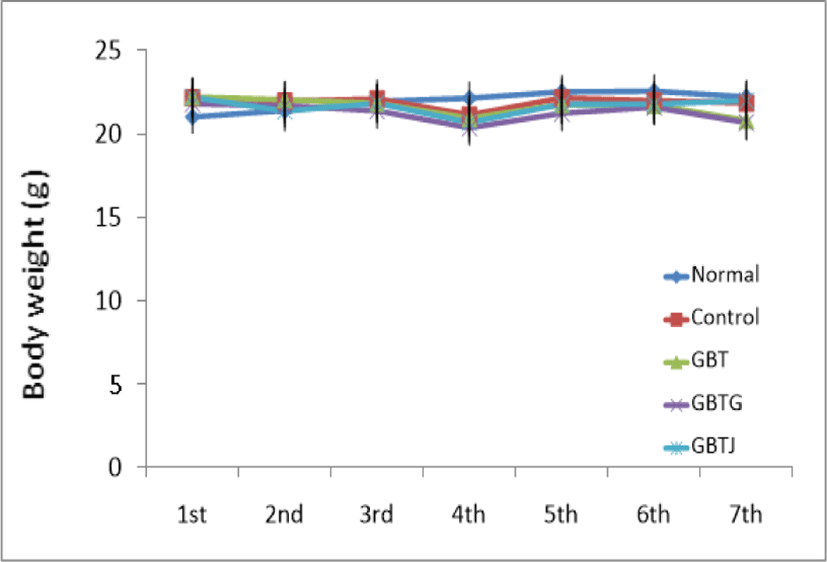
실험 기간 중 총 7차례 생쥐의 체중을 측정하였다. 체중의 측정은 전자저울(Hana KC-200, Korea)을 사용하여 측정일 오후 1시경 일정하게 시행하였으며, 마지막 체중 측정은 생쥐를 희생시키기 직전에 실시하였다.
실험이 모두 종료된 생쥐를 희생시킨 후 가위로 절제한 귀를 다시 수동 펀칭기를 통해 직경 5㎜의 원형 절편으로 규격화시킨 후 미량 저울(Ohaus, USA)로 좌우 측 무게를 측정하였다.
실험이 종료된 생쥐를 희생시킨 후 절제한 등 피부와 수동 펀칭기를 사용하여 절제한 귀의 두께를 디지털 캘리퍼(Mitutoyo, Japan)를 이용하여 측정하였다.
각 군별 생쥐의 背部를 디지털 카메라(Samsung WB1000, Korea)로 촬영하였고, 아래와 같은 판정 기준에 따라 피부 병변 정도를 관찰하여 수치화하였다(Table 7).
실험이 종료된 후 생쥐를 희생시키고 등 부위 피부 조직을 절제하여 10% 포르말린에 고정하고 파라핀에 포매하였다. 포매된 조직을 미세절단기(Sakura, Japan)를 이용하여 4㎛ 두께로 박절하고 슬라이드에 부착시킨 뒤 탈수와 투명과정을 거쳐 흐르는 물에 침전시켰고 파라핀을 제거한 후 조직 절편을 각각 Hematoxylin & Eosin(Sigma, USA), Toluidine blue(Sigma, USA)로 염색하였다. 이후 과염색된 부분을 흐르는 수돗물에 씻은 뒤 재차 탈수, 투명과정을 거쳐 봉입하고 400배(H&E stain)와 100배율(Toluidine blue stain)로 광학현미경(Olympus, Japan)을 사용하여 관찰하였다. H&E stain을 통해서 표피의 세포층을 주로 관찰하였고, toluidine blue stain으로는 주로 진피 내 mast cell의 분포 및 탈과립 양상을 관찰하였다.
실험 시작 전 어떠한 약물도 처치하지 않은 생쥐의 비장에서 비장세포(splenocyte)와 흉선에서 흉선세포(thymocyte)를 각각 추출한 후, 이들의 부유액을 RPMI 1640 배지로 희석하였다. 그리고 5.0× 105cells/well 농도로 96-well plate에 접종하고 24시간 배양을 거치게 한 뒤, 3종의 GBTS 열수추출물을 각각 농도별로 처리하였다. 다시 24시간 배양 후 각 well에 Ez-cytox 15㎕를 첨가하여 차광상태로 2시간 배양 후 각 well의 흡광도(optical density, OD)를 microplate reader(Bio-Rad, USA)를 사용하여 450nm에서 측정하였다.
실험기간 동안 AD 유발 및 3종의 GBTS 투여와 도포가 이루어진 생쥐를 희생시킨 뒤 비장에서 비장세포를 적출하여 부유액을 RPMI 1640 배지로 희석하였다. 5.0×105cells/well 농도로 96-well plate에 접종하고 Ez-cytox 15㎕를 각 well에 첨가한 뒤 차광상태에서 2 시간 배양을 하였고 그 후 각 well의 흡광도를 microplate reader(Bio-Rad, USA)를 통해 450nm에서 측정하였다.
-
① 혈청 내의 IL-4의 수치를 측정하기 위하여 채혈 후 원심분리시켜 분리한 혈청과 mouse IL-4(R&D, USA) kit를 사용하여 측정하였다. 각 well에 assay diluent RD1-18 50㎕와 standard, control, serum 50㎕를 첨가하고 cover를 덮어 1분 mixing, 실온 2시간 방치를 시행하였다. 그 후 1× wash buffer 400㎕로 5회 washing하고 mouse IL-4 conjugate 100㎕를 첨가한 뒤 cover를 덮고 재차 실온 2시간 방치를 시행하였다. 다시 1× wash buffer 400㎕로 5회 washing 후 이번에는 substrate solution 100㎕를 첨가하고 cover를 덮은 뒤 실온 30분 방치하였다. 발색반응을 중지시키기 위해 plate에 stop solution 100㎕를 넣고 microplate reader(Bio-Rad, USA)로 450nm에서 흡광도를 측정하였다.
-
② TNF-α 양 측정
혈청 내의 TNF-α(Tumor necrosis factor-alpha) 수치를 측정하기 위해 mTNF-α ELISA kit(Novex, USA)를 이용하였다. 혈청 및 standards 100㎕를 96-well plate에 넣고 biotin conjugate 100㎕를 첨가하고 실온에서 90분 방치한 뒤 washing buffer를 이용하여 4회 세척하였다. 이후 각 well에 streptavidin-HRP를 100㎕씩 분주하고 실온 30분 방치 후 washing buffer를 통해 4회 세척을 거쳤다. 그리고 각 well에 stabilized chromogen을 100㎕씩 분주하고 차폐된 실내에서 30분 방치시킨 후 각 well에 반응 중지를 위해 stop solution을 100㎕씩 주입한 다음 microplate reader(Bio-Rad, USA)로 450nm에서 흡광도를 측정하였다.
-
③ IgE 측정
혈청 내 IgE 측정을 위해 mouse IgE ELISA kit(Abcam, UK)를 이용하였다. 각 well에 standard, zero control, serum 100㎕를 넣은 후 cover를 덮은 상태에서 1분 mixing, 실온에서 30분 방치하였다. 1× wash buffer를 이용하여 4회 washing 한 뒤 1× enzyme-Antibody conjugate 100㎕를 첨가한 뒤 plate cover를 덮어서 실온에서 30분간 방치하였다. 1× wash buffer로 4회 washing하고 이번에는 TMB substrate solution 100㎕를 첨가한 다음 cover를 덮고 실온에서 10분간 방치하였다. 다음 plate에 stop solution 100㎕를 넣고 발색반응을 중지시킨 후 microplate reader(Bio-Rad, USA)로 450nm에서 흡광도를 측정하였다.
Ⅲ. 결 과
실험 기간 동안 총 7회에 걸쳐 체중을 측정한 결과, normal군에 비해 DNCB로 AD를 유발한 다른 실험군이 4차 측정 이후로 체중이 감소하는 경향이 보였으나 통계적인 유의성은 관찰되지 않았다(Table 8, Fig. 1).
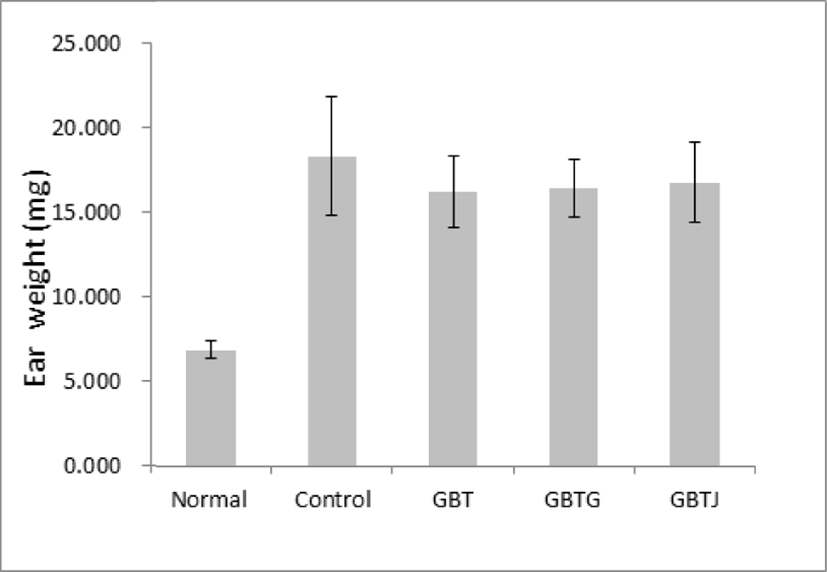
AD 유발 생쥐에 GBTS 투여가 생쥐의 귀 무게에 미치는 영향을 관찰하기 위하여 실험이 끝난 생쥐를 희생시킨 후 일정한 크기로 절제한 귀의 무게를 측정하였다. 이를 관찰한 결과 control군에 비해 GBTS를 투여한 모든 실험군에서 무게의 감소가 보였으나 통계적인 유의성은 없었다(Table 9, Fig. 2).
| Groups | Ear weight (mg) |
|---|---|
| Normal | 7±1 |
| Control | 18±3 |
| GBT | 16±2 |
| GBTG | 16±2 |
| GBTJ | 17±2 |
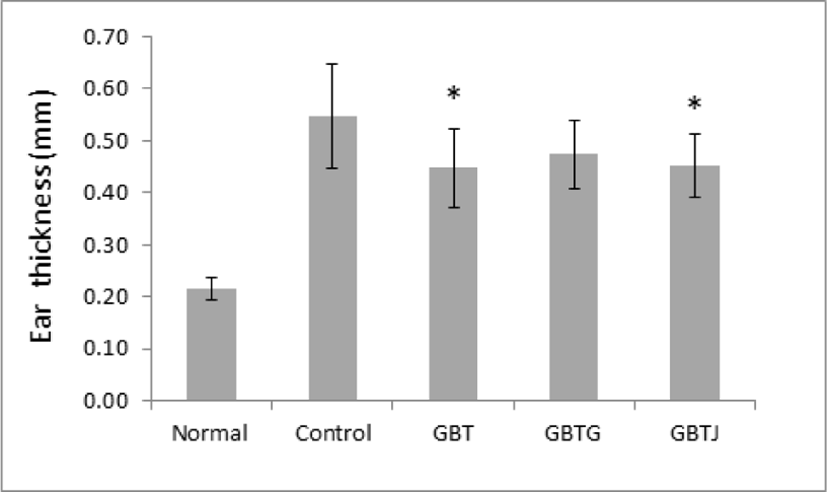
AD 유발 생쥐에 GBTS 투여가 생쥐의 귀 두께에 미치는 영향을 관찰하기 위하여 실험이 끝난 생쥐를 희생시 킨 후 절제한 좌우측의 귀의 두께를 디지털 캘리퍼로 측정하여 평균값을 산출하였다. 관찰 결과 control군에 비해 GBTS 투여군 모두 얇아진 것으로 관찰되었으며, 이 중 GBT와 GBTJ군에서 통계적으로 유의성 있게 얇아졌다(Table 10, Fig. 3).
| Groups | Ear thickness (㎜) |
|---|---|
| Normal | 0.22±0.02 |
| Control | 0.55±0.10 |
| GBT | 0.45±0.08* |
| GBTG | 0.47±0.07 |
| GBTJ | 0.45±0.06* |
Normal: naive group(n=5), Control: AD-induced and no treatment group(n=9), GBT: AD-induced and GBT treat group(n=10), GBTG: AD-induced and GBTG treat group(n=10), GBTJ: AD-induced and GBTJ treat group(n=10). Values are represented as mean±SD. *: Indicates significant difference from control group(*P<0.05).
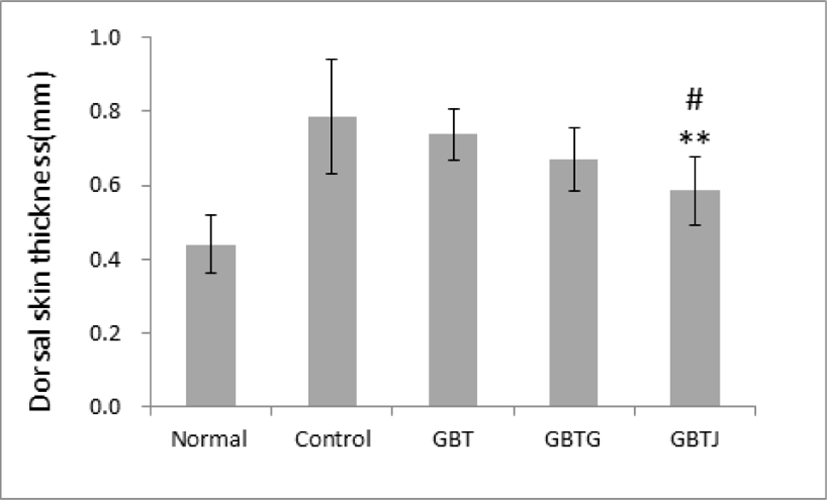
실험이 끝난 생쥐를 희생시킨 후 일정한 크기로 등 부위의 피부를 절제한 후, 절제된 등 부위의 피부를 디지털 캘리퍼를 이용하여 두께를 측정한 결과 control군에 비해 GBTS 투여군에서 모두 얇아진 것이 관찰되었다. 이 중 GBTJ군에서 control군에 비해 유의하게 얇아졌으며, GBTS 투여군 중에서도 GBTJ군이 GBT군에 비해서도 유의하게 얇아진 것으로 관찰되었다(Table 11, Fig. 4).
| Groups | Dorsal skin thickness (㎜) |
|---|---|
| Normal | 0.44±0.08 |
| Control | 0.79±0.15 |
| GBT | 0.74±0.07 |
| GBTG | 0.67±0.09 |
| GBTJ | 0.59±0.09**,# |
Normal: naive group(n=5), Control: AD-induced and no treatment group(n=9), GBT: AD-induced and GBT treat group(n=10), GBTG: AD-induced and GBTG treat group(n=10), GBTJ: AD-induced and GBTJ treat group(n=10). Values are represented as mean±SD. **: Indicates significant difference from control group(*P<0.01). #: Indicates significant difference from GBT group(#P<0.05).
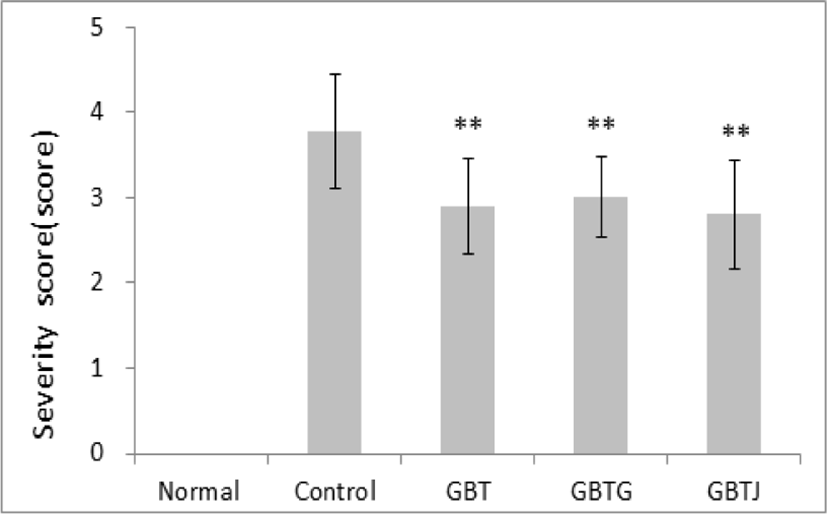
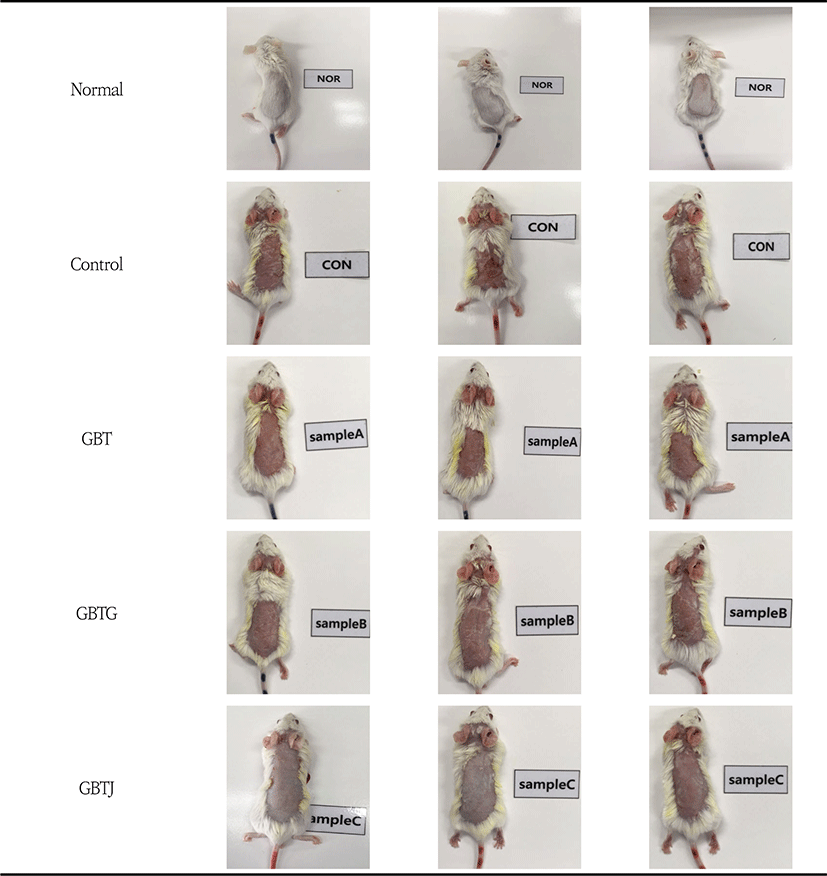
3종의 GBTS 투여에 따른 가시적인 증상 개선을 관찰하기 위하여 등 부위 증상의 변화 정도를 5점 척도로 정량화하였다. AD를 유발하지 않은 normal군의 등 피부에 비해 DNCB로 AD를 유발한 다른 실험군은 확연하게 피부 홍반, 낙설 등의 피부 이상 증상이 관찰되었다. Control군과 GBTS 투여군 사이에서는 각각의 약물을 도포 및 투여한 GBT, GBTG, GBTJ의 모든 군에서 control군에 비해 유의하게 AD 증상이 개선되었음을 관찰할 수 있었다(Table 12, Fig. 5-6).
| Groups | Severity score |
|---|---|
| Normal | 0 |
| Control | 3.78±0.67 |
| GBT | 2.90±0.57** |
| GBTG | 3.00±0.47** |
| GBTJ | 2.80±0.63** |
Normal: naive group(n=5), Control: AD-induced and no treatment group(n=9), GBT: AD-induced and GBT treat group(n=10), GBTG: AD-induced and GBTG treat group(n=10), GBTJ: AD-induced and GBTJ treat group(n=10). Values are represented as mean±SD. **: Indicates significant difference from control group(**P<0.01).
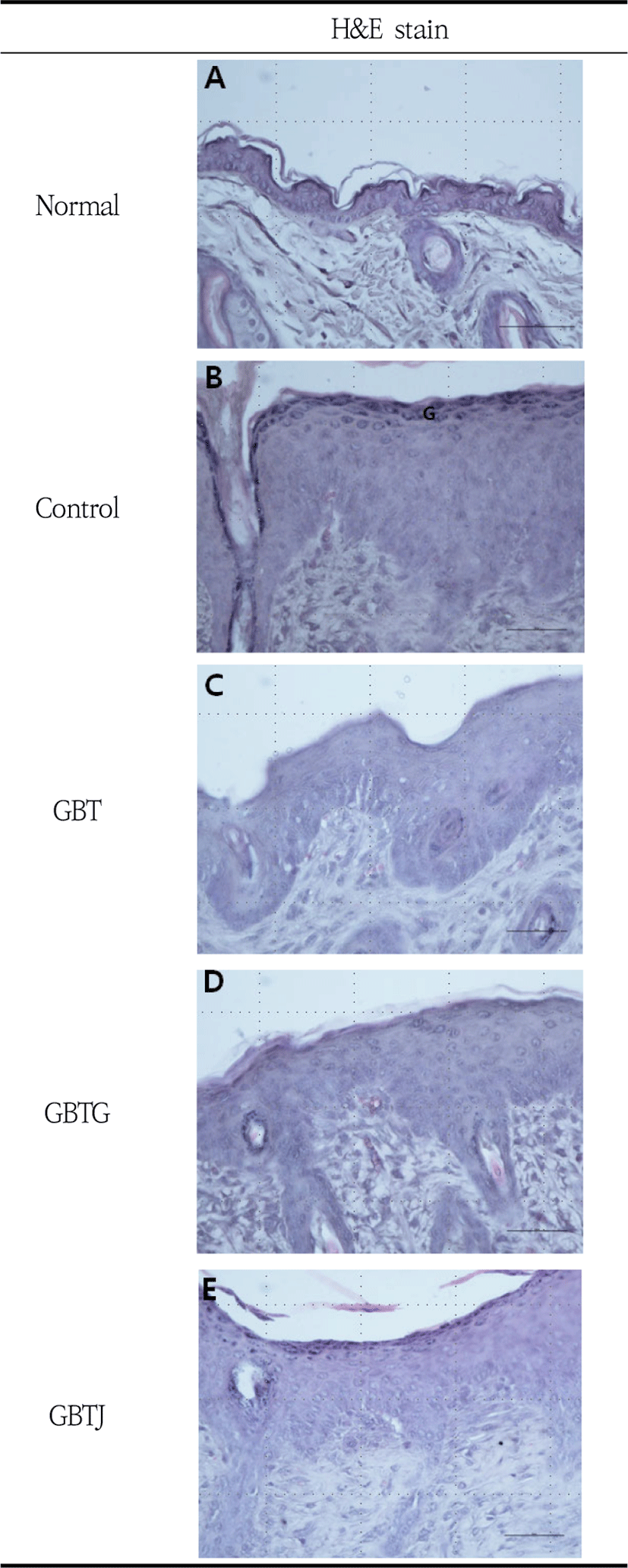
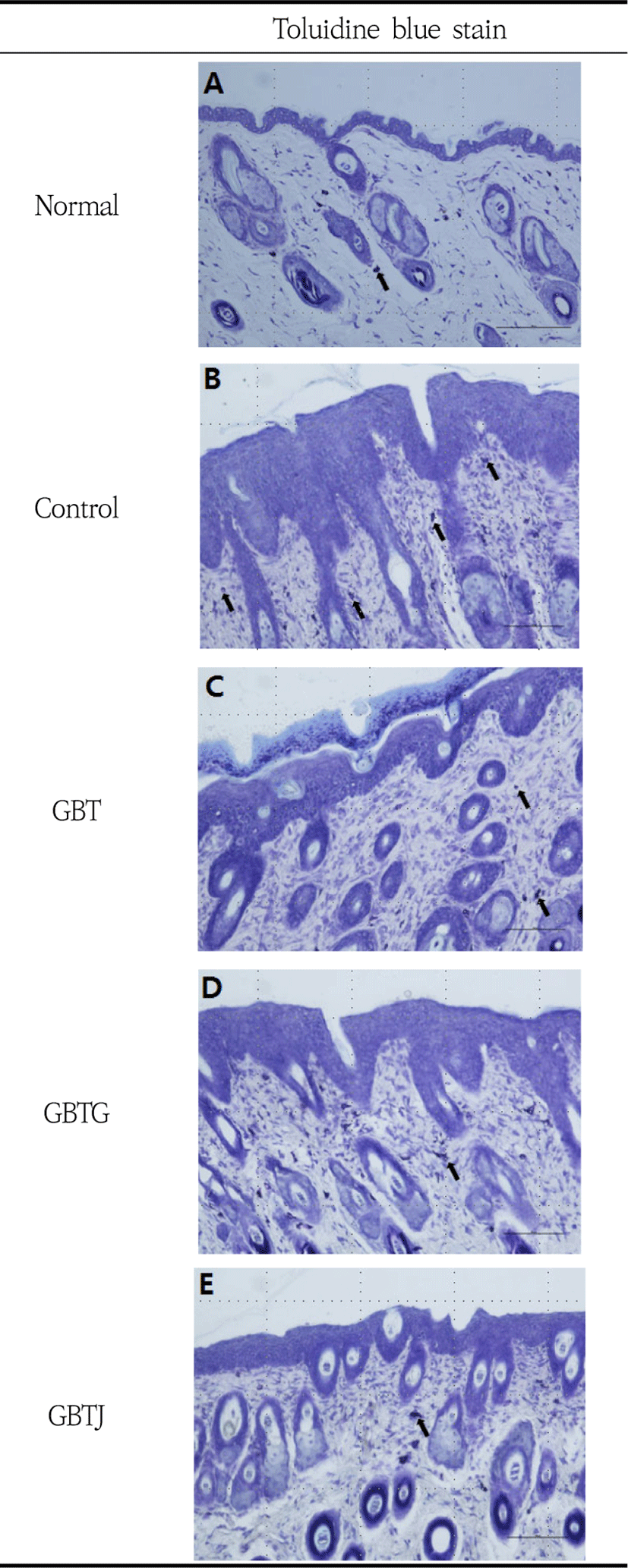
표피층을 관찰하기 위하여 H&E stain을 시행한 조직 소견을 살펴보면 normal군 표피의 바닥층은 줄기세포 한 층을 이루고 있었고 가시층과 과립층 또한 대부분 한 층으로 관찰되었다(Fig. 7-A). Control군의 표피는 정상군에 비하여 매우 두꺼웠으며 바닥층의 줄기세포들은 정상군에 비하여 세포분열이 왕성하였다. 또한 가시층 세포는 5-6층을 이루고 있었으며, 많은 각질유리질(keratohyalin) 과립을 내포하고 있는 과립층 세포 는 3-4층으로 관찰되었다. 각질층은 표면이 매끄럽지 않았으며 불연속적인 형태를 보여주었으며, 탈락된 각 질은 정상군에 비하여 두꺼웠다(Fig. 7-B). GBT군의 표피는 전반적으로 정상군에 비하여 두껍고 대조군에 비하여 얇게 나타났으며 바닥층 줄기세포는 정상군에 비하여 세포분열이 왕성하였다. 가시층은 2-3층으로 관찰되었으며, 과립층은 대부분 2층으로 관찰되었으나, 각질유리질 과립과 각질층은 뚜렷하지 않았다(Fig. 7-C). GBTG군의 표피는 정상군보다는 두껍고 대조군보다는 얇게 나타났으며 바닥층 줄기세포의 분열은 GBT군처럼 활발하였다. 가시층은 약 3층으로 관찰되었고 과립층은 대부분 2층으로 관찰되었으나 각질유리질 과립은 뚜렷하지 않았다. 각질층은 불연속적이었으나 탈락된 각질층은 비교적 얕게 관찰되었다(Fig. 7-D). GBTJ군의 표피는 전반적으로 정상군에 비하여 두껍고 대조군에 비하여 얇게 나타났으며 바닥층 줄기세포의 분열은 왕성하였으며 가시층은 2-3층으로 관찰되었다. 과립층 또한 2-3층으로 관찰되었는데 control군에서처럼 각질유리질 과립들이 뚜렷하였고, 각질층은 비교적 뚜렷하게 관찰되었다(Fig. 7-E). Toluidine blue stain 결과, 대조군에서는 많은 수의 mast cell이 관찰되었으나, GBT, GBTG, GBTJ군에서는 모두 대조군에 비하여 현저히 적은 mast cell이 관찰되었다(Fig. 8).
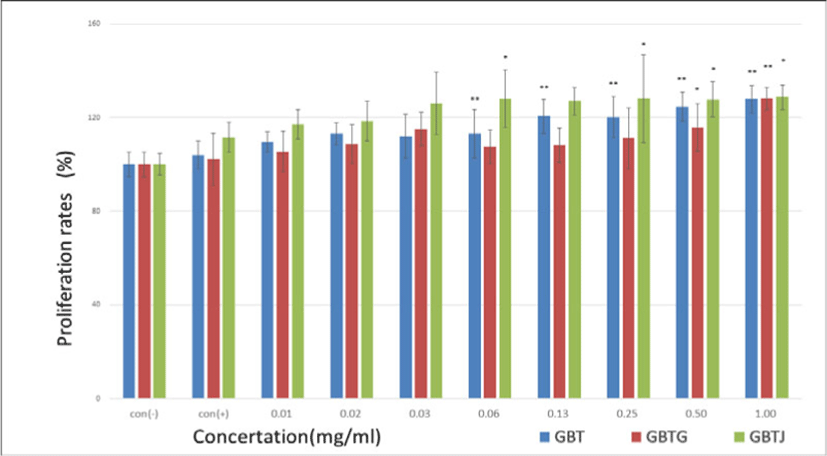
약물 등을 처치하지 않은 생쥐의 비장에서 비장세포를 추출한 후 열수 추출된 각각의 시료를 농도별로 처 리하고 비장세포의 증식율을 관찰하였으며 이때 측정값은 LPS를 투여하지 않은 con(-) 군을 기준하여 백분율로 표시하였다. 관찰 결과 대체로 시료의 농도가 증가할수록 증식률도 증가하는 경향이 보였으며, 특히 GBT군과 GBTJ군은 이러한 경향성이 뚜렷하였고 GBTG군은 증가하였다가 감소 후 다시 증가하는 패턴을 보였다(Table 13, Fig. 9).
Con(-): GBTSs and LPS not treated group, Con(+): GBTSs not treated and LPS treated group, GBT: BTS except talcum, GBTG: GBT added Lonicerae Japonicae Flos, GPTJ: GBT added Kochiae Fructus. Values are represented as mean±SD. *: Indicates significant difference from control(+) group(*P<0.05). **: Indicates significant difference from control(+) group(**P<0.01).
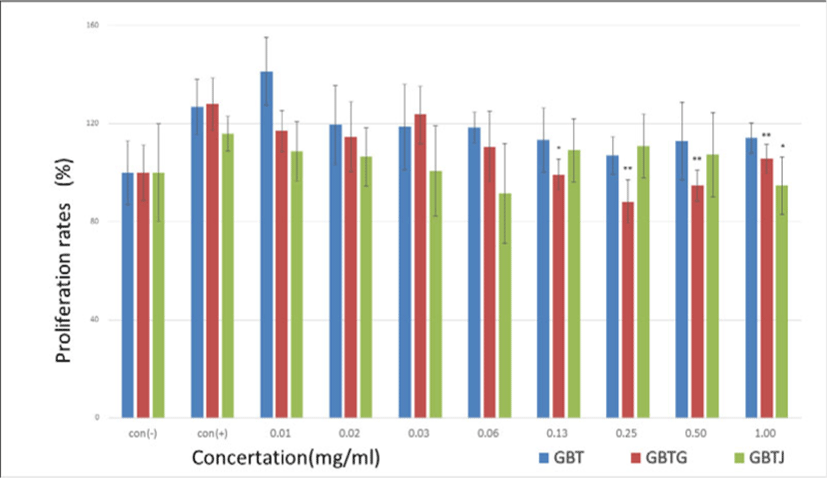
약물 등을 처치하지 않은 생쥐의 흉선에서 흉선세포를 추출한 후 열수 추출된 각각의 시료를 농도별로 처리하고 증식률을 관찰하였으며 이때 측정값은 LPS를 투여하지 않은 con(-) 군을 기준하여 백분율로 표시하였다. 관찰결과 대체로 시료의 농도가 증가할수록 증식률은 con(+)군에 비해 대체로 감소하는 경향을 보였으며 그 중 GBTG군에서 감소하는 폭이 가장 컸다(Table 14, Fig. 10).
Con(-): GBTSs and LPS not treated group, Con(+): GBTSs not treated and LPS treated group, GBT: BTS except talcum, GBTG: GBT added Lonicerae Japonicae Flos, GPTJ: GBT added Kochiae Fructus. Values are represented as mean±SD. *: Indicates significant difference from control(+) group(*P<0.05). **: Indicates significant difference from control(+) group(**P<0.01).
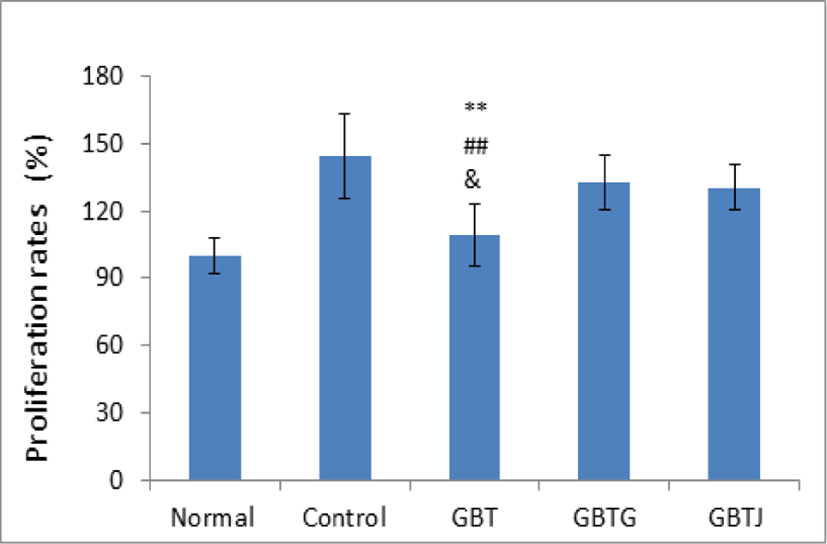
실험 기간 동안 약물 처리를 모두 거친 생쥐를 희생시킨 후, 비장에서 비장 세포를 분리하여 비장세포의 증식율을 측정하였다. LPS 미투여군인 normal군을 기준으로 하여 백분율로 표시하였다. 관찰 결과 control군에 비해 모든 GBTS 실험군들이 감소하는 경향이 보였으며, 특히 GBT군은 control군 뿐만 아니라 GBTG와 GBTJ군과도 유의성 있게 비장세포 증식률이 감소되었음을 관찰할 수 있었다(Table 15, Fig. 11).
| Groups | Proliferation rates (%) |
|---|---|
| Normal | 100.0±8.03 |
| Control | 144.4±18.82 |
| GBT | 109±13.71**,##,& |
| GBTG | 132.8±12.22 |
| GBTJ | 130.6±10.26 |
Normal: naive group(n=5), Control: AD-induced and no treatment group(n=9), GBT: AD-induced and GBT treat group(n=10), GBTG: AD-induced and GBTG treat group(n=10), GBTJ: AD-induced and GBTJ treat group(n=10). Values are represented as mean±SD. **: Indicates significant difference from control group(**P<0.01). ##: Indicates significant difference from GBTG group(##P<0.01). &: Indicates significant difference from GBTJ group(&P<0.05).
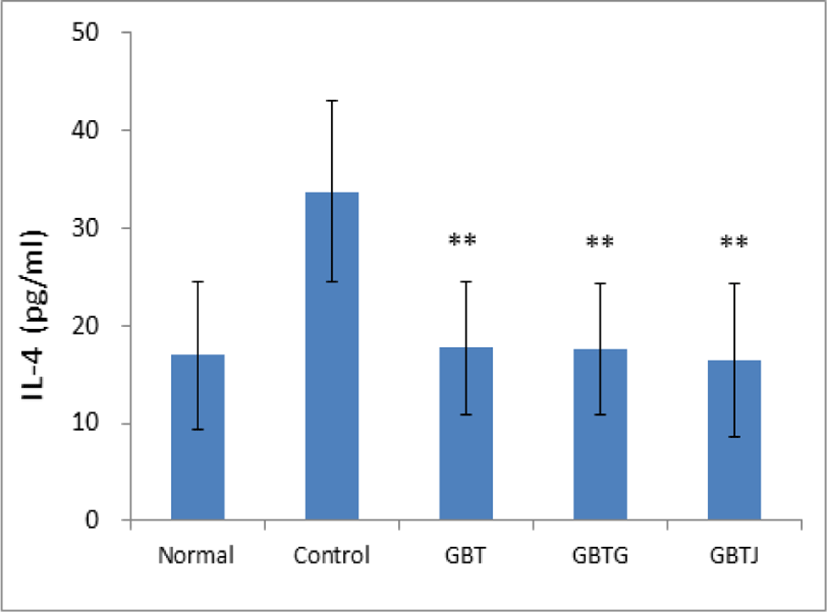
실험 종료 후 희생시킨 생쥐의 혈청을 분리하여 IL-4 수치를 측정하였다. 측정 결과 control군에 비해 GBT, GBTG, GBTJ군 모두에서 통계적으로 유의하게 IL-4 수치가 감소한 것을 관찰할 수 있었다(Table 16, Fig. 12).
| Groups | IL-4 (ng/㎖) |
|---|---|
| Normal | 16.97±7.55 |
| Control | 33.75±9.30 |
| GBT | 17.68±6.89** |
| GBTG | 17.53±6.75** |
| GBTJ | 16.45±7.90** |
Normal: naive group(n=5), Control: AD-induced and no treatment group(n=9), GBT: AD-induced and GBT treat group(n=10), GBTG: AD-induced and GBTG treat group(n=10), GBTJ: AD-induced and GBTJ treat group(n=10). Values are represented as mean±SD. **: Indicates significant difference from control group(**P<0.01).
실험 종료 후 희생시킨 생쥐에서 혈청을 분리하여 TNF-α의 함량을 측정하였다. 측정 결과 control군에 비해 GBT, GBTG 그리고 GBTJ군 모두에서 통계적으로 유의하게 TNF-α 수치가 감소한 것을 확인할 수 있었다(Table 17, Fig. 13).
| Groups | TNF-α (ng/㎖) |
|---|---|
| Normal | 18.31±1.07 |
| Control | 23.76±3.33 |
| GBT | 18.77±1.31** |
| GBTG | 19.30±1.31** |
| GBTJ | 18.82±1.38** |
Normal: naive group(n=5), Control: AD-induced and no treatment group(n=9), GBT: AD-induced and GBT treat group(n=10), GBTG: AD-induced and GBTG treat group(n=10), GBTJ: AD-induced and GBTJ treat group(n=10). Values are represented as mean±SD. **: Indicates significant difference from control group(**P<0.01).
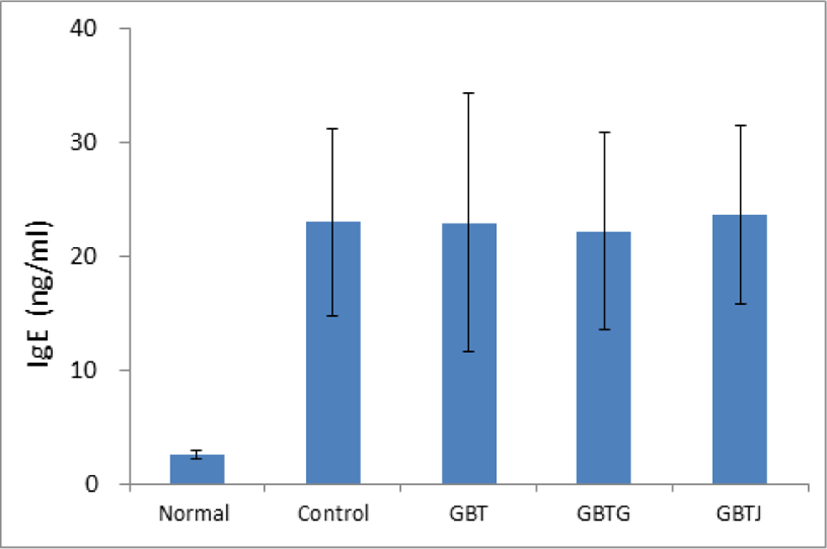
실험 종료 후 희생시킨 생쥐에서 혈청을 분리하여 IgE 함량을 측정하였다. 측정 결과 normal 군과 AD가 유발된 다른 군간의 차이는 확연하게 관찰되었으나, control 군과 3종 GBTS의 IgE 함량 차이는 관찰할 수 없었다(Table 18, Fig. 14).
| Groups | IgE (ng/㎖) |
|---|---|
| Normal | 2.6±0.3 |
| Control | 23.1±8.2 |
| GBT | 23.0±11.3 |
| GBTG | 22.2±8.7 |
| GBTJ | 23.7±7.9 |
IV. 고 찰
AD에 대해 한의학에서는 병인을 胎中積熱(유전적인 소인), 動風化熱食物(부적절한 식생활), 濕熱로 보고 병인에 따른 변증을 통해 健脾, 淸熱, 利濕, 消風止痒, 滋陰養血의 치법을 사용하여 다양한 내, 외치를 시행한다23). AD의 치료방법으로는 기본적으로 적절한 습도 유지가 권장되고 있으며 국소 및 전신적인 부위에는 로션, 연고 형태, 경구 형태의 스테로이드제를 사용하나, 내성 및 피부위축 등의 스테로이드 부작용 위험으로 인해 단기간 사용이 권장된다. 또한 선택적으로 항히스타민제, 항생제 치료, 광선치료 등의 치료법이 활용되고 있으나1), 근본적인 치료와 더욱 효과적인 치료법 개발을 위하여 한의학적인 치료법에 대한 연구가 활발히 이루어지고 있다.
BTS는 劉의 《宣明論方》에 처음 수록되었으며 熱, 風, 燥의 3 가지 病因을 치료하며 表裏가 모두 實할 경우에 사용하는 처방이다11,12,24). BTS의 처방 구성 약재를 살펴보면, 滑石, 梔子는 水熱毒을 소변으로 排泄시키고, 石膏와 桔梗은 肺胃의 熱을 끄며, 連翹와 黃芩은 해독, 청열작용을 하고, 防風, 麻黃, 荊芥, 薄荷, 生薑은 風熱邪를 發散시키며, 大黃, 芒硝는 胃腸間의 熱毒을 대변으로 排出시키고, 白朮, 甘草은 脾胃를 조화롭게 하며, 川芎, 當歸, 赤芍藥은 肝血을 다스린다18). BTS는 回春凉膈散을 기본방으로 하였으며, 濕熱邪로 인한 AD 치료에 多用되어온 처방이다14).
BTS에 대하여 최근 비만에 대한 효능25-40), 항산화 및 면역효과41,42), 피부미백효과43), 고혈압 및 심혈관계에 미치는 영향44-52), 관절염에 미치는 영향53), BTS의 독성54,55), 독성 물질에 대한 해독성56,57), 항알러지 효과58-61), 각종 피부질환에 미치는 영향15-17,62) 등 다양한 방면의 연구가 진행되었다. 특히, 손 등17)은 AD 생쥐모델에서 BTS가 호산성백혈구 감소 및 피부손상 완화, PKC 억제, NF-κB 활성억제를 통해 항염증 작용을 할 수 있음을 보고하였다. 그러나 BTS의 구성 약재 중 하나인 滑石은 2009년 고시된 식품의약품안전처의 《대한약전외한약(생약)규격집》 개정안20)에 의거하여 수입 한약재 항목 중 정밀검사 대상이 되어 규격 기준에 맞는 약재의 유통량이 점차 적어지게 되었다. 滑石은 苦, 寒하고 膀胱, 胃에 작용하여 利水通淋, 祛濕斂瘡의 효능이 있으며18), AD에 활용 가능한 광물성 약재이다63). 석면이 포함된 滑石은 호흡기에서 독성을 나타내지만19,64,65), 석면형 섬유를 포함하지 않는 滑石(흡입노출)은 IARC에서 명시한 인체발암물질로 분류할 수 없는 Group 3에 속함에도 한약재로서의 접근성이 떨어지게 되었다19).
그로 인해 BTS의 원방 사용을 위한 방법으로 과립제제 사용 혹은 실험용 목적으로 滑石을 구매하는 것 이외에는 탕전 사용에 대한 접근이 어려워지게 되었다. 임상에서는 흔히 滑石을 제외하거나, 滑石을 제외하고 石膏를 증량하여 사용하기도35) 하는 등 다양한 방면으로 BTS를 활용해보고자 하는 시도가 있었다. 따라서 본 저자는 BTS의 활용에 대한 추가적인 실험연구가 필요하다고 생각하였으며, 대만에서 실시된 분석연구에서 金銀花와 地膚子를 AD, 건선의 다빈도 활용약재로 선정한 점21)에 착안하여 金銀花나 地膚子를 君藥으로 사용한 GBTS, 또는 BTS에서 滑石을 제외한 GBTS가 DNCB를 통해 AD가 유발된 생쥐에게 미치는 영향을 실험적으로 알아보고자 하였다.
金銀花는 인동과(Caprifoliaceae)에 속한 인동덩굴의 花蕾이며, 甘, 寒하며 肺, 胃, 大腸에 귀경하며 淸熱解毒, 散風熱, 養血止血의 효능이 있어 熱毒으로 인한 癰癤, 腸癰, 肺癰, 血痢, 痢疾등의 염증성 질환에 쓰인다18,66). 2010년 이전 10년의 연구 동향에 의하면, 항산화효과, 항염증효과, 피부 관련 연구 등이 다수 보고 되었으며67), 2010년 이후에도 피부질환에 응용할 수 있는 다양한 항산화, 항염증 효과 등과 더불어 항암효과, 항균작용 등에 대한 연구가 꾸준히 진행되어 오고 있다68-74). 유 등6)은 金銀花 약침은 AD에 효과가 없었으며, 안 등75)은 金銀花가 NF-κB 활성 억제를 하여 iNOS 조절을 시켜 AD에 항염증효과로 작용할 수 있다는 실험연구를 발표하기도 하였다. 특히 金銀花가 포함된 처방 중에서 加減通淸散21)은 BTS의 변방으로 처방 구성은 대동소이하며, 滑石 대신 金銀花가 君藥이 되어 장미색 비강진, 한포진, 알레르기성 피부염, AD 등과 같은 습진 피부질환을 치료한 다수의 임상 치험례76-82)가 보고되었으나, DNCB를 통한 동물실험연구는 현재까지 진행되지 않았다.
地膚子는 명아주과(Chenopodiaceae)의 1년생 본초인 댑싸리의 과실로 苦, 寒하고 腎, 膀胱에 작용하며 淸熱, 利濕祛風止痒의 효능이 있어서, 下焦의 濕熱을 소변으로 排泄시키고, 皮膚瘙痒, 濕疹, 濕熱瘡毒에 사용한다18). 최 등83)은 地膚子 추출물이 피부 태선화와 과각질화를 억제하며 IL-1β, TNF-α, NF-κB, MAP kinase를 조절함을 밝혔고, 조 등84)은 地膚子의 메탄올 추출물이 TNF-α, IFN-γ, MCP-1을 감소시켜 항염증 반응을 나타냄을 연구하였다. 또한 나 등85)은 HIF-1α의 단백질 발현 감소를 통한 신생혈관 생성 억제, 항산화 효과에 대한 연구를 보고하였고, 김 등86)은 地膚子의 外用이 소양감, 홍반, 팽진을 감소시킴을 밝혔으며 이외에도 地膚子 추출물에 대한 항소양 효과87), 항알레르기 효과88) 등의 다양한 연구가 진행되어 오고 있다. 특히 地膚子와 滑石은 苦, 寒하며 膀胱에 작용하여 소변으로 濕熱을 내보내는 利水藥類로18) 성미, 효능의 유사성과 기존의 地膚子에 대한 연구를 바탕으로 BTS에서 滑石에 대한 地膚子의 대체를 통하여 AD에 미칠 영향에 대해 유의성 있는 결과를 예상하였다.
이에 본 연구에서는 normal군, control군, BTS에서 滑石을 제외한 GBT군, BTS에서 滑石을 제외하고 金銀花를 가미한 GBTG군, BTS에서 滑石을 제외하고 地膚子를 가미한 GBTJ군의 다섯 가지 비교군을 대상으로 하여 실험을 진행하였다.
실험기간 동안 실험동물에 급격한 체중감소의 부작용89)이 발생할 수 있음을 인지하고, 마지막 희생 직전을 포함하여 총 7회에 걸쳐 생쥐의 체중측정을 하였다. Normal군을 제외한 나머지 실험군은 4차 측정 이후 체중이 대체로 감소하였으나 유의한 정도의 차이는 보이지 않았으며(Table 8, Fig. 1), 이는 실험동물에 대한 부작용이 크게 나타나지 않았음을 나타낸다.
DNCB로 피부염을 유발한 생쥐에서는 귀와 같은 국소부위의 부종과 그에 따른 무게 증가가 관찰되며, 약물 처치를 통한 수치 변화의 차이는 항염증 효과에 대한 평가지표90)가 된다. 3 종의 GBTS가 AD 유발 생쥐의 귀의 무게와 두께에 미친 영향을 알아보기 위하여 실험 종료 후 희생된 생쥐의 귀 절편을 미량 저울과 디지털 캘리퍼로 측정하였다. 본 실험 결과, 귀의 무게를 측정한 결과 GBT, GBTG, GBTJ군 모두 대조군에 비해 감소하였으나, 유의성은 보이지 않았다(Table 9, Fig. 2). 귀의 두께는 GBTS 3종을 투여한 실험군이 대조군에 비해 평균적으로 더 얇아졌으며, GBT(P<0.05), GBTJ(P<0.05)군은 귀 두께가 대조군에 비하여 유의성 있는 감소를 보였다(Table 10, Fig. 3).
Ceramide는 sphingolipids 분해산물인 sphingosine과 지방산이 결합한 것으로, sphingosine은 protein kinase C(PKC)를 억제하여 세포분열을 감소시킨다. AD는 피부의 ceramide가 감소하고 PKC가 활성화 되어 세포분열이 증가하게 된다91,92).
먼저 3종의 GBTS 실험군이 등 피부 두께에 미치는 영향을 관찰한 결과, GBT, GBTG, GBTJ군에서 대조군에 비하여 모두 얇아진 경향을 보였으며, GBTJ (P<0.01)군은 대조군에 비하여 유의성 있게 얇아졌다. 특히, GBTJ(P<0.05)군이 GBT군에 비하여 유의성 있는 두께 감소를 보였다(Table 11, Fig. 4).
GBTS 실험군들이 등 피부에 미친 영향을 알아보기 위해 먼저 색소침착, 홍반, 낙설, 혈흔과 같은 피부 병변의 심각도에 따라 5점 척도로 판정 기준을 세우고(Table 7) 육안적인 관찰을 하였다. 그 결과, 대조군과 약물 투여 실험군들은 모두 홍반, 낙설 등의 피부 이상이 나타났으며, GBT(P<0.01), GBTG(P<0.01), GBTJ (P<0.01)군 모두 대조군에 비하여 유의성 있게 피부 이상 증상이 호전되었다(Table 12, Fig. 5-6). 따라서 GBT, GBTG, GBTJ군들이 AD 피부의 이상 증상 호전에 유효한 효과를 보임을 알 수 있었다.
피부조직의 병리학적인 변화를 관찰하기 위하여 실험 종료 후 희생된 생쥐의 등 피부를 절제하여 H&E stain과 toluidine blue stain을 시행하였다. H&E stain 결과, GBT, GBTG 그리고 GBTJ 군은 AD가 유발되어 기저층의 세포분열이 왕성하였고, 표피층의 두께는 normal 군보다는 두꺼웠으나 control군에 비해서 두께가 얇게 관찰되었으며, 과립, 과각화가 감소되었다(Fig. 7).
비만세포는 여러 염증매개물질들을 분비하여 소양감, 두드러기 등의 염증반응을 유발하며, 침윤하여 피부를 전체적으로 비후하게 한다93). 비만세포의 침윤을 살피기 위해 toluidine blue stain으로 진피조직을 관찰한 결과 mast cell의 수가 많은 차이를 보였다. Control군에서 가장 많은 수의 비만세포가 관찰되었으며 GBTS를 투여한 실험군에서는 normal군에 비하여 다소 많은 수의 비만세포가 관찰되었으나 control군에 비해 현저하게 적게 관찰되었다(Fig. 8). 이와 같은 결과는 GBTS들이 피부층의 두께 증가 억제와 비만세포 침윤을 감소시킴으로써 AD 치료에 유효한 효과를 가질 수 있다는 것을 보여준다.
비장은 각종 전신적 염증, 면역염증성 질병 등 질병의 발생과 진행에 반응을 나타내며93), 비장동맥을 통해 항원과 림프구들을 공급받는다. 또한 비장은 항원을 Th림프구에 전달하고, Th림프구는 B림프구를 활성화시키며 활성화된 B림프구는 형질세포로 분화하여 면역글로불린 IgG, A, M, D, E를 생성한다2).
본 실험에서는 AD 생쥐에 GBT, GBTG, GBTJ군의 생체 내외의 면역학적 활성 억제 효과를 확인하기 위해 비장세포의 증식율을 관찰하였다. 약물처리를 하지 않은 생쥐의 비장에서 비장세포를 추출하고 각 실험군을 농도별로 처리하여 대조군에 비하여 비장세포의 증식률을 관찰한 결과, GBT군은 0.06mg/㎖ 이상(P<0.01)에서 유의한 수준으로 증가하였으며, GBTJ군은 0.13mg/㎖을 제외하고 0.06mg/㎖ 이상 (P<0.05)에서 대체로 유의하게 증가하였다. GBTG군은 농도에 따라 점차 증가하다가 0.03mg/㎖에서 잠시 감소한 뒤 0.50mg/㎖(P<0.05), 1mg/㎖(P<0.01)에서 다시 유의하게 증가하였다(Table 13, Fig. 9). 모든 실험이 종료된 후 생쥐의 비장세포를 추출하여 비장세포의 증식률을 관찰한 결과, 대조군에 비해 모든 실험군에서 감소하는 경향을 보였으나 GBT(P<0.01)군은 대조군에 비하여 유의성 있는 감소를 보였다. 특히 GBT(P<0.01)군은 GBTG군에 비해 유의한 감소를 보였으며, GBT(P<0.05)군은 GBTJ군에 비하여 유의성 있게 감소하였다(Table 15, Fig. 11). 이는 GBTS 실험군들이 in vitro 상의 비장세포 증식률에서는 농도에 따라 증가하여 면역반응이 더욱 유발되는 것으로 추측하였으나, in vivo 실험에서는 오히려 증식률이 감소하여 면역학적 활성도가 억제되었으며, 金銀花와 地膚子를 가미하지 않은 GBT군이 GBTG, GBTJ군에 비해 염증반응을 더욱 억제시킨다는 사실을 관찰 할 수 있었다.
흉선에는 흉선세포라는 미성숙한 T세포가 피질에 대부분 수질에 소수 모여 있으며, class I, Ⅱ MHC 분자와 외부의 항원만을 인식할 수 있는 항원 특이성을 가지지 못한 흉선세포는 glucocorticoid에 의해 제거된다. 흉선세포는 CD4+ T cell과 CD8+ T cell로 분화되며 각각 사이토카인 분비와 대식세포 활성화를 시킨다2,94,95). AD 생쥐에 GBTS 실험군이 흉선세포에 미치는 영향을 살펴보기 위해 약물 처치를 하지 않은 생쥐의 흉선세포를 추출하여 농도별로 처리한 후 증식률을 관찰하였다. 대체로 모든 실험군에서 대조군에 비해 흉선세포 증식률이 감소하는 경향을 나타냈으며, GBTJ군이 1mg/㎖(P<0.05)에서, GBTG군이 0.13mg/㎖(P<0.05), 0.25mg/㎖ 이상(P<0.01)에서 유의성 있는 감소를 보였다(Table 14, Fig. 10). 이는 GBTS가 AD 유발 생쥐의 면역반응 억제에 유효하였음을 나타낸다.
AD는 급성일 경우에는 Th2 cell이 편향적인 발달을 보이며 Th2 반응으로 IgE 증가, 피부염증이 유발되고, 만성으로 진행될 시 Th1 사이토카인이 증가하여 염증반응이 심화된다93). IL-4는 T cell, 비만세포, NK cell, neutrophil, eosinophil이 분비하여 B 림프구의 생성과 증식을 통해 IgE의 생산 증가를 돕는 사이토카인이다95). 본 연구에서 혈청 내 IL-4의 함량 변화를 관찰한 결과, GBT(P<0.01), GBTG(P<0.01), GBTJ(P<0.01)군에서 모두 대조군에 비하여 유의한 감소를 보여(Table 16, Fig. 12) GBTS 실험군들이 AD의 Th2 세포면역 반응 억제를 통한 항염증 효과가 있음을 알 수 있었다.
TNF-α는 Th1 세포반응과 관련되어있으며 전구염증인자로 과도하게 활성화될 시 염증 질환의 병리작용을 유발시킨다. 단핵구, 대식세포, 비만세포, B cell, T cell 등에서 생성되며, 혈관내피세포에 작용하여 백혈구의 혈관 외 유주를 유도하고 세포독성을 항진시킨다2,95). 본 연구에서 혈청 내 TNF-α 함량 측정 결과, GBT(P<0.01), GBTG(P<0.01), GBTJ(P<0.01)군의 TNF-α가 대조군에 비하여 유의성 있게 감소하였으며(Table 17, Fig. 13) GBTS 실험군이 Th1 세포반응을 억제시키는 것으로 추측된다.
IgE는 비만세포 및 호염구의 Fc 부위에 결합하는 주 면역글로불린으로 즉시형 과민반응 관련 매개물질을 분비하게 한다. 평소 IgE는 혈청 내에 낮은 농도로 존재하나, 알레르기성 질환의 초기에는 농도가 증가하며95,96), DNCB로 AD를 유발한 생쥐에서 대조군 마우스에 비해 혈장 내 IgE가 유의성 있는 증가를 보여 Th2 반응이 더 활성화된다는 연구 보고가 있었다97). 본 실험에서 혈청 내 IgE의 농도를 측정한 결과, 실험군들의 유의한 변화는 보이지 않았다(Table 18, Fig. 14).
이상의 결과로 미루어 보아, 滑石을 제외하거나 滑石을 金銀花 또는 地膚子로 대체한 GBTS는 AD의 귀, 등 두께 감소, 임상적인 증상 경감, 비만세포 침윤 감소, IL-4, TNF-α 감소를 통한 항염증 반응으로 DNCB로 유발된 AD에 대해 유효한 효과가 있는 것으로 생각된다. GBT군이 아토피피부염을 호전시킨 점은 BTS 원방에서 滑石이 제외되었음에도 다른 구성약재들의 효능으로 인해 피부 이상 증상이 경감된 것으로 보인다. 3종 GBTS 실험군을 비교, 관찰한 결과, 등 두께 비교실험에서 GBTJ군이 타 실험군에 비해 유의성 있는 감소가 있었으며, in vivo 상 비장세포 증식률 관찰에서 GBT군이 유의한 감소를 얻었다. 비록 실험군 간 비교에서는 일관적으로 유의한 관찰결과를 얻지 못하였으나, 전체 실험 측면에서 GBTJ군이 다른 군에 비해 유의성 있는 실험항목이 더 많이 관찰된 점을 미루어 보아 地膚子를 활용한 GBTS를 중심으로 기전 분석을 위한 후속 연구가 필요하리라 사료된다.
본 연구의 한계점은 BTS 원방과 3종의 GBTS를 동일한 실험으로 효과를 비교하지 못한 점과, DNCB로 AD를 유발한 동물모델에서 얻어진 결과라는 점이다. 아울러 본 연구에서는 면역 물질 중 일부만을 측정대상으로 삼았고, 경구 투여와 도포에 대한 각각의 효능 비교가 되지 못하였으며, in vivo와 in vitro 상의 비장세포 증식률 실험에서 나타난 상반된 결과에 대해 오류분석 및 후속적 연구의 필요성이 있다고 생각된다. 하지만, 본 연구를 바탕으로 임상에서 사용이 어려워진 BTS를 기존 약재를 통해 가감방으로 변용하여 AD의 임상적 치료제로 활용할 수 있는 가능성을 보여주었으며, 향후 다양한 습진 질환에 접근할 수 있는 연구의 기초자료가 될 수 있으리라 생각한다.
V. 결 론
본 연구에서는 BTS에서 滑石을 제외, 또는 滑石을 대체하여 각각 金銀花 또는 地膚子를 가미한 GBTS들을 이용하여 DNCB로 AD를 유발시킨 생쥐에 미친 영향을 관찰하였으며 결과는 다음과 같다.
-
3종의 GBTS 실험군은 체중변화와 귀의 무게에 특별한 영향을 미치지 않았다.
-
GBT, GBTJ군은 AD 유발에 의해 증가된 귀의 두께를 유의성 있게 감소시켰다.
-
GBTJ군은 AD 유발 생쥐의 등 두께를 대조군, GBT군에 비하여 유의성 있게 감소시켰다.
-
3종의 GBTS 실험군은 모두 AD 유발 생쥐의 피부 증상 발현 정도를 유의성 있게 감소시켰다.
-
3종의 GBTS 실험군은 조직학적 검사에서 표피의 두께, 비만세포의 침윤 감소를 시켰다.
-
In vitro 상 3종의 GBTS 실험군은 농도증가에 따라 비장세포 증식율이 유의성 있게 증가하였으나, in vivo 상에서는 모든 실험군의 비장세포 증식율이 감소하는 경향이 있었으며, GBT군은 대조군, GBTG, GBTJ군에 비해 유의성 있게 감소하였다.
-
In vitro 상 3종의 GBTS 실험군의 농도증가에 따라 흉선세포 증식율이 감소하였으며, GBTG, GBTJ군에서 유의성 있게 감소하였다.
-
3종의 GBTS 실험군은 모두 AD를 유발시킨 생쥐의 혈청 내 IL-4, TNF-α 함량을 유의성 있게 감소시켰다.
-
3종의 GBTS 실험군에서 혈청 내 IgE 함량변화는 유의성이 없었다.






