Ⅰ. 서 론
아토피피부염(AD, Atopic dermatitis)은 한의학적으로 ‘奶廯’, ‘胎斂瘡’, ‘濕瘡’, ‘浸淫瘡’ 등의 범주에 속하며 소양감, 부종, 홍반, 삼출, 인설 등의 양상을 나타내는 습진의 일종으로 재발이 잦아 만성으로 경과하는 만성 염증성 질환이다1). 한 연구에 따르면, 아토피피부염 환자의 17.1% 정도가 정신과 진단을 받은 경험이 있다고 보고되어지므로 아토피피부염은 단순 피부 증상 외에도 수면장애, 정신적 신체적 스트레스 등에 영향을 주어 개인만의 문제가 아닌 사회적 문제로도 이어질 수 있다2).
현재까지 아토피피부염에 대한 양방 치료로는 항히스타민제와 염증을 감소시켜주는 국소 스테로이드 및 항생제 연고를 사용하고, 증상이 심한 경우에는 전신 스테로이드제를 사용하며, 기타치료법으로는 광선치료, Cyclosporine 등이 있다3). 그러나 스테로이드제의 장기적 사용은 모세혈관 확장과 피부위축 등의 피부 부작용과 더불어 쿠싱증후군, 성장지연 등의 전신적 부작용을 야기하는 등 다양한 문제점들이 제기되고 있어 한의학적 치료에 관심이 높아지고 있는 추세이다4).
甘麥大棗湯(Gammakdaejo-tang, 이하 GMD)은 《金匱要略》에 “婦人臟躁, 喜悲傷欲哭, 象如神靈所作, 數欠伸, 甘麥大棗湯主之”로 기록되어 있으며, 임상에서는 不眠不安, 胃潰瘍, 筋痙攣, 精神病, 子宮痙攣, 神經衰弱 및 히스테리 등에 응용된다5). 甘麥大棗湯의 구성약물 중 君藥인 甘草는 生用하면 解毒의 효능이 있으므로 癰疽瘡瘍, 消化性潰瘍, 咽喉腫痛을 치료하고6), 주요성분인 isoliquiritigenin, liquiritin, liquiritigenin, glycyrrhizin은 항균작용이 있는 것으로 알려져 있어 감염성 피부질환 치료에 활용할 수 있다7). 大棗는 補脾和胃, 調營衛하는 효능이 있으며, 甘草와 배합하면 補脾生血, 益氣生津하는 효과가 증대되어지고6), 비타민이 풍부하며 항산화물질인 polyphenol 성분이 다량으로 분포하여 진정작용 및 항알러지작용에 활용되어진다.8) 小麥은 益氣除熱止汗 하는 효능이 있어 自汗盜汗, 骨蒸勞熱에 활용되어지며9), 小麥의 성분 중 하나인 arabinoxylan은 면역세포를 활성화 시켜주는 작용이 있다고 알려져 있다10).
아토피 피부염의 가장 두드러진 증상은 소양감으로 볼 수 있다. 그러나 소양감은 개인마다 매우 주관적이며 정신적 스트레스 등 심리 상태와도 연관성이 높은 증상으로 치료함에 있어 객관적인 평가가 어려운 실정이다11). 이와 관련하여 甘麥大棗湯이 신체부동 스트레스 백서에 미치는 영향에 관한 연구12)에서는 甘麥大棗湯이 혈청 스트레스 호르몬으로 알려진 corticosterone의 분비를 억제하는 효과가 있음을 보고 하였고, 항우울 및 만성스트레스에 대한 효능에 관한 연구13)에서는 만성 스트레스를 유발시킨 생쥐에서 serotonine의 분비증가와 스트레스를 지속적으로 받을 시 증가하는 혈중 glucose의 함량을 감소시킨다고 보고하였다.
이외 甘麥大棗湯에 대한 연구로는 국소 뇌혈관과 심혈관계에 미치는 영향에 관한 연구14), 알코올성 간질환에 대한 치험 1례5) 등이 있으나 아토피피부염에 작용하는 면역학적 기전에 관한 연구는 없었다.
이에 저자는 GMD가 아토피피부염에 효능이 있는지 알아보기 위하여 백서 실험 후 육안적 상태, IgE, Histamine, Cytokine, 면역세포, 조직 내 바이오마커 등에 대하여 관찰 및 측정 분석한 결과 유의성을 얻었기에 보고하는 바이다.
Ⅱ. 재료 및 방법
실험에 사용한 甘麥大棗湯(이하, GMD으로 표기)의 구성 약재는 대전한약국에서 구입하여 사용하였고 甘草는 충남 금산, 小麥은 전남 구례, 大棗는 경북 경산에서 채취한 것을 사용하였으며 그 내용 및 분량은 다음과 같다 (Table 1).
| Herbal medicine name | Scientific name | Weight (g) |
|---|---|---|
| 甘草 | Glycyrrhiza uralensis Fischer | 40 |
| 小麥 | Triticum aestivum Linne | 48 |
| 大棗 | Zizyphus jujuba Miller var. inermis Rehder | 14 |
| Total amount | 102 |
사용된 Nc/Nga mice (수컷, 5주령, 15-18g)는 ㈜라온바이오 (Korea)를 통해 공급받았으며 실험 당일까지 고형사료와 물을 충분히 공급하고 습도 55±15%, 온도 22±2℃, 12시간씩-12시간씩 (light-dark cycle)의 환경을 조성하고 1주일간 적응시켜 실험에 사용되었다. 위 실험은 대전대학교 동물실험윤리 위원회에서 승인 (승인번호 DJUARB2018-011)을 받았으며 동물윤리준칙에 의거하여 실험하였다.
사용된 시약은 DNCB (Sigma-Aldrich, USA), AccuPower CycleScript RT PreMix (Bioneer, Korea), dexamethasone (Sigma-Aldrich, USA), mouse magnetic luminex assay kit (R&D system, USA), total RNA prep kit (Intronbio, Korea), formalin (Merck, Germany), histamine ELISA kit (MyBioSource, U.S.A), mouse IgE single plex magnetic bead kit (Millipore, USA)등을 사용하였다.
사용된 기기는 rotary vacuum evaporator (EYELA Co., Japan), eep-freezer (Sanyo Co., Japan), reflux extractor (EYELA Co., Japan), freeze dryer (Ilshinbiobase Co., Korea), ICP-AES (Shimadzu, Co., Japan), HPLC (Shimadzu, Co., Japan), luminex (Millipore, U.S.A.), c d plate shaker (Lab-Line Co., U.S.A.), ice-maker (Vision scientific Co., Korea), nanodrop (Thermofisher, U.S.A.), autoclave (Sanyo Co., Japan), micro plate reader (Molecular Devices Co., U.S.A.), electrophoresis system (ADVANCE, Japan), lean bench (Vision scientific Co., Korea), alpha cycler 1 PCRmax (PCRmax, U.K.), centrifuge (Sigma Co., U.S.A.), 수은분석기 (TELEDYNE Leeman Labs, U.S.A.), vortex mixer (Vision scientific Co., Korea), real time PCR (Qiagen, Germany) 등을 사용하였다.
GMD(102g)에 증류수 500㎖을 넣고 환류 추출을 3시간 동안 하여 얻은 여과액을 rotary vacuum evaporator를 통해 감압 농축하였다. 농축된 용액을 freeze dryer로 동결 건조 후 GMD 분말 14.6g(수율 : 14.3%)을 얻었으며 초저온 냉동고 (-80℃)에 보관하며 실험에 필요한 농도에 맞춰 증류수에 희석하여 사용하였다.
0.45㎛ membrane filter에 GMD 30mg을 80% 에탄올 1㎖에 녹인 후 여과하여 10㎕를 HPLC 시료로 사용하였다. water(A)와 acetonitrile(B)로 gradient elution system을 적용하여 0분-5분(0% B), 5분-30분(40% B), 30분-40분(80% B), 40분-55분(100% B)으로 설정하였다. column 온도는 40℃를 유지하였으며 유속은 1.0㎖/min이었고, UV wavelength는 210nm로 설정한 후 분석하였다.
납, 카드뮴, 비소를 분석하기 위해 질산 10㎖을 넣고 극초단파 시료 전처리장치 전용 용기에 GMD 0.5g을 넣은 후 후드 안에 용기를 정치시켜 발생 가스를 제거한 후 극초단파 시료 전처리장치를 이용하여 분해하였다. 분해가 끝난 후 분해액을 여과하여 용량 플라스크에 넣고 물을 첨가하여 표준액의 농도 범위에 맞게 희석 후 검액으로 사용하였다. 극초단파 시료 전처리장치 용기에 질산 10㎖를 넣고 검액 조제와 같은 방법을 이용하여 공시험액으로 사용하였다. 준비된 공시험액, 표준약, 검액을 가지고 유도결합플라즈마분광계(ICP)를 사용하여 검량선을 작성하였으며 공시험액으로 보정 후 검색을 측정하였다. 수은 분석의 경우 GMD 50mg을 수은분석기를 이용하여 특별한 전처리 과정 없이 측정하였다.
1주 동안 안정기를 가진 뒤 6주령이 된 Nc/Nga mice의 등 표면을 꼬리 상단부에서 귀 하단부까지 제모하고 24h 방치하였다. 그 후 1% DNCB (dinitrochlorobenzen) 용액 (올리브오일·아세톤 = 1:3) 150㎕를 2주간 격일로 제모한 부위에 도포하였다. 2주 도포 후, 0.5% DNCB 용액 150㎕를 1주에 3회씩 도포하면서, 음성대조군은 증류수를 투여하고 양성대조군은 dexamethasone 1mg/㎖, GMD 200mg/kg, GMD 400mg/kg으로 4주 동안 매일 1회 200㎕씩 경구 투여하였다.
비교군은 normal(Non DNCB caused Nc/Nga mice), control(DNCB-caused mice group was treated orally with D.W), positive control (DNCB-caused mice group was treated orally with dexamethasone 1mg/kg), GMD 200mg/kg(DNCB-caused mice group was treated orally with GMD 200mg/kg) GMD 및 GMD 400mg/kg(DNCB-caused mice group was treated orally with GMD 400mg/kg)로 총 다섯 군으로 나누었으며 각 그룹별로 6마리의 Nc/Nga mice 가 사용되었다.
실험이 끝난 후 심장천자법을 통해 1cc의 전혈을 얻었으며 이 중 0.25cc의 전혈을 통해 혈구분석을 진행하였다. 나머지 전혈을 통해 혈청을 분리하여 30분 동안 상온에 두어 굳힌 후 원심분리(3,000rpm, 15min)하여 200-300㎕의 혈청을 획득하였다. 획득한 혈청 중 Millipore사의 IgE kit와 R&D system 사의 cytokine kit, Mybiosource사의 histamine ELISA kit는 혈청을 각각 50㎕ 사용하였다. 바이오마커 측정용량에 맞추어 ep tube에 넣고 초저온 냉동고 (-80℃)에 보관하여 사용하였다. 혈액 채취 후 발현된 등 부분을 미세가위로 근막 전까지 자르고 질소로 즉각 냉각 시킨 다음 ep tube에 넣고 초저온 냉동고(-80℃)에 보관하며 사용하였다.
아토피 피부염을 유발 시킨 후 시료를 경구 투여하는 6주차에 사진 촬영을 진행하였으며 사진을 토대로 아토피성 피부염에서 일반적으로 사용되어지는 임상적 육안 평가법으로 관능 평가를 실시하였다. 평가 항목으로는 건조 피부(dry skin), 홍반(erythema), 짓무름(excoriation), 부종과 혈종(edema & hematoma), 태선화(lichenification) 등 5가지로 나누었으며, 각각의 항목에 대한 평가는 없음(0), 약함(1), 중등(2), 심함(3)으로 채점하였다.
-
① Immunoglobulin E (IgE)
실험이 끝난 후 획득한 혈청을 이용하여 Immunoglobulin E (IgE)을 측정하였다. 96 well plate에 분리한 혈청과 standard를 50㎕, bead를 25㎕씩 각 well에 넣었다. 상온에서 1h 반응시킨 후, washing buffer를 사용하여 3회에 걸쳐 세척 작업을 진행하였다. 세척이 끝난 후 25㎕의 PE와 anti-mouse light chain를 넣고 다시 상온에서 15min 반응시켰다. 3회 세척 후 sheath fluid 200㎕씩 넣고 luminex를 통해 측정하였다.
-
② Histamine
실험이 끝난 후 획득한 혈청을 통해 histamine을 측정하였다. 96 well plate를 통해 분리한 혈청과 standard를 50㎕, biotin-labeled antibody를 50㎕씩 각 well에 넣은 후, 37℃에서 45min 반응시켰다. Washing buffer를 사용하여 3회에 걸쳐 세척 작업을 진행하였다. 세척 후 HRP-streptavidin conjugate 100㎕를 넣은 후 37℃에서 30min동안 반응시킨다. 3회 세척 후 TMB substrate 90㎕씩 넣고 37℃에서 15min 반응시킨 후 stop solution 50㎕씩 넣었다. 흡광도는 micro plate reader기를 통해 450nm에서 측정하였다.
-
③ Cytokine
실험이 끝난 후 획득한 혈청을 통해 TNF-α, IL-1β, IFN-γ, IL-2, IL-4, IL-5, IL-6, IL-10을 측정하였다. 96 well plate에 분리한 혈청과 standard를 50㎕, microparticle cocktail를 50㎕씩 각 well에 넣은 후 상온에서 2h 반응시켰다. washing buffer를 사용하여 3회에 걸쳐 세척 작업을 진행하였다. 세척 후 biotin-antibody cocktail 50㎕를 넣고 다시 상온에서 1h 반응시켰다. 세척을 3회 실시한 뒤 streptavidin-PE를 50㎕씩 넣고 상온에서 30min 반응 시킨 후 washing buffer를 사용하여 3회 세척 작업을 진행하였다. 세척한 뒤 sheath fluid 150㎕를 넣은 후 상온에서 2min 반응시키고 luminex를 통해 측정하였다.
실험이 끝난 후 획득한 혈액을 통해 면역세포 white blood cell, lymphocyte, monocyte, neutrophil, eosinophil, basophil 측정을 대전대학교 한방 Bio Fab Lab(Korea)에 의뢰하였다.
실험이 끝난 후 획득한 등 조직을 통해 VEGF, filaggrin, TGF-β1 mRNA 발현량을 확인하였다. 조직 100mg에 cell lysis buffer 1㎖씩 넣고 미세가위로 조직을 자른 후, chloroform 200㎕씩 넣어 다시 혼합하였다. 이를 원심분리(13,000rpm, 10분)시킨 후 400㎕의 상층액을 회수한 다음 binding buffer 400㎕씩 넣고 나서 혼합한 후 column에 주입하여 원심분리하였다. column에 washing buffer A 700㎕씩 넣은 후 원심분리하였고 washing buffer B 700㎕씩 넣고 원심분리 후 elution buffer 50㎕을 넣어 원심분리하여 RNA를 추출하였다. 역전사 (reverse transcription) 반응은 RT premix (reverse transcriptase, dT20 primer, reaction buffer, stabilizer dNTPs)에 total RNA를 1㎍ 첨가하여 최종 부피가 20㎕가 되도록 diethyl pyrocarbonate (DEPC) 처리된 증류수를 첨가하였다. 혼합액을 섞어 넣은 후 원심침강 (2,000rpm, 5sec)하여 45℃ heating block에서 60min 동안 반응시킨 후 first-strand cDNA를 합성하였다. 이를 다시 95℃에서 5min동안 반응시키고 M-MLV RT를 불활성화시킨다. 그 후 합성이 완료된 cDNA를 PCR에 사용하였다. 합성이 완료된 cDNA를 증폭시키기 위해 real-time PCR을 진행하였다. cDNA 1㎕, 각 primer 2㎕, DEPC-DW 5㎕, SYBR Green 10㎕를 real-time 전용 tube에 넣은 후 다음과 같이 진행하였다. 95℃ 2min 반응시킨 후 95℃ 5초, 62.5℃ 30초를 1 cycle로 정하고 총 40 cycle을 시행하였다. 그 후 유전자 발현량은 대조군과 비교하여 계산을 하였고, 사용된 primer의 sequence와 size는 다음과 같다(Table 2).
Ⅲ. 실험결과
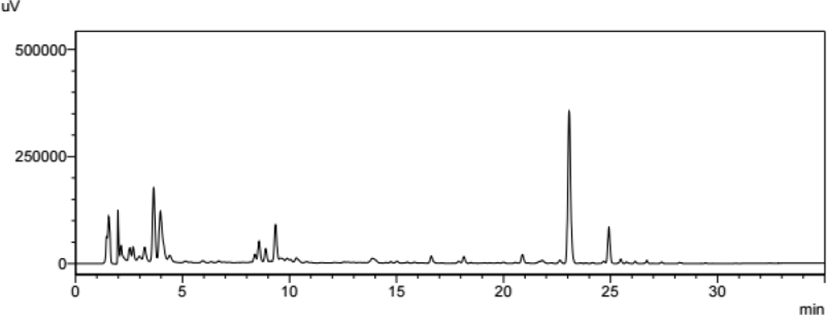
GMD의 HPLC 분석을 한 결과, 2min, 4min, 23min 대에 피크가 확인되었다(Fig. 1).
중금속 함량을 측정한 결과, GMD는 비소가 기준치(3mg/kg) 이하로 검출되었고 납, 카드뮴, 수은은 검출되지 않았다(Table 3).
| Pb | As | Cd | Hg | |
|---|---|---|---|---|
| permissible concentration | 5 | 3 | 0.3 | 0.2 |
| GMD | N.D | 0.1 | N.D | N.D |
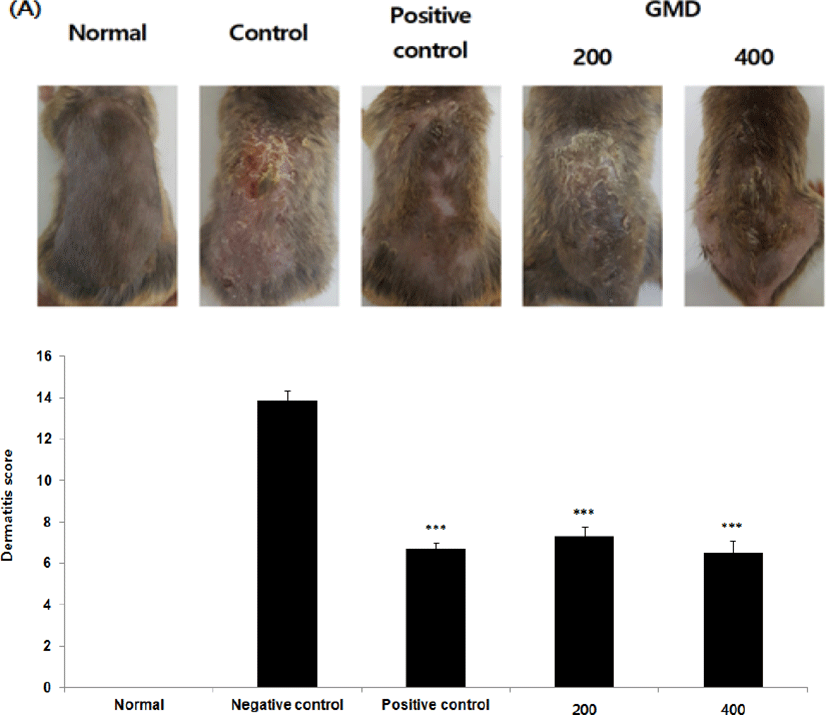
DNCB 처리로 인한 정상군을 제외한 대조군, 실험군 그룹에서 짓무름과 심한 상처에 의한 피부염 발현 현상을 확인하였고, 6주차에 육안으로 각 그룹의 피부상태를 관찰한 결과, 대조군은 시간이 경과할수록 각질의 탈락과 각화의 현상이 심한 반면, GMD 투여군은 아토피 피부염 증상이 현저하게 감소되는 것을 육안으로 관찰할 수 있었다(Fig. 2).
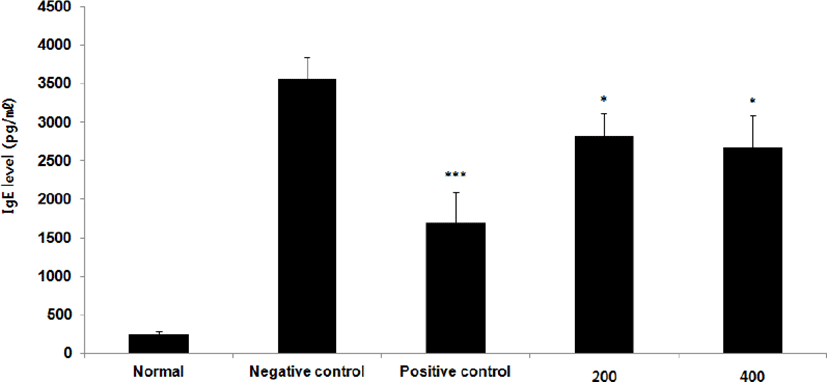
IgE level을 측정한 결과, 정상군은 245.6±50.4ng/㎖, 양성대조군은 1698.8±400.9ng/㎖, 음성대조군은 3562.8±282.0ng/㎖로 나타난 반면, GMD 200, 400mg/kg 투여군은 2821.3±298.3 ng/㎖, 2674.3± 419.2ng/㎖로 나타나 모든 투여군은 음성대조군에 비해 유의성 있는 (***p < 0.001, *p < 0.05 ) 감소가 나타났다(Fig. 3).
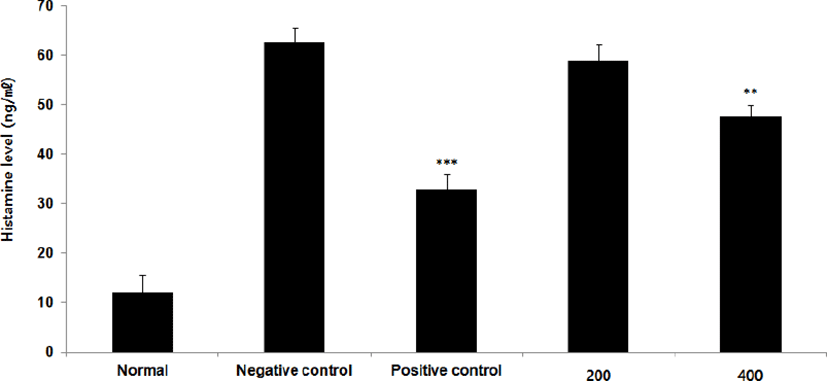
Histamine level을 측정한 결과, 정상군은 12.0± 3.7ng/㎖, 양성대조군은 32.8±3.1ng/㎖, 음성대조군은 62.6±3.1ng/㎖로 나타난 반면, GMD 200, 400mg/kg 투여군은 58.9±3.3ng/㎖, 47.6±2.2ng/㎖ GMD 200mg/kg을 제외한 모든 투여군은 음성대조군에 비해 유의성 있는 (***p < 0.001, **p < 0.01, *p < 0.05) 감소가 나타났다(Fig. 4).
-
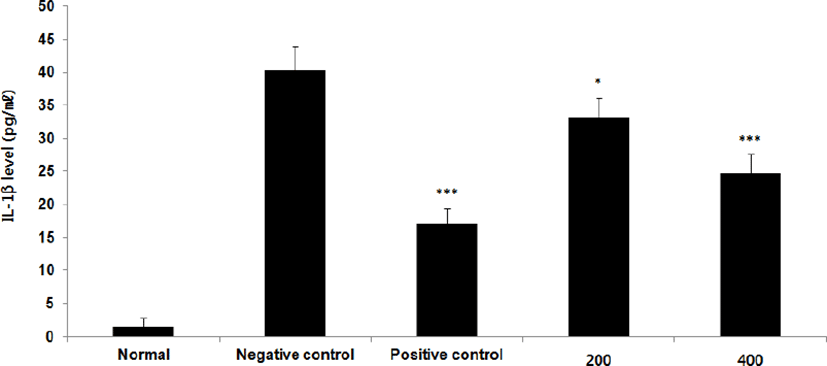
① IL-1β : IL-1β level을 측정한 결과, 정상군은 1.4±1.3pg/㎖, 양성대조군은 17.1±2.3pg/㎖ 음성대조군은 40.3±3.7pg/㎖로 나타난 반면, GMD 200, 400mg/kg 투여군은 33.1±3.0pg/㎖, 24.8±2.9pg/㎖로 나타나 모든 투여군은 음성대조군에 비해 유의성 있는 (***p < 0.001, **p < 0.01, *p < 0.05) 감소가 나타났다(Fig. 5).
-
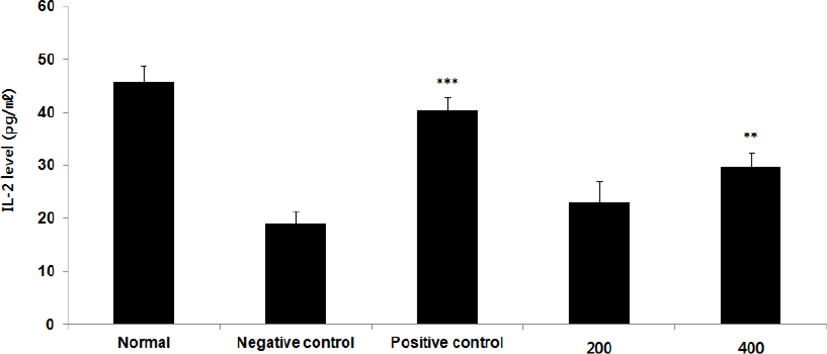
② IL-2 : IL-2 level을 측정한 결과, 정상군은 45.7±3.2pg/㎖, 양성대조군은 40.4±2.6pg/㎖, 음성대조군은 19.0±2.4pg/㎖로 나타난 반면, GMD 200, 400mg/kg 투여군은 22.9±4.1pg/㎖, 29.6±2.8pg/㎖로 나타나 GMD 200mg/kg 투여군을 제외한 모든 투여군은 음성대조군에 비해 유의성 있는 (***p < 0.001, **p < 0.01, *p < 0.05) 증가가 나타났다(Fig. 6).
-
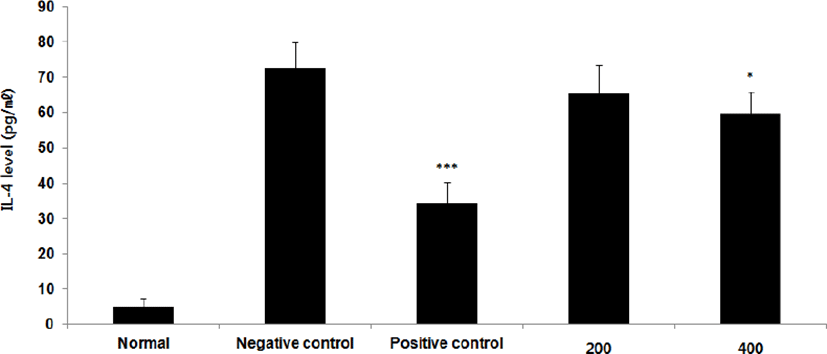
③ IL-4 : IL-4 level을 측정한 결과, 정상군은 5.1±2.2pg/㎖, 양성대조군은 34.4±5.9pg/㎖, 음성대조군은 72.7±7.1pg/㎖로 나타난 반면, GMD 200, 400mg/kg 투여군은 65.4±8.0pg/㎖, 59.6±6.3pg/㎖로 나타나 GMD 200mg/kg을 제외한 모든 투여군은 음성대조군에 비해 유의성 있는 (***p < 0.001, **p < 0.01, *p < 0.05) 감소가 나타났다 (Fig. 7).
-
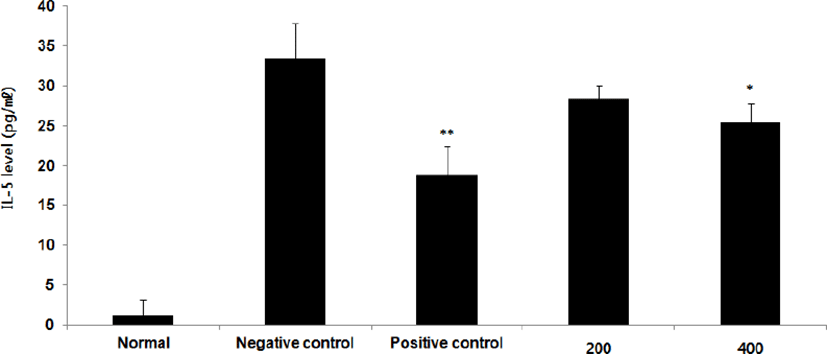
④ IL-5 : IL-5 level을 측정한 결과, 정상군은 1.3±1.9pg/㎖, 양성대조군은 18.9±3.5pg/㎖, 음성대조군은 33.4±4.4pg/㎖로 나타난 반면, GMD 200, 400mg/kg 투여군은 28.4±1.7pg/㎖, 25.4±2.5pg/㎖로 나타나 GMD 200mg/kg을 제외한 모든 투여군은 음성대조군에 비해 유의성 있는 (**p < 0.01, *p < 0.05) 감소가 나타났다(Fig. 8).
-
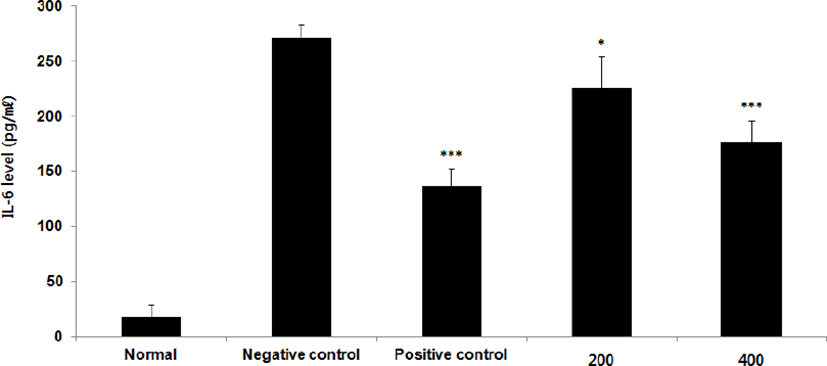
⑤ IL-6 : IL-6 level을 측정한 결과, 정상군은 17.1±11.6pg/㎖, 양성대조군은 135.8± 16.4pg/㎖, 음성대조군은 270.9±12.4pg/㎖로 나타난 반면, GMD 200, 400mg/kg 투여군은 226.3±28.0pg/㎖, 176.4±19.8pg/㎖로 나타나 모든 투여군은 음성대조군에 비해 유의성 있는 (***p < 0.001, **p < 0.01, *p < 0.05) 감소가 나타났다(Fig. 9).
-
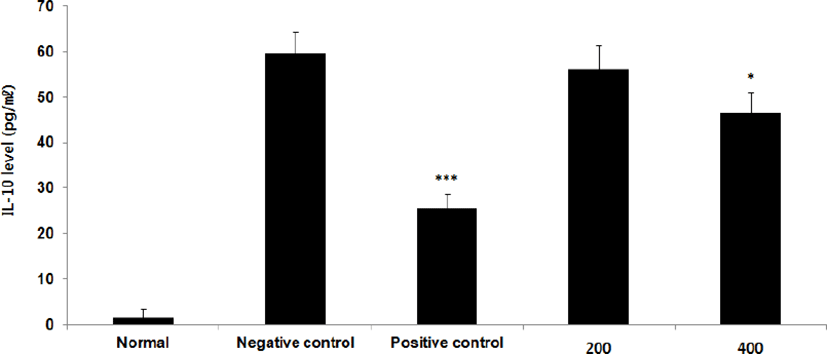
⑥ IL-10 : IL-10 level을 측정한 결과, 정상군은 1.5±2.0pg/㎖, 양성대조군은 25.7±3.1pg/㎖, 음성대조군은 59.7±4.6pg/㎖로 나타난 반면, GMD 200, 400mg/kg 투여군은 56.1±5.4pg/㎖, 46.5±4.6pg/㎖로 나타나 GMD 200mg/kg을 제외한 모든 투여군은 음성대조군에 비해 유의성 있는 (***p < 0.001, **p < 0.01, *p < 0.05) 감소가 나타났다(Fig. 10).
-
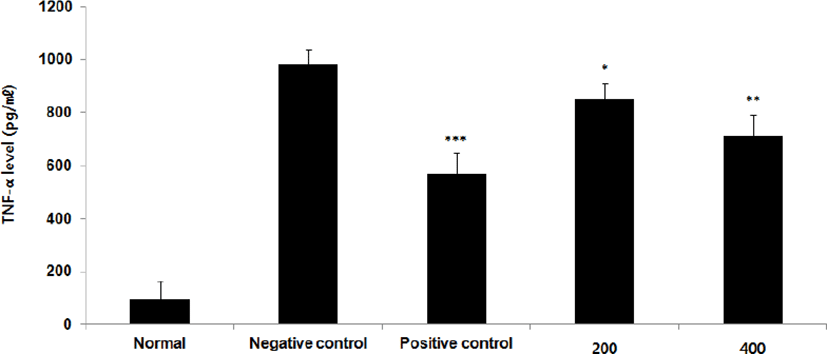
⑦ TNF-α : TNF-α level을 측정한 결과, 정상군은 94.9±68.5pg/㎖, 양성대조군은 570.2± 79.3pg/㎖, 음성대조군은 982.4±54.1pg/㎖로 나타난 반면, GMD 200, 400mg/kg 투여군은 848.7±61.3pg/㎖, 712.7±79.3pg/㎖로 나타나 모든 투여군은 음성대조군에 비해 유의성 있는 (***p < 0.001, **p < 0.01, *p < 0.05) 감소가 나타났다 (Fig. 11).
-
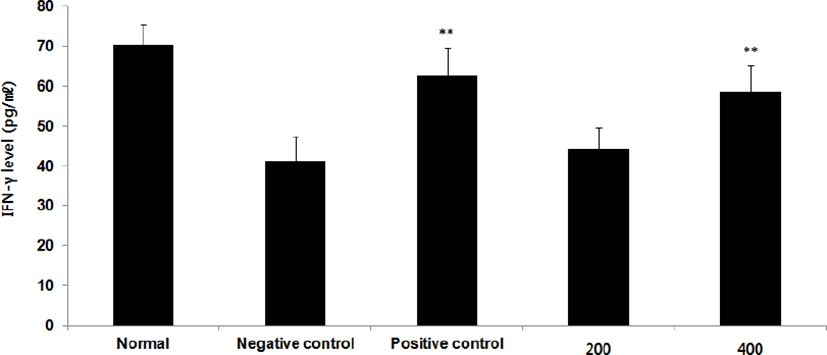
⑧ IFN-γ : IFN-γ level을 측정한 결과, 정상군은 70.4±5.0pg/㎖, 양성대조군은 62.8±7.0pg/㎖, 음성대조군은 41.2±6.4pg/㎖로 나타난 반면, GMD 200, 400mg/kg 투여군은 44.5±5.2pg/㎖, 58.8±6.4pg/㎖로 나타나 GMD 200mg/kg을 제외한 모든 투여군은 음성대조군에 비해 유의성 있는 (**p < 0.01) 증가가 나타났다(Fig. 12).
White blood cell level을 측정한 결과, 정상군은 1.1±0.1×103cells/㎕, 양성대조군은 1.5±0.2 ×103 cells/㎕, 음성대조군은 3.3±0.2×103cells/㎕로 나타난 반면, GMD 200, 400mg/kg 투여군은 3.2± 0.3×103cells/㎕, 2.3±0.1×103cells/㎕로 나타나 GMD 200mg/kg을 제외한 모든 투여군은 음성대조군에 비해 유의성 있는 (***p < 0.001, **p < 0.01) 감소가 나타났다(Fig. 13).
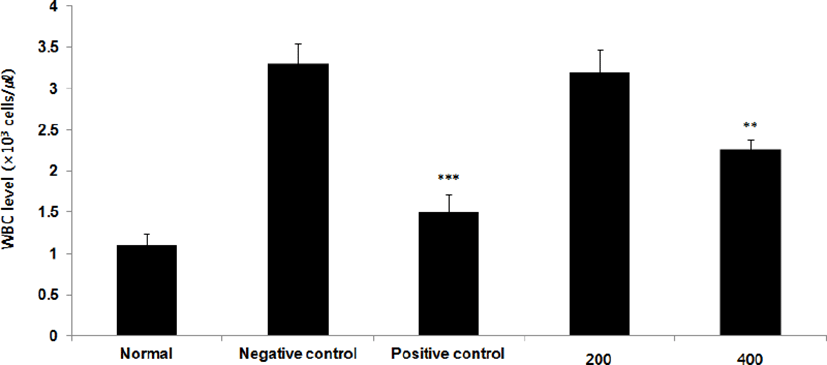
Monocyte level을 측정한 결과, 정상군은 7.4±1.1%, 양성대조군은 17.4±1.0%, 음성대조군은 25.0±1.9%로 나타난 반면, GMD 200, 400mg/kg 투여군은 21.5±2.2%, 19.3±1.0%로 나타나 모든 투여군은 음성대조군에 비해 유의성 있는 (**p <0.01, *p <0.05 ) 감소가 나타났다(Fig. 14).
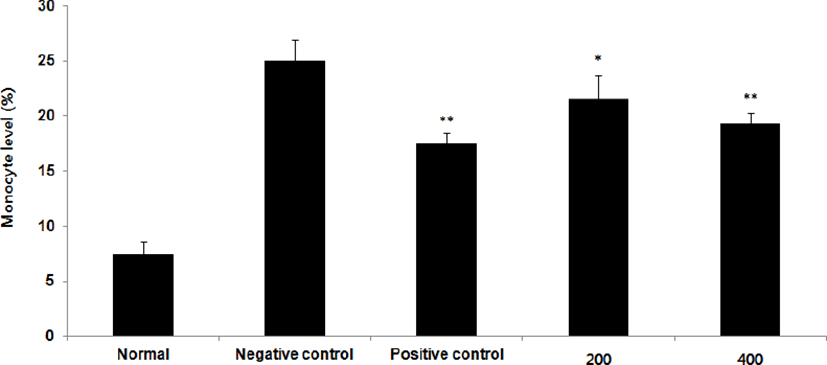
Neutrophil level을 측정한 결과, 정상군은 5.7±0.6%, 양성대조군은 7.5±0.2%로 나타난 반면, 음성대조군은 10.9±0.4%로 나타난 반면, GMD 200, 400mg/kg 투여군은 10.6±0.4%, 8.3±0.4%로 나타나 GMD 200mg/kg을 제외한 모든 투여군은 음성대조군에 비해 유의성 있는 (***p < 0.001, **p < 0.01 ) 감소가 나타났다 (Fig. 15).
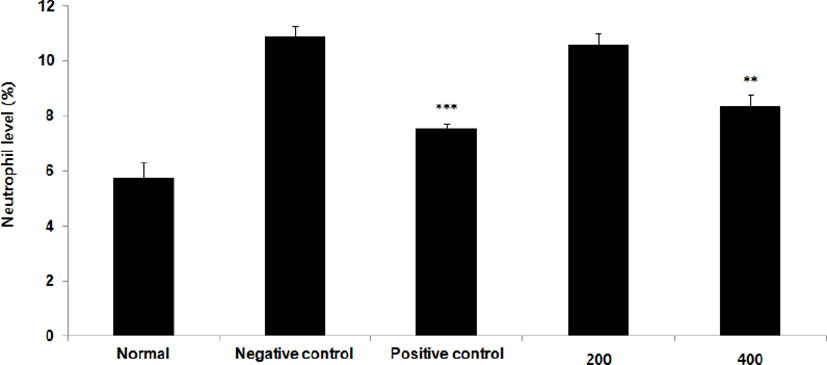
Eosinophil level을 측정한 결과, 정상군은 5.4±0.3%, 양성대조군은 6.7±0.4%, 음성대조군은 10.8±0.4%로 나타난 반면, GMD 200, 400mg/kg 투여군은 9.8±0.2%, 9.6±0.4%로 나타나 모든 투여군은 음성대조군에 비해 유의성 있는 (***p < 0.001, **p < 0.01, *p < 0.05) 감소가 나타났다(Fig. 16).
Basophil level을 측정한 결과, 정상군은 10.6±0.1%, 양성대조군은 9.9±0.2%, 음성대조군은 10.7±0.1%로 나타난 반면, GMD 200, 400mg/kg 투여군은 10.6±0.2%, 11.5±0.3%로 나타나 모든 실험군 차이를 나타내지 않았다(Fig. 17).
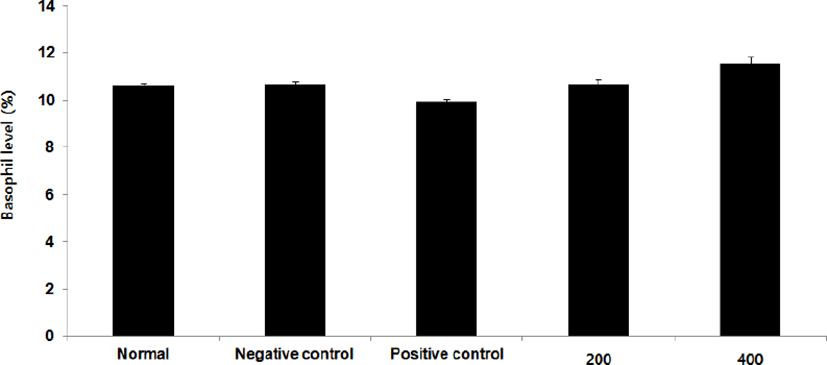
Lymphocyte level을 측정한 결과, 정상군은 70.6±2.4%, 양성대조군은 57.8±6.2%, 음성대조군은 41.7±5.1%로 나타난 반면, GMD 200, 400mg/kg 투여군은 46.8±6.5%, 51.3±1.6%로 나타나 GMD 200 mg/kg을 제외한 모든 투여군은 음성대조군에 비해 유의성 있는 (**p < 0.01, *p < 0.05 ) 증가가 나타났다(Fig. 18).
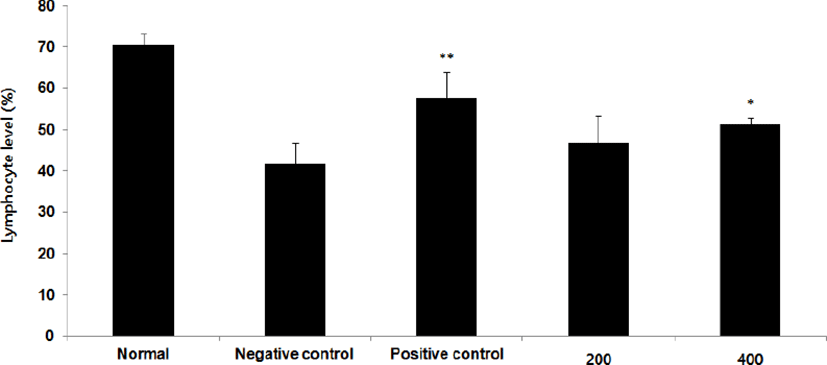
Filaggrin mRNA 발현량을 측정한 결과, 정상군은 2.2±0.1, 양성대조군은 1.7±0.1, 음성대조군은 1.0±0.1로 나타난 반면, GMD 200, 400mg/kg 투여군은 1.2±0.2, 1.3±0.1,로 나타나 GMD 200mg/kg을 제외한 모든 투여군은 음성대조군에 비해 유의성 있는 (***p < 0.001, **p < 0.01, *p < 0.05) 증가가 나타났다(Fig. 19).
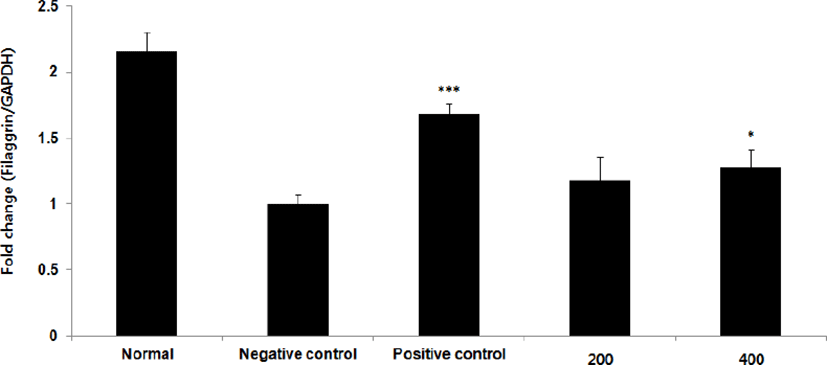
VEGF mRNA 발현량을 측정한 결과, 정상군은 1.7±0.1, 양성대조군은 1.5±0.1, 음성대조군은 1.0± 0.1로 나타난 반면, GMD 200, 400mg/kg 투여군은 1.1±0.1, 1.4±0.1로 나타나 GMD 200 mg/kg을 제외한 모든 투여군은 음성대조군에 비해 유의성 있는 (***p < 0.001, **p < 0.01, *p < 0.05) 증가가 나타났다(Fig. 20).
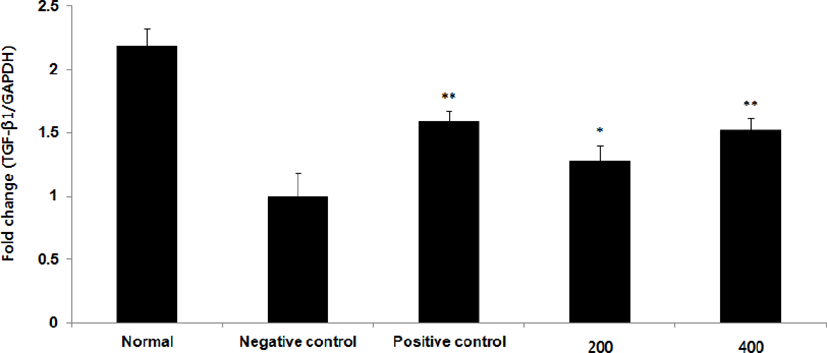
TGF-β1 mRNA 발현량을 측정한 결과, 정상군은 2.2±0.1, 양성대조군은 1.6±0.1, 음성대조군은 1.0±0.2로 나타난 반면, GMD 200, 400mg/kg 투여군은 1.3±0.1, 1.5±0.1로 나타나 모든 투여군은 음성대조군에 비해 유의성 있는 (**p <0.01, *p < 0.05) 증가가 나타났다(Fig. 21).
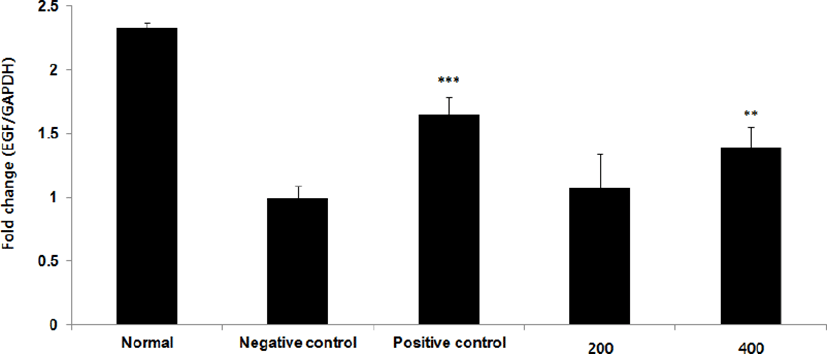
EGF mRNA 발현량을 측정한 결과, 정상군은 2.3±0.0, 양성대조군은 1.7±0.1, 음성대조군은 1.0±0.1로 나타난 반면, GMD 200, 400mg/kg 투여군은 1.1±0.3, 1.4±0.2로 나타나 GMD 200mg/kg 제외한 모든 투여군은 음성대조군에 비해 유의성 있는 (***p < 0.001, **p < 0.01) 증가가 나타났다(Fig. 22).
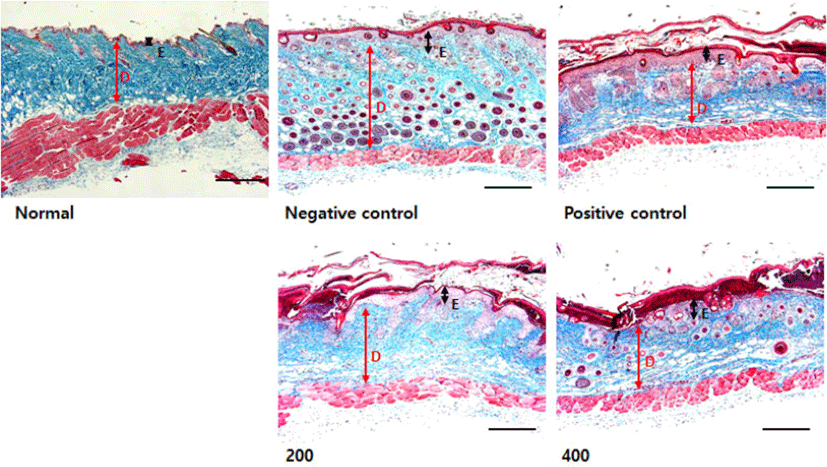
피부 두께 변화를 측정한 결과, 음성대조군은 정상군에 비해 epidermis (E; black arrow)와 dermis (D; red arrow)두께가 현저하게 증가하였고, 모든 투여군은 음성대조군에 비해 epidermis와 dermis의 두께가 감소하였다(Fig. 23).
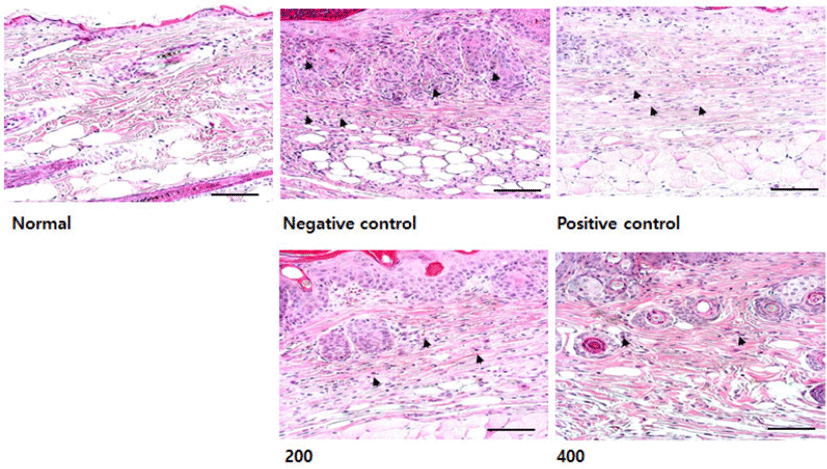
호산구의 침윤 변화를 측정한 결과, 음성대조군은 정상군에 비해 호산구의 침윤이 현저하게 증가하였고, 모든 투여군은 음성대조군에 비해 침윤이 감소하였다(Fig. 24).
Ⅳ. 고 찰
아토피피부염(Atopic dermatitis, AD)은 피부 발적, 소양감, 태선화 등의 병변을 특징으로 하는 만성 염증성 피부질환으로 겉으로 드러나는 피부 증상 이외에도 수면장애, 감정적, 신체적 스트레스, 사회생활 등에 제한을 주고 삶의 질을 떨어뜨리므로 개인 및 가족의 문제만이 아니라 사회 공동체의 문제이기도 하다. AD의 발병기전에 관해서는 확실히 알려진 바가 없으나, 환경 인자, 유전적 소인, 면역학적 변화 등 복잡하고 다양한 인자들로 인해 발생되어지는 것으로 보고 있다15,16).
AD의 양방학적 치료로는 국소치료, 전신치료, 항원특이면역치료, 기타치료 등으로 이루어진다. 국소치료로는 국소스테로이드, 습포밀폐요법, 국소칼린뉴린억제제, 국소, 선택적 PDE-4 억제제 치료, 전신치료로는 항히스타민제, 항균제, 항염증치료제, 기타치료로는 광선치료, 항원 특이 면역치료 등이 사용되어지고 있으며 최근에는 염증 세포나 매개체에 특이적으로 표적 작용하는 생물학적제제 치료에 대한 연구들이 지속적으로 이루어지고 있다16). 그러나 AD의 치료제로 사용어지는 항히스타민은 아토피 피부염 환자에게서 가려움증을 억제하기에 충분하지 못하며, 스테로이드의 장기적 적용은 피부의 위축이나 소아환자에 있어 성장지연 가능성 등 각종 부작용을 유발할 수 있으므로 안전하고 우수한 효과를 가진 새로운 치료법에 대한 연구가 지속되고 있다17,18).
한의학에서 아토피피부염은 '浸淫', '浸淫瘡', '奶癬', '胎斂瘡', '乳癬' 등으로 불리며19), 《諸病源候論, 小兒雜病諸侯. 癬候》에 “小兒面上, 癬皮如甲錯起乾燥, 謂之乳癬”이라 정의하여 최초로 기록되어 있고, 《外科正宗》에서는 “奶癬因兒在胎中 母食五辛 父餐炙煿 遺熱與兒.”라 하여 아토피피부염의 원인에 대하여 기록하고 있다. 또한, 《醫宗金鑑》에는 胎斂瘡이라 하여 건조하고 가려워 白屑이 생기는 乾斂, 소양감이 극심하여 潢水가 전신으로 퍼져나가는 濕斂으로 나누어 변증함으로써 현대의 아토피피부염과 가장 유사하게 설명하고 있다19,20).
甘麥大棗湯은 《金匱要略》에 “婦人臟躁, 喜悲傷欲哭, 象如神靈所作, 數欠伸, 甘麥大棗湯主之”로 기록되어 있으며, 養心安神하고 和中緩急 시키기 위해 사용되어 왔다. 임상에서는 不眠不安, 胃潰瘍, 筋痙攣, 精神病, 子宮痙攣, 神經衰弱 및 히스테리 등에 응용된다5).
甘麥大棗湯의 구성약물인 甘草는 和中緩急, 解毒, 潤肺 하는 효능이 있어 生用하면 解毒의 효능이 있으므로 소화성궤양, 癰疽瘡瘍, 咽喉腫痛을 치료하고, 灸用하면 성질이 溫하게 변하므로 脾胃虛弱, 食少, 腹痛便溏, 心悸 등에 활용된다6). 또한, 감초의 주요성분인 isoli-quiritigenin, liquiritin, liquiritigenin, glycyrrhizin은 항균작용이 있는 것으로 알려져 있다7). 아토피 피부염환자 90% 정도에서 감염균 Staphylococcus aureus가 발견되는 것으로 보아 항균작용이 있는 甘草를 감염성 피부질환 치료에 활용할 수 있다21). 大棗는 補脾和胃, 調營衛하는 효능이 있으며, 甘草와 배합하면 補脾生血, 益氣生津하는 효과가 증대되어 脾胃虛弱과 營血不足으로 인한 心悸怔忡, 婦人臟燥症 등에 활용되어지고6), 비타민이 풍부하며 항산화물질인 polyphenol 성분이 다량으로 분포하여 항암작용, 진정작용 및 항알러지작용에 활용된다8). 小麥은 益氣除熱止汗 하는 효능이 있어 自汗盜汗, 骨蒸勞熱에 활용되어지고 養心安身작용으로 부인의 히스테리나 虛煩證에 이용되어지며9), 소맥의 성분 중 하나인 arabinoxylan은 면역세포를 활성화 시켜주는 작용이 있다고 알려져 있다10).
甘麥大棗湯에 대한 연구로는 알코올성 간질환에 대한 치험 1례5), 항우울 및 만성스트레스에 대한 효능에 관한 연구13), 국소 뇌혈관과 심혈관계에 미치는 영향에 관한 연구14) 등이 있으나 피부질환과 관련된 연구는 없었다.
이에 저자는 GMD가 아토피피부염에 효능이 있는지 알아보기 위하여 DNCB용액을 Nc/Nga mice에 도포하여 접촉성 피부염을 일으켜 아토피 피부염과 같은 모델로 유발시킨 후 normal군, 증류수 투여한 Negative control군, Dexamethasione 투여한 Positive control군, 甘麥大棗湯 저농도(200mg/kg) 및 고농도(400mg/kg) 투여한 군 총 5개의 비교군으로 나누어 연구를 진행하였다. 비교군에는 각각의 시료들을 4주 동안 매일 1회 200㎕씩 경구투여 한 후, 육안적인 피부상태, Immunoglobulin E, Histamine, Cytokine(IL-1β, IL-2, IL-4, IL-5, IL-6, IL-10, TNF-α, IFN-γ), 면역세포, 조직 내 바이오마커 등에 대해 관찰하였다.
HPLC를 통해 GMD의 유효성분을 분석 결과, 2분, 4분, 23분대에 피크가 확인되었다(Fig. 1). GMD의 중금속 함량을 측정한 결과, 비소가 기준치 이하로 검출되었고 납, 카드뮴, 수은은 검출되지 않았다(Table 3).
DNCB는 혈청 내 IgE, 호염구, 호산구 Th2를 증가시켜 아토피피부염과 유사한 상태를 나타내므로 본 연구에서 아토피피부염을 발현시키기 위한 목적으로 사용하였으며22), DNCB 처리에 의하여 정상군을 제외한 대조군, 실험군 그룹에서 짓무름과 심한 상처에 의한 피부염 유발 현상을 확인하였다. 6주차에 육안으로 각 그룹의 피부상태를 관찰한 결과 GMD 투여군은 아토피 피부염 증상이 현저하게 감소되는 것을 관찰할 수 있었다(Fig. 2).
아토피피부염은 여러 면역관련세포 중 T세포의 활성화와 큰 관련성을 가지고 있다23). T세포는 각각의 Cytokine에 의해 Th1과 Th2로 분류되어지며 아토피피부염은 Th2 반응과 연관성을 가지게 된다. Th2세포는 IL-4, IL-5 등에 의해 B세포에서 IgE를 생산시키고 호산구를 활성화시켜 혈액 내에 IgE와 Histamine 등의 독성 물질들의 함량을 높이고 면역세포를 피부로 침윤시켜 아토피피부염을 더 악화시킨다. 반면, Th1 세포에 의해 생성 되어진 IL-12와 IFN-γ 등은 Th2로 인하여 생성 되는 IL-4, IL-5 등을 억제하는 역할을 한다24-27).
본 연구에서 GMD 경구투여가 IgE와 Histamine에 영향을 주는 것을 알아보기 위해 실험한 결과 IgE level은 음성대조군에 비해 모든 투여군에서 유의한 감소가 나타났으며 Hitamine level은 고농도(400mg/kg) 투여군에서 유의한 감소가 나타났다(Fig. 3, 4).
GMD 경구투여가 각종 Cytokine들에 영향을 주는 것을 알아보기 위해 실험한 결과, 모든 투여군에서 IL-1β, IL-6 및 TNF-α는 모두 감소하였고(Fig. 5, 9, 11), GMD 400mg/kg 투여군에서 IL-4, IL-5, IL-10는 감소하였으며(Fig. 7, 8, 10) IL-2, IFN-γ는 증가하였다(Fig. 6, 12). 위 결과를 토대로 GMD는 Th1 Cytokine은 활성화시키고 Th2 Cytokine은 억제하여 아토피피부염의 면역학적 불균형을 완화시켜 준다는 것을 확인할 수 있다.
GMD 경구투여가 혈액 내 면역세포에 영향을 주는 것을 알아보기 위해 실험한 결과, 모든 투여군에서 Basophil은 차이가 없었고(Fig. 17), Monocyte와 Eosinophil는 모든 투여군에서 유의하게 감소하였으며(Fig, 14, 16) GMD 400mg/kg 투여군에서 White blood cell, Neutrophil는 유의한 감소를(Fig. 13, 15) Lymphocyte는 유의한 증가를 보였다(Fig. 18). Basophil에는 유의미한 차이는 없었으나 Monocyte, Eosinophil, White blood cell, Neutrophil는 감소하고 Lymphocyte는 유의한 증가를 보이는 것을 토대로 GMD가 혈액 내 면역세포에 작용하여 염증반응을 경감시켜주는 것을 확인할 수 있다.
상처의 재생 및 치유를 위해서는 혈관 손상의 회복이 가장 중요한데 이 과정은 vascular endothelial call growth factor(VEGF), transforming growth factor beta 1(TGF-β1), epidermal growth factor(EGF) 등의 Cytokine에 의해 이루어진다28).
또한, filaggrin은 피부장벽을 형성하고 보습하는 기능을 가진 단백질로, filaggrin 유전자 기능상실 변이가 일어나면 손상된 피부장벽을 통해 항원이 쉽게 투입되어 Th2 면역반응, 선천 면역 활성화 등 각종 면역반응을 일으켜 아토피피부염을 유발한다29).
GMD가 피부재생에 효과가 있는지 알아보기 위해 실험한 결과, filaggrin은 GMD 400mg/kg 투여군에서 유의하게 증가하여 피부장벽 형성에 도움을 주는 것을 확인할 수 있고(Fig. 19) VEGF와 EGF 또한 GMD 400mg/kg 투여군에서 유의하게 증가하였으며(Fig. 20, 22) TGF-β1은 모든 투여군에서 유의한 증가(Fig. 21)를 보여 GMD가 손상 받은 피부조직의 재생 및 치료에 도움을 주는 것으로 나타났다.
실험이 끝난 후, 쥐의 등 피부조직을 채취하여 피부두께와 호산구 침윤의 변화를 측정한 결과, 모든 투여군은 음성대조군에 비해 epidermis와 dermis의 두께가 감소(Fig. 23)하였으며 호산구 침윤 또한 감소(Fig. 24)한 것을 확인할 수 있었다.
이상의 결과들을 종합하여 볼 때, GMD는 아토피 피부염에 있어 피부재생 및 면역, 항염증과 관련하여 효과가 있을 것이라 판단되어진다. GMD는 항염증 작용 뿐만 아니라 피부장벽 형성에도 도움을 주는 것으로 보아 외용제로서의 효과 또한 충분히 고려되므로 아토피피부염 치료제로서 GMD가 다양한 제제로 활용 가능한 연구들이 추후 필요하리라 사료된다.
또한, GMD는 항스트레스 및 불면 등 정신과적 질환에 다용되는 처방으로 피부증상 이외에도 수면장애, 감정적, 신체적 스트레스, 사회생활 등에 제한을 주는 아토피피부염 환자들의 삶의 질을 개선시키는데 도움이 되리라 사료되며 본 연구결과를 바탕으로 다양한 임상실험 및 효능 보강이 이루어진다면 아토피피부염 치료를 동반한 피부조직의 회복 및 재생에 대한 한의학적 처방으로써 활용이 가능할 것으로 사료된다.
Ⅴ. 결 론
甘麥大棗湯 (GMD) 추출물의 아토피 피부염에 대한 효과를 검증하기 위해 DNCB를 통해 아토피를 유발시킨 Nc/Nga mice로 실험한 결과 다음과 같은 결론을 얻었다.
-
육안적 평가 결과, GMD 투여군은 음성대조군에 비해 증상이 유의성 있게 호전되었다.
-
IgE을 측정한 결과, GMD 투여군은 음성대조군에 비해 유의성 있게 감소시켰다.
-
Histamine을 측정한 결과, GMD 200mg/kg을 제외한 GMD 투여군은 음성대조군에 비해 유의성 있게 감소시켰다.
-
Cytokine을 측정한 결과, GMD 200mg/kg은 TNF-α, IL-1β, IL-6를 음성대조군에 비해 유의성 있게 감소시켰다. GMD 400mg/kg은 IL-1β, IL-4, IL-5, IL-6, IL-10, TNF-α를 유의성 있게 감소시켰고 IL-2, IFN-γ를 유의성 있게 증가시켰다.
-
면역세포를 확인한 결과, 모든 실험군은 basophil의 차이를 나타내지 않았으며, 모든 GMD 투여군은 monocyte와 eosinophil을 음성대조군에 비해 유의성 있게 감소시켰으며, GMD 400mg/kg 투여군만 white blood cell, neutrophil을 유의성 있게 감소시키고 lymphocyte를 유의성 있게 증가시켰다.
-
유전자 발현량을 측정한 결과, 모든 GMD 투여군은 TGF-β1을 음성대조군에 비해 유의성 있게 증가시켰으며, GMD 400mg/kg 투여군에서 filaggrin과 VEGF, EGF가 유의성 있게 증가시켰다.
-
호산구 침윤 변화와 피부조직 내의 표피와 진피의 두께를 확인한 결과, 모든 GMD 투여군에서 음성대조군에 비해 감소하였다.






