Ⅰ. 서 론
염증반응이란, 체내에 바이러스 같은 외부 유해물질이 유입되는 경우, 면역세포가 이를 인지하여 다양한 염증매개물질을 분비해 몸을 보호해주는 기전이다. 그러나 지속적인 염증반응은 점막 손상을 촉진시켜 통증, 부종, 발작, 발열 등을 일으켜 기능장애를 유발한다1). 내독소로 잘 알려진 lipopolysaccharide(LPS)는 그람-음성균의 세포외막에 존재하고, 대식세포 표면의 toll-like receptor4(TLR4)에 의해 인지되어 주요한 염증의 원인으로 작용한다2). 대식세포가 자극을 받으면 다양한 염증인자를 발병하여 prostaglandin(PG) pathway를 활성화시켜 염증반응을 유발한다3,4). 이 염증반응은 nuclear factor kappa B(NF-κB)로 부터 시작하여 초기 염증반응 유도 사이토카인(pro-inflammatory cytokine)인 interleukin(IL), tumor necrosis factor-alpha(TNF-α)와 염증매개물질인 cyclooxygenase-2(COX-2), inducible NOS(iNOS)등을 분비한다5). Nitric oxide(NO)는 NO synthase (NOS)에 의해 생성되고 특히 NOS 중 iNOS는 외부 자극이나 cytokine 등에 의해 유도되면 다량의 NO를 생산한다6). 반응성이 높은 NO가 병리적 원인에 의해 과도하게 형성되면 염증을 유발하여 조직의 손상 및 cytokine과 같은 염증 매개체의 생합성을 촉진시켜 염증을 심화시킨다7). 즉, iNOS와 COX-2의 발현과 NO, PGE2의 생성은 면역세포의 대표적인 염증반응이라고 볼 수 있다8). 또한 염증반응에서 cytokine과 더불어 다양한 자유기(free radical)가 생성된다. 자유기 reactive oxygn species(ROS)의 항산화 체계가 무너지면 oxidative stress가 발생하게 되어 염증이나 노화, 암 유발과 같은 다양한 병리학적인 변화를 일으킨다9).
최근 합성 제제인 Valsartan, Ranitidine 등이 발암 유발물질이라는 점이 밝혀지면서 안전성을 담보할 수 있는 한약 및 생약재에 대한 관심이 커지고 있다. 黃精, 何首烏, 白朮 등 한약재의 경우 오랜 처방으로 증명된 안전성과 항염증, 항산화 효능을 인정받아, 한방화장품 등의 원료로 다양하게 사용되고 있다10). 이와 같은 단일 한약재에 대한 연구 이외에 托裏消毒飮11), 仙方活命飮12) 등의 처방의 항염증에 대한 선행연구가 있다. 이 두 처방은 공통적으로 《東醫寶鑑 雜病篇 癰疽》13)에 수록된 처방으로, 癰疽文에 기록된 다른 처방도 항염 과가 있을 것으로 생각하였다. 五聖湯(Osung-tang, OST)도 《東醫寶鑑 雜病篇 癰疽》13)에 수록되어 있는 처방으로 甘草, 瓜蔞根, 金銀花, 大黃, 生薑, 皂角刺로 구성되어 있고, “疔疽生黃疱 中或紫黑色. 初發必先痒後痛, 先寒後熱, 四肢沈重, 頭痛, 心驚, 眼花. 若大重則嘔逆爲難治. 通治, 紫金錠·返魂丹·一捻金·神效奪命丹·蟾酥丸·獨蟾丸·五聖湯·還魂散·千金消毒散, 選用.” 의 내용으로 수록되어 있다. 따라서, 본 처방이 염증반응에 대한 억제 효과가 있을 것으로 생각되나, 현재까지 OST에 대한 실험적 연구는 미비한 실정이다. 이에 본 연구는 OST에 대한 항염증 및 항산화 효과를 확인하고자 대식세포의 NF-κB 경로 억제 및 염증반응에서 생성되는 자유기의 소거능을 밝히고자 한다.
Ⅱ. 재료 및 방법
OST에 사용된 약재는 ㈜HMAX에서 구입하여 사용하였다. 구입한 약재들은 다음과 같다(Table 1).
Table 1의 한약재 210g을 정확하게 측량한 뒤 heating mantle에 3차 증류수 2,000㎖를 같이 넣은 뒤 4시간 가열하였다. 추출한 다음 추출액을 6시간 냉각시킨 후 거즈로 1차 여과하고 filter paper로 2차 여과한 후 감압 농축하여 100㎖의 농축액을 얻었다. 이 농축액을 초저온 냉장고에서 얼린 후 동결건조기를 이용하여 건조시켜 얻은 분말 25g을 시료로 사용하였다. 이 때 수율은 11.9%이다.
본 연구에 사용한 세포주인 RAW 264.7 macrophage cells은 American Type Culture Collection(ATCC)에서 구입하여 사용하였다. 배양 시 배지는 10% fetal bovine serum(FBS: GenDEPOT, USA)과 1% penicillin/streptomycin(GenDEPOT, USA)이 첨가된 Dulbecco’s modified eagle’s medium(DMEM: GenDEPOT, USA)을 사용하였으며, 37℃, 5% CO2 조건에서 안정화시켰다.
세포 생존율 측정은 3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyltetrazolium bromide(MTT) assay로 진행하였다. RAW 264.7 cells을 96-well plate에 5×104cells/well로 분주한 뒤 24시간동안 37℃, 5% CO2 조건에서 안정화시켰다. 상층액 제거 후 OST 시료를 농도별(50, 100, 200, 400µg/㎖로 100㎕씩 넣고 24시간 동안 배양하였다. 24h 후 상층액을 제거하고 MTT(4㎎/㎖) 시약을 20㎕ 처리하여 4시간동안 37℃, 5% CO2가 공급되는 배양기에서 배양하였다. 배양 후 상층액을 제거하고 dimethyl sulfoxide(DMSO)로 세포를 용해시켰다. 생성된 formazan을 spectro-photometer(SpectraMax 190; Molecular Devices, Sunnyvale, California, USA)를 이용하여 570㎚에서 흡광도를 측정하였다.
LPS(Sigma, USA)로 염증이 유도된 RAW 264.7 cells을 사용하여 NO의 생성능을 측정했다. RAW 264.7 cells를 96-well plate에 5×104cells/well이 되도록 분주한 뒤, 24시간동안 37℃, 5% CO2 조건에서 안정화시켰다. 상층액을 제거하고 LPS(1㎍/㎖)와 시료를 농도별(50, 100, 200, 400㎍/㎖)로 동시에 처리하여 배양하였다. 24시간 후 배양한 상등액 100㎕을 다른 96well plate에 옮겨 준 뒤 Griess reagent (Sigma, USA) 100㎕를 섞어 30분 동안 반응시킨 후 spectrophotometer를 이용하여 540㎚에서 흡광도를 측정하였다.
RAW 264.7 cells를 6-well plate에 5×105 cells/well이 되도록 분주하고 24시간동안 37℃, 5% CO2가 공급되는 배양기에서 안정화시켰다. 그 후 LPS(1㎍/㎖)와 OST을 농도별(50, 100, 200 및 400㎍/㎖)로 1㎖씩 동시에 처리하여 24시간 배양하였다. 상층액을 제거하고 1× PBS buffer로 1회 세척하였다. 각 well에 Trizol(Ambion, USA)을 1㎖ 처리한 후 e-tube에 옮겨 chloroform(Sigma, USA)을 200㎕ 넣어주었다. 원심분리 후 다른 e-tube에 상층액을 옮기고 상층액과 동일한 양의 isopropanol(Sigma, USA)을 처리 후 원심분리하여 상층액을 제거하였다. Pure 75% ethanol(DUKSAN, Korea)로 washing하고 다시 원심분리를 하여 RNA를 추출하였다. 정량한 RNA는 TOYOBO Revetra ACE-α® FSK101(TOYOBO, Japan)를 사용하여 cDNA를 합성하고 분석에 사용하였다. cDNA 합성 후 TaqMan™ probe, 멸균수, primer를 넣고 정량한 cDNA를 혼합하여 total volume을 20㎕로 맞추었다. 그 후 iNOS, COX-2 및 NF-κB를 확인하였다. 실험에 사용된 probe들은 Table 2에 나타냈다.
| Symbol | Genename | Assay ID |
|---|---|---|
| GAPDH | Glyceraldehyde-3-phosphate dehydrogenase | Mm99999915_g1 |
| iNOS | Inducible nitric oxide synthase | Mm00440502_m1 |
| COX-2 | Cyclooxygenase-2 | Mm00478374_m1 |
| NF-κB | Nfκb1 | Mm00476361_m1 |
RAW 264.7 대식세포를 5×105cells/well로 6-well plate에 분주한 뒤 37℃, 5% CO2 incubator에 24시간 동안 안정화시켰다. OST를 농도별(50, 100, 200, 400㎍/㎖)로 LPS(1㎍/㎖)와 동시에 처리하여 24시간 배양하였다. 그 후 lysis buffer를 첨가해 세포를 용해시킨 후 원심분리하여 세포막 성분들을 제거하였다. 얻은 단백질은 BCA assay(Thermo fisher, USA)를 이용하여 정량하였다. 단백질을 5X SDS-PAGE Loading dye (Biosolution, Korea)을 사용하여 염색해준 뒤 전기영동 시켰다. Membrane(Amersham™ Hybond™ P 0.45 μM PVDF; GE Healthcare Life Sciences, UK)을 95% ethanol (DUKSAN, Korea)에 활성화시켜 transfer를 진행하였다. 단백질이 모두 membrane으로 이동하면 5% skim milk(BD bio, USA)에 50분 동안 blocking 하였다. iNOS, COX-2, p-IκB antibody(Cell signaling, USA)를 1% skim milk와 1 : 5,000의 비율로 희석하여 overnight 하였다. Tris Buffered Saline with Tween 20(TBST)로 washing한 뒤 secondary antibody(Cell signaling, USA)를 2% skim milk와 1 : 10,000의 비율로 희석하여 2시 간동안 shaking 해주었다. 2시간이 지난 뒤 TBST로 washing 후 발현된 단백질을 측정하였다.
DPPH(Sigma, USA) 용액으로 OST의 radical 소거 능력을 실험하였다. 99% methanol (Honey well, USA)과 증류수를 1 : 1의 비율로 섞은 용액에 OST를 최종농도 50, 100, 200, 400㎍/㎖가 되도록 첨가하였다. 각각 만들어진 시료를 50㎕씩 취하여 DPPH (250mM) 50㎕와 혼합한 뒤 실온에서 빛을 차단하고 30분 반응 후 spectrophotometer를 이용하여 517㎚에서 흡광도를 측정하였다. 이 때 활성비교를 위해 positive control 시약으로 ascorbic acid (Sigma, USA)를 사용하였다.
Ⅲ. 실험결과
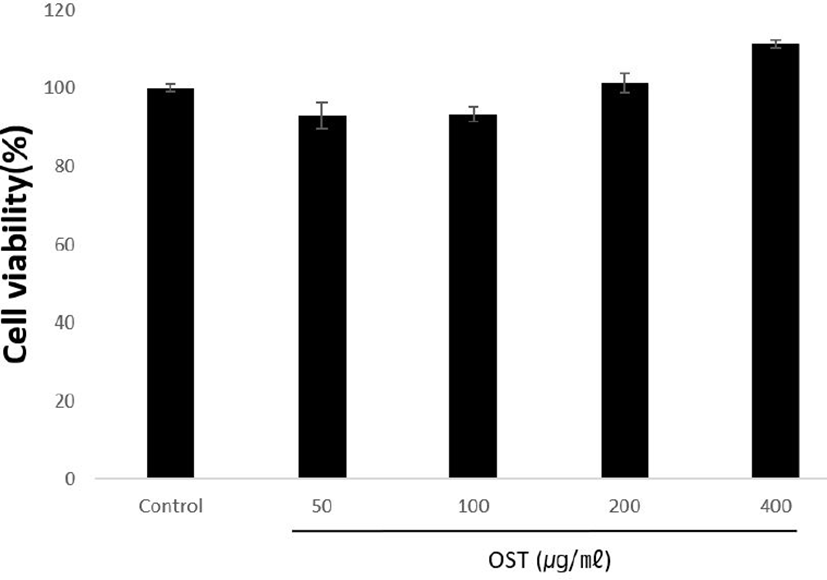
OST을 각각 50, 100, 200, 400㎍/㎖의 농도로 처 리한 RAW 264.7 세포의 생존율을 확인한 결과 control군에 비해 93.04 ± 3.45%, 93.36 ± 1.80%, 101.22 ± 2.51%, 111.20 ±1.09%으로 나타났다. RAW 264.7 세포에서 OST 추출물 50-400㎍/㎖의 농도범위에서 독성이 없음을 확인하였다(Fig. 1).
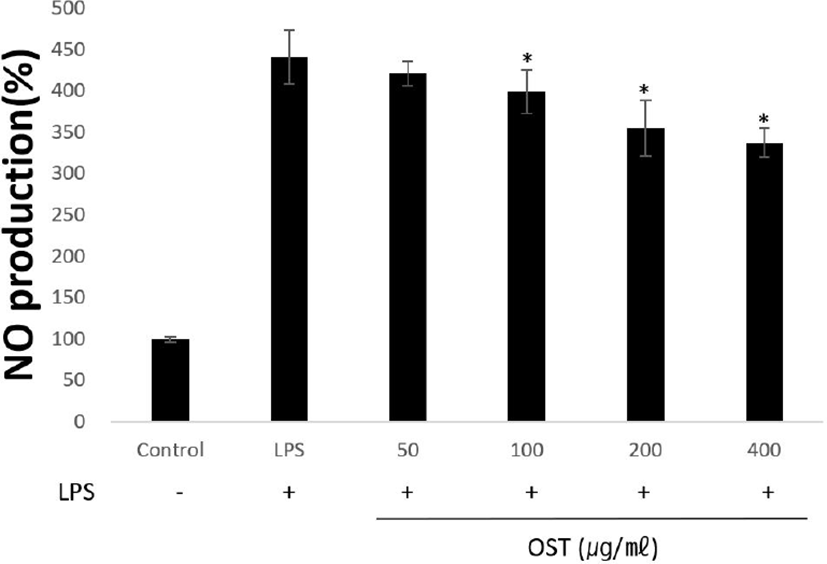
RAW 264.7 cells에서의 OST의 NO 생성 저해 효과를 측정하였다. OST 농도 50, 100, 200 및 400㎍/㎖와 LPS(1㎍/㎖)를 동시에 처리 후 LPS만 처리한 군과 비교하였다. NO의 생성율은 LPS만 처리한 군에선 441.52 ± 32.34% 증가하였다. LPS와 OST을 농도별로 처리한 군에선 421.38 ± 14.58%, 399 ± 26.16%, 355.53 ± 33.67%, 337.84 ± 17.48%으로 나타나 LPS 처리군에 비하여 농도 의존적으로 감소하였다(Fig. 2).
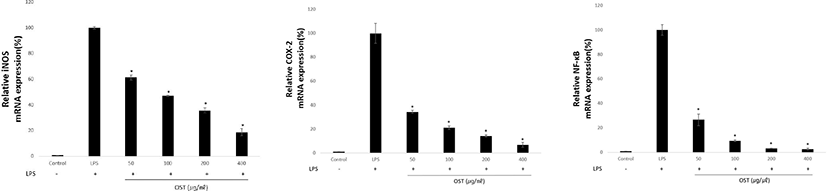
LPS 자극에 의해 염증반응이 유도된 세포에서 OST가 iNOS, COX-2 및 NF-κB의 mRNA발현에 미치는 영향을 real-time PCR로 조사하였다. iNOS, COX-2 및 NF-κB의 발현이 감소하는 것으로 보아 OST은 염증매개물질인 NF-κB 발현 저해를 통해 iNOS와 COX-2를 억제시켜 항염증 효능을 나타냈다(Fig. 3).
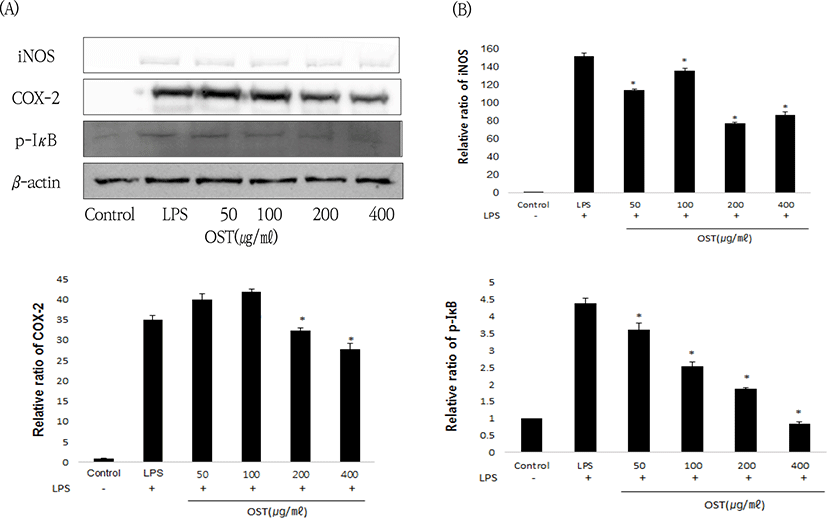
LPS로 유도된 RAW 264.7 cells에서 western blotting을 사용하여 염증 매개 단백질인 iNOS, COX-2 및 p-IκB의 발현 양을 확인하였다. LPS 처리군은 iNOS, COX-2와 p-IκB의 발현이 증가하였고, OST를 50, 100, 200 및 400㎍/㎖로 처리한 군들에서 iNOS, COX-2와 p-IκB의 발현이 LPS만 처리한 군에 비해 농도 의존적으로 감소하는 경향을 나타냈다. 발현 된 단백질의 진하기 정도는 image J를 이용한 image analysis를 통해 확인하였다. 따라서 OST은 RAW 264.7 cells에서 mRNA 수준과 비슷하게 iNOS, COX-2와 p-IκB의 단백질 발현을 감소시키는 것으로 확인되었다(Fig. 4).
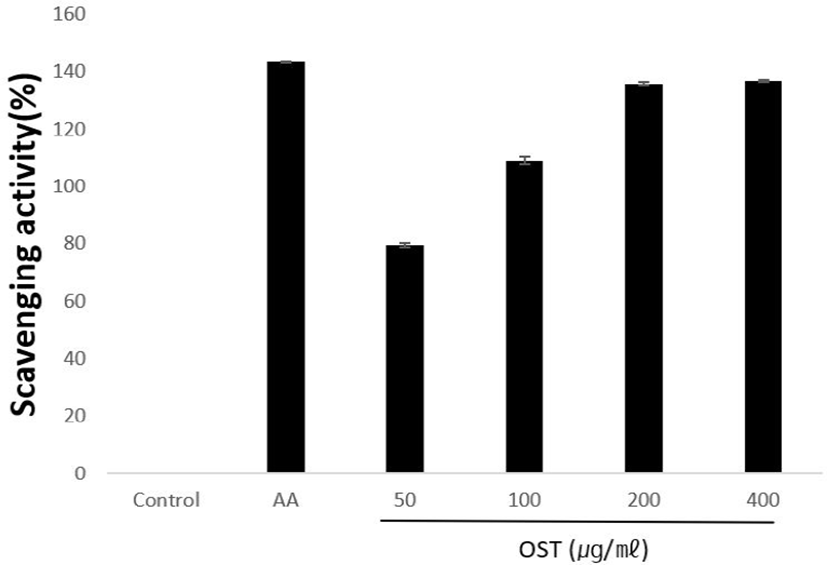
DPPH를 사용하여 radical 소거율을 측정하였다. OST를 농도별로 50, 100, 200 및 400㎍/㎖를 처리한 결과 radical 소거율이 79.47 ± 0.84%, 109.06 ± 1.15%, 135.96 ± 0.45% 및 136.95 ± 0.31%로 농도 의존적으로 증가함을 나타냈다(Fig. 5).
Ⅳ. 고 찰
OST는 朝鮮代 許浚의 《東醫寶鑑 雜病篇 癰疽》13)에 수록되어 있으며, “疔疽生黃疱 中或紫黑色. 初發必先痒後痛, 先寒後熱, 四肢沈重, 頭痛, 心驚, 眼花. 若大重則嘔逆爲難治. 通治, 紫金錠·返魂丹·一捻金·神效奪命丹·蟾酥丸·獨蟾丸·五聖湯·還魂散·千金消毒散, 選用.” 이라 하여 疔疽를 치료하는 처방으로 제시되어 있다. 疔疽는 한의학 피부질환인 疔과 疽가 혼재되어 있는 것으로, 疔은 瘡形은 적고 瘡根은 깊은 것으로 발병이 비교적 迅速하고 쉽게 惡化되며 비교적 위급한 瘡瘍이며, 疽는 急性 化膿性 疾患으로 肌膚間에 발생하는 有頭疽와 骨格과 關節사이에 발생하는 無頭疽로 나뉘며 焮熱紅腫脹痛하며 難消 難潰 難斂하는 특징이 있다14). 이와 같은 疔疽의 특징은 발적, 발열, 종창, 동통 기능장애의 증상을 보이는 조직 손상에 대한 생체의 자가 방어능력 중의 하나인 염증 반응의 산물이라 볼 수 있다15).
염증반응성 질환인 疔疽의 通治方 중 하나인 OST는 甘草, 瓜蔞根, 金銀花, 大黃, 生薑, 皂角刺로 구성된 처방으로 약재별 항염효과에 대해서는 다음과 같이 연구되어져있다. 甘草는 iNOS 활성화 억제 및 NO, PGE2를 감소시키는 효과가 있는 것으로, 瓜蔞根은 이명인 天花粉으로 더 알려진 약재로 이 天花粉은 LPS로 유도된 염증 상황에서 NO를 감소시키는 효과가 있는 것으로16), 金銀花는 TNF-α의 분비 및 iNOS의 활성화를 일부분 감소시키는 효과가 있는 것으로, 生薑은 type 2 helper T cell의 활성에 의해 유리되는 IL-4, IL-5 등을 억제시키는 것으로, 皂角刺는 LPS로 유도된 NO 생성 및 iNOS 발현억제를 시키는 효과가 있는 것으로17), 大黃은 LPS로 유도된 NO, TNF-α, IL-6, iNOS 등을 억제 하는 것으로 알려져 있다18).
OST를 구성하는 개별 약재들의 항염 효과는 상술한 것과 같이 연구가 되어 있으나, 개별 약재들의 복합물인 OST의 경우 선행 연구가 1례도 확인되지 않았다. 이에 본 연구는 LPS로 유도된 RAW264.7 cells에서 열수 추출된 OST의 항염증 효과와 항산화 효과를 평가하였다.
대식세포는 혈액단핵세포로부터 분화한 조직세포로 염증반응에서 방어적 역할을 담당한다19). TLR4에서 LPS를 인지한 염증반응의 과정은 전사인자인 NF-κB 조절 회로에 관여하는 것으로 알려져 있는데, 이를 통해 염증성 cytokine의 생산과 분비, arachidonic acid 신진대사 물질의 생산 증가를 유도한다2). 대식세포가 자극을 받아 NF-κB가 활성화되면 다양한 염증을 발병하는 인자로 알려진 TNF-α, IL-6, IL-1β등을 증가시켜 PG pathway를 활성화시켜 염증반응을 유도한다3,4). NO는 reactive nitrogen species(RNS)의 일종인 NOS에 의하여 L-arginine이 citrulline으로 산화될 때 생산되는 반응성이 높은 radical로, 일반적으로 박테리아를 사멸시키거나 종양을 제거하는 중요한 역할을 한다20). NO는 endothelium-derived relaxing factor(EDRF)로서 세포 내 cGMP의 생산을 유도하여 혈관내피 평활근의 이완을 일으킨다고 알려져 있다21). 과도하게 생성된 NO는 toxic radical로 작용하여 세포나 조직의 손상을 일으켜 염증 질환에 있어서 NO가 염증을 유발하는 인자로 생각되기도 한다20). LPS로 유도된 RAW 264.7 세포에서 NO assay를 이용하여 NO의 생성량을 측정하였다. LPS만 처리한 군에 비해 LPS와 OST을 동시에 처리한 군에서 농도 의존적으로 NO의 생성이 감소하는 것을 확인하였다(Fig. 2).
NOS는 endothelial NOS(eNOS), neuronal NOS(nNOS), inducible NOS(iNOS)의 세 가지 주요한 isoform이 있다22). 특히 iNOS는 외부 자극이나 pro-inflammatory cytokine 등에 의해 자극받게 되면 hepatocytes, smooth muscle cells, bone marrow cells, monocytes, macrophages 등 다양한 세포에서 발현되어 다량의 NO를 생산한다고 보고되고 있다6). 또한 외부 자극으로 인해 손상을 입은 세포는 세포막 인지질로부터 arachidonic acid 가 유리되어 COX가 되며, COX는 PG류의 다양한 염증반응 매개인자를 생성하는데, PG중에서도 PGE2가 염증반응에 관련이 있어 종양의 세포사멸을 억제하여 종양생성에 기여한다23,24). NF-κB는 정상적인 환경에서는 세포질에서 inhibitory subunit인 inhibitor kappa Bα(IκBα)와 결합된 비활성형을 형성하지만 inflammatory cytokines, mitogens, UV, oxidant 등의 여러 자극에 의해 IκB 단백질이 인산화되며 NF-κB는 핵 안으로 이동해 해당 DNA의 promoter, enhancer 등의 조절요소로 작용한다3). RAW 264.7 세포에 LPS와 OST을 동시에 처리하여 iNOS와 COX-2, NF-κB의 mRNA 발현을 realtime PCR로 확인한 결과, LPS에 의해 증가된 iNOS와 COX-2 및 NF-κB가 OST에 의해 감소되는 것을 확인하였다(Fig. 3). iNOS와 COX-2 및 p-IκB를 단백질 수준에서도 조사하기 위해 RAW 264.7 세포에 LPS와 OST을 처리한 결과, 유전자 발현 수준과 비슷한 경향을 나타내었다(Fig. 4).
자유기 중 reactive oxygen species(ROS)는 세포 내의 미토콘드리아에서 호흡과 면역반응에 의한 산소의 산화와 환원 과정을 통해 끊임없이 생성된다. 하지만 정상적으로 ROS는 체내에 존재하는 항산화 체계의 작용으로 제거되면서 균형을 이루고 있다. 항산화 체계의 작용이 무너지면 oxidative stress가 발생하게 되어 염증이나 노화, 암 유발과 같은 다양한 병리학적인 변화를 일으킨다. 실제로 많은 임상 질환에서 oxidative stress가 증가되는 것이 확인되었다25). 생체막 구성성분인 인지질의 불포화지방산은 활성 산소종과 같은 free radical에 의해 과산화 반응이 개시되며 연쇄적으로 진행된다. Free radical에 의한 과산화 반응은 세포막의 투과성을 증가시키고 전반적인 세포독성을 초래하여 노화 현상이나 여러 가지 질환의 병리현상을 유도함으로써 발암 과정에도 관여한다25,26). OST의 항산화 효과를 입증하기 위해 DPPH를 진행한 결과, positive control인 ascorbic acid는 radical 소거능이 143.45%로 나타났고 OST은 농도 의존적으로 소거능이 증가하여 최고 농도인 400㎍/㎖에선 136.95%까지 나타났다(Fig. 5).
이상의 결과는 OST가 LPS로 유도된 염증성 RAW 264.7 세포에서 염증반응을 억제하고 DPPH radical 소거 활성을 통해 항산화 효과가 있음을 확인하였다. 따라서 OST의 염증억제 효과와 항산화 효과는 항원 혹은 자극물질의 자극 후 면역세포의 활성화로 cytokine이 분비되며 염증세포의 침윤이 일어남으로써 발생하는 만성 염증성 피부 질환에 응용할 수 있을 것으로 판단된다. 만성 염증성 피부 질환 중 하나인 아토피피부염은 만성염증의 재발이 지속되는 만성재발성 습진의 일종으로 여러 면역 기전의 이상반응으로 발생하는 질환이다27). 여러 면역 기전 중 IκB protein가 인산화 된 후 NF-κB가 핵으로 들어가 target 유전자의 NF-κB binding site에 결합하여 iNOS, NO 등 염증 반응 유발 요소가 지속되는 것이 현재 규명된 아토피피부염의 원인 중 하나이다28). OST는 NF-κB를 억제함으로써 iNOS, NO 등을 억제할 수 있으며, 이런 측면에서 아토피피부염 등을 포함한 다양한 만성 염증성 피부 질환에 대한 치료 소재로서 활용할 수 있을 것으로 사료된다.
Ⅴ. 결 론
OST의 항염증과 항산화 효과를 조사하기 위해 NO, iNOS, COX-2. NF-κB 생성조절 및 DPPH free radical 소거능 실험한 결과 다음과 같은 결론을 얻었다.
-
OST를 염증매개물질 억제효과를 확인하기 위하여 마우스 대식세포인 RAW 264.7 cells에 OST를 50~400㎍/㎖의 농도별로 처리한 결과 세포독성은 없었다.
-
RAW 264.7 cells에 LPS를 처리하여 증가된 NO의 생성과 사이토카인을 농도 의존적으로 유의성 있게 감소시킨 것을 확인할 수 있었다.
-
OST는 LPS에 의해 유도된 iNOS 및 COX-2, NF-κB의 mRNA 발현과 iNOS와 COX-2, p-IκB의 단백질 발현을 유의성 있게 감소시켰다.
-
OST는 DPPH radical 소거 활성에 미치는 효과에서도 농도 의존적으로 증가시켰다.






