Original Article / 원저
衛生湯의 LPS로 유도된 RAW264.7 세포에서 염증매개체에 대한 억제효과
Inhibitory Effects of Wisaengtang on Inflammatory Mediators in LPS-induced RAW264.7 Cells
Jung-Hee Kim1
,
Tae-Jun Kim2
,
Ee-Hwa Kim3
,
Yong-Min Kim4,*
Author Information & Copyright ▼
2세명대학교 한의과대학 한방안이비인후피부과학교실 (수련의)
3세명대학교 한의학과대학 경락경혈학교실 (교수)
1Dept. of Bio Fusion Science, Semyung University
2Dept. of Korean Medical Ophthalmology & Otolaryngology & Dermatology, College of Korean Medicine, Semyung University
3Dept. of Acupoint & Meridian, College of Korean Medicine, Semyung University
4Dept. of Bio Fusion Science, Semyung University
*Corresponding author : Yong-Min Kim, Dept. Of Cosmetic Sciences & Beauty Biotechnology, Semyung University, Jecheon, Chungbuk 27136, South Korea. (Tel : 043-653-6303, E-mail :
dragonroom@hanmail.net)
© 2019 the Society of Korean Medicine Ophthalmology & Otolaryngology & Dermatology. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution NonCommercial-ShareAlike License (http://creativecommons.org/licenses/by-nc-sa/3.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Jul 02, 2019 ; Revised: Jul 24, 2019 ; Accepted: Aug 05, 2019
Published Online: Aug 31, 2019
Abstract
Objectives : This study examined the inhibitory effects of Wisaengtang(WST) on inflammatory mediators(NF-κB, COX-2, iNOS, IL-6) in cellular inflammatory responses induced by lipopolysaccharide(LPS).
Methods : To investigate the cytotoxicity of WST, MTT assay was used. The inhibitory effects of inflammatory mediators were confirmed by real-time PCR and DPPH scavenging activity was measured to confirm the antioxidative effect.
Results : When the NF-κB mRNA expression was inhibited, the levels of COX-2, iNOS, and IL-6 mRNA in the inflammatory response decreased significantly. iNOS is involved in the production of nitric oxide (NO), and it is confirmed that WST inhibits the expression of iNOS mRNA and thus the production of NO.
Conclusions : These results suggest that WST can be a therapeutic substance for oxidation and inflammation through elimination of DPPH free radical and inhibition of NF-κB activity.
Keywords: Wisaengtang(WST); Inflammatory mediators; nitric oxide(NO); Oxidation; Inflammation
Ⅰ. 서 론
염증은 만성 통증, 심혈관 질환, 노화, 자가 면역 질환 등에 대한 인체의 방어기전이다1). 그러나 지속적인 염증반응은 만성염증질환 및 종양 등의 유발 원인이 되기도 한다2). Lipopolysaccharide(LPS)는 인지질, 다당류 및 소량의 단백질로 구성되어 있으며 염증반응을 유발하는 인자로 다양한 cytokine과 염증매개물질을 생성시킨다. 그리하여 염증반응을 연구하는 경우 자주 사용하는 실험모델로 확립되어 있다5). LPS 등과 같은 일차적인 자극에 의해서4) 염증반응이 일어나게 되면 대식세포와 같은 면역세포들은 NF-κB로 부터 시작하여 초기 염증반응 유도 사이토카인(pro-inflammatory cytokine)인 interleukin(IL), tumor necrosis factor-alpha(TNF-α)와 염증매개물질인 cyclooxygenase-2(COX-2), inducible NOS(iNOS)등을 분비한다3). 이와 같은 염증매개물질들의 형성은 arachidonic acid가 leukotriene, thromboxane, prostaglandin 등으로 바뀌는 과정 및 nitricoxide(NO)의 대량 생성에 관여하게 되며, 숙주에 치명적 결과를 초래한다고 알려져 있다6). 이 중 NO는 반응성이 높은 물질로 NO synthase(NOS)는 L-arginine으로부터 생성되며 NOS는 constitutive NOS와 iNOS로 나누어진다. 과잉 생산된 NO는 조직의 손상, 유전자 변이, 신경 손상7), 혈관 투과성 및 부종 등의 염증반응을 촉진한다고 보고되고 있다. 즉, iNOS와 COX-2의 발현과 NO, prostaglandin E2(PGE2)의 생성은 면역세포의 대표적인 염증반응이라고 볼 수 있다6,8).
최근 천연을 선호하는 소비자의 기호성 증대와 더불어 사회 전반적인 웰빙 열풍을 타면서 한약 및 생약재를 이용한 신제품을 개발하려는 시도가 많이 이루어지고 있다. 衛生湯(Wisaengtang, WST)은 《醫學心悟 附錄 外科症治方藥》9)에 수록되어 있는 처방으로 白芷, 連翹, 天花粉, 荊芥, 甘草, 牛蒡子, 防風, 乳香, 沒藥, 金銀花, 貝母, 當歸尾로 구성되어 있고, “解毒消癰 淸熱 活血 止痛 初起相宜” 하는 효능으로 염증반응의 억제에 사용 가능한 처방으로 생각되나, 현재까지 본 처방에 대한 실험적 연구는 미비한 실정이다. 이에 본 연구에서는 WST가 LPS로 활성된 RAW 264.7 cell에서 cytokine 및 염증매개물질의 변화에 미치는 영향을 살펴보았다.
Ⅱ. 재료 및 방법
1. 약재
본 연구에서 사용된 약재는 ㈜HMAX에서 구입하여 사용하였다.
Table 1.
Contents of WST
| Herbal name |
Pharmacognostic Name / Scientific Name |
Weight(g) |
| 白芷 |
Angelicae Dahuricae Radix / Angelicadahurica |
12 |
| 連翹 |
Forsythiae Fructus / Forsythiaviridissima |
12 |
| 天花粉 |
Trichosanthis Radix / Trichosantheskirilowii |
12 |
| 荊芥 |
Schizonepetae Spica / Schizonepetatenuifolia |
16 |
| 甘草 |
Glycyrrhizae Radix et Rhizoma / Glycyrrhizauralensis |
16 |
| 牛蒡子 |
Arctii Fructus / Arctiumlappa |
16 |
| 防風 |
Saposhnikoviae Radix / Saposhnikovia divaricata |
20 |
| 乳香 |
Olibanum / Boswelliacarterii |
20 |
| 沒藥 |
Myrrha / Commiphoramyrrha |
20 |
| 金銀花 |
Lonicerae Flos / Lonicerajaponica |
32 |
| 貝母 |
Fritillariae Thunbergii Bulbus / Fritillariathunbergii |
24 |
| 當歸尾 |
Angelicae Gigantis Radix / Angelicagigas |
24 |
| total |
|
224 |
Download Excel Table
2. 시료 제조
본 연구에서 사용된 WST는 위의 한약재 224g을 정량한 후 heating mantle에 증류수 2000㎖와 함께 투여하고 4시간 가열하여 추출하였다. 추출액을 여과지로 여과한 후 감압 농축하여 100㎖의 농축액을 얻었다. 농축액을 초저온 냉동고에서 얼린 후 동결건조 시켰다. 동결건조 추출물은 46.5g을 얻었으며 수율은 20.8%이다.
3. 세포배양
본 연구에서 사용된 RAW264.7 cells은 37℃, 5% CO₂ 조건에서 10% FBS, penicillin(100units/㎖)이 첨가된 DMEM 배지로 배양하였다.
4. 세포생존율 측정
WST의 세포독성과 생존율을 알아보기 위하여 MTT assay를 실행하였다. RAW264.7 cells을 1×105cells/㎖의 농도로 96-well plate에 분주한 후 24hrs 동안 37℃, 5% CO₂ incubator에서 배양하였다. 24hrs 뒤 상층액 제거 후 WST를 농도별(25, 50, 100, 200, 400㎍/㎖)로 100㎕씩 처리해준 후 24hrs 동안 배양하였다. 24hrs 뒤 상층액을 제거한 후 4 ㎎/㎖의 3-(4,5-dimethylthiazol-2-yl)2,5-diphenyltetrazolium bromide (MTT; Bio basic, Canada)을 20㎕씩 처리하여 4hrs 동안 반응시켰다. 4hrs 뒤 상층액 제거 후 dimethyl sulfoxide(DMSO; Bio basic, Canada)를 첨가하여 spectrophotometer (Synergy HT, BIO-TEK, USA)를 이용하여 570㎚에서 흡광도를 측정하였다.
5. NO생성 측정
LPS (Sigma, USA)로 염증이 유도된 RAW 264.7 macrophage cells를 사용하여 NO의 생성능을 측정하였다. RAW264.7 cells을 1×105cells/well의 농도로 96-well plate에 분주한 후 24hrs 동안 37℃, 5% CO₂ incubator에서 배양하였다. 24hrs 뒤 상층액 제거 후 RAW264.7 cells에 LPS(1㎍/㎖)와 WST를 농도별(25, 50, 100, 200㎍/㎖)로 50㎕씩 동시에 처리하여 24hrs 동안 배양하였다. 24hrs 뒤 상층액 100㎕을 다른 96well plate에 옮겨 준 뒤 Griess시약 100㎕를 혼합하였다. 상온에서 30mins 동안 반응 후 spectrophotometer을 이용하여 540㎚에서 흡광도를 측정하였다.
6. Real-time PCR
RAW 264.7cells에서 WST의 NF-κB, COX-2, iNOS 및 IL-6의 발현 억제효과를 확인하기 위해 real-time PCR 분석을 진행하였다. 5×105cells/well의 농도로 6-well plate에 분주한 후 24hrs 동안 37℃, 5% CO₂ incubator에서 배양하였다. 24hrs 뒤 각각 25, 50, 100 및 200㎍/㎖의 WST와 1㎍/㎖의 LPS를 동시에 처리하여 배양하였다. 24hrs 후 Trizol reagent (Ambion, USA)를 사용하여 RNA 추출하였다. 추출된 RNA는 diethyl pyrocarbonate (DEPC treated-water; Sigma, USA)로 용해하여 사용하였고, total RNA(2㎍)를 정량 후 cDNA 합성 kit (Revetra ACE-α-; Toyobo, Japan)를 통해 cDNA를 합성하였다. cDNA 합성 후 tagman master mix(Thermo fisher, USA) 10㎕, 멸균수 4㎕, primer 1㎕, cDNA 5㎕를 혼합하여 준비하였다. NF-κB, COX-2, iNOS 및 IL-6를 확인하였다. 실험에 사용된 probe들은 Table 2에 나타냈다(Table 2).
Table 2.
Gene Name and Assay ID Number in real-time PCR Analysis
| Symbol |
Gene name |
Assay ID |
| GAPDH |
Glyceraldehyde-3-phosphate dehydrogenase |
Mm99999915_g1 |
| COX-2 |
Cyclooxygenase-2 |
Mm478374_m1 |
| iNOS |
Inducible nitic oxide synase |
Mm00440502_m1 |
| IL-6 |
Interleukin-6 |
Mm00446190_m1 |
| NF-κB |
Nfkb1 |
Mm00476361_m1 |
Download Excel Table
7. DPPH radical 소거능 측정
WST의 free radical 소거능을 측정하기 위해 DPPH (Sigma, USA) 용액으로 실험하였다. 99% methanol (Honey well, USA)과 증류수를 1:1 비율로 섞은 용액에 WST를 최종농도 25, 50, 100 및 200㎍/㎖가 되도록 첨가하였다. 각각 만들어진 시료를 50㎕씩 취하여 DPPH (250mM) 50㎕와 혼합한 뒤 실온에서 빛을 차단하고 30mins 반응 후 spectrophotometer을 이용하여 517㎚에서 흡광도를 측정하였다.
8. 통계처리
모든 데이터는 평균 ± 표준편차로 표시하였으며, 실험결과는 SPSS 12.0 version(SPSS Inc., Chicago IL, USA) 프로그램을 이용하였다. WST의 효과를 판정하기 위한 통계학적 분석은 student t-test를 통하여 비교 분석하였다. WST의 농도를 각각 25, 50, 100 및 200㎍/㎖ 처리 했을 때를 대조군과 비교하였다.
Ⅲ. 결 과
1. 세포 생존율
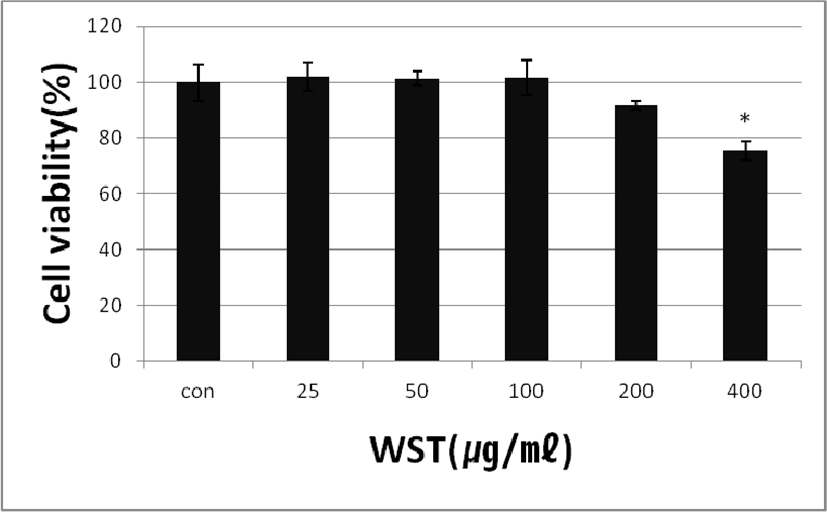
WST의 농도별 세포 생존율을 확인하기 위하여 배양 한 세포에 WST를 농도별(25, 50, 100, 200 and 400㎍/㎖)로 24시간 동안 처리하여 세포생존율을 측정하였다. 그 결과 세포생존율은 대조군에 비해서 각 102.08 ± 5.10%, 101.29 ± 2.59%, 101.57 ± 6.15%, 91.75 ± 1.46% 및 75.53 ± 3.38%로 나타났다. 400㎍/㎖농도부터는 독성이 있는 것으로 판단하여 200㎍/㎖농도까지 다음 실험을 진행하였다(Fig. 1).
Fig. 1.
Effect of WST on Cytotoxic in RAW 264.7 Cells. Con: untreated group; 25, 50, 100, 200 and 400: treated with WST(25, 50, 100, 200 and 400㎍/㎖).
*p<0.05 indicates different from control group.
Download Original Figure
2. NO생성억제 효과
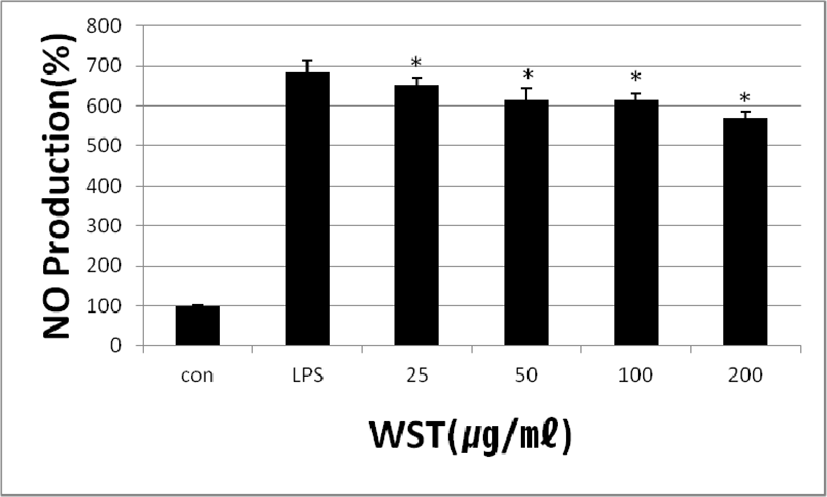
WST의 RAW264.7 cells에서의 NO생성억제의 효과를 관찰하였다. 배양한 세포에 LPS와 WST(25, 50, 100 and 200㎍/㎖)를 24시간 동안 처리하였을 때 LPS만 처리한 세포에서는 NO의 생성량이 683.58 ± 32.23%로 나타났고, LPS와 WST를 함께 처리한 세포에서는 농도별로 652.23 ± 18.53%, 615,76 ± 25.80%, 614.11 ± 16.98% 및 567.76 ± 18.3%로 WST의 농도가 증가함에 따라 유의성 있게 NO생성이 감소하는 것을 확인하였다(Fig. 2).
Fig. 2.
Effect of WST on NO Production in RAW 264.7 Cells. Con: untreated group; LPS: treated with LPS(1㎍/㎖); 25, 50, 100 and 200: treated with LPS and WST(25, 50, 100, 200㎍/㎖).
*p<0.05 compared to the control group.
Download Original Figure
3. Real-time PCR
1) COX-2의 유전자 발현 억제 효과
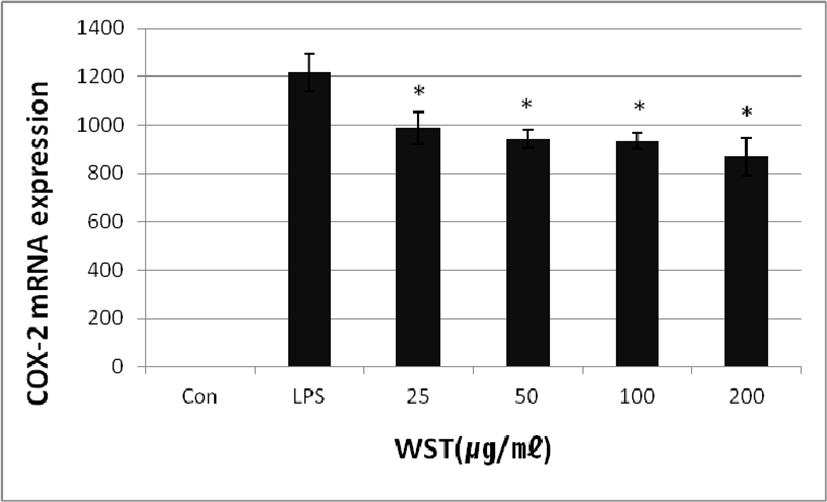
WST가 COX-2의 mRNA발현에 미치는 영향을 확인하기 위하여 real-time PCR을 실행하였다. 배양한 세포에 LPS와 WST(25, 50, 100 and 200㎍/㎖)를 24시간 동안 처리하였을 때 LPS만 처리한 세포에서는 COX-2의 발현량이 1219.62 ± 78.01%로 나타났고, LPS와 WST를 함께 처리한 세포에서는 농도별로 987.41 ± 67.10%, 942.84 ± 37.72%, 932.98 ± 33.59% 및 869.59 ± 76.41%로 나타났다. WST의 농도가 증가함에 따라 유의성 있게 COX-2 발현이 감소하는 것을 확인하였다(Fig. 3).
Fig. 3.
Effect of WST on LPS-induced Expression of COX-2 mRNA. Con: untreated group; LPS: treated with LPS(1㎍/㎖); 25, 50, 100 and 200: treated with LPS and WST(25, 50, 100 and 200㎍/㎖).
*p<0.05 compared to the control group.
Download Original Figure
2) iNOS의 유전자 발현 억제 효과
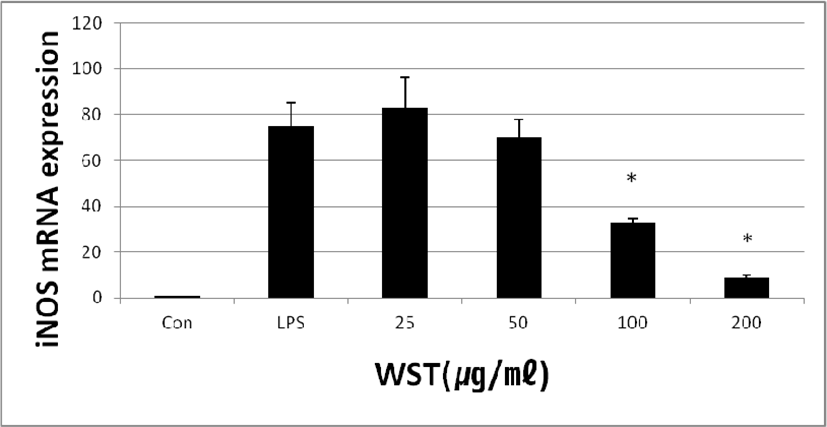
WST가 iNOS의 mRNA 발현량에 미치는 영향을 확인하기 위하여 real-time PCR을 실행하였다. 배양한 세포에 LPS와 WST(25, 50, 100 and 200㎍/㎖)를 24시간 동안 처리하였을 때 LPS만 처리한 세포에서는 iNOS의 발현량이 74.89 ± 10.25%로 나타났고, LPS와 WST를 함께 처리한 세포에서는 농도별로 82.71 ± 13.72%, 70.01 ± 7.88%, 32.93 ± 1.94% 및 8.86 ± 1.30%로 나타났다. WST를 농도별로 처리한 결과 농도의존적으로 iNOS의 mRNA의 발현이 감소하는 것을 확인하였다(Fig. 4).
Fig. 4.
Effect of WST on LPS-induced Expression of COX-2 mRNA. Con: untreated group; LPS: treated with LPS(1㎍/㎖); 25, 50, 100 and 200: treated with LPS and WST(25, 50, 100 and 200㎍/㎖).
*p<0.05 compared to the control group.
Download Original Figure
3) IL-6의 유전자 발현 억제 효과
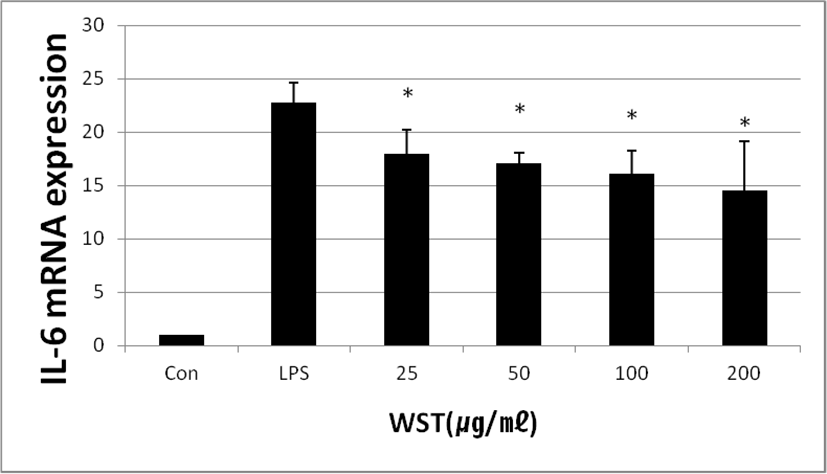
WST가 IL-6의 발현량에 미치는 영향을 확인하기 위하여 real-time PCR을 실행하였다. 배양한 세포에 LPS와 WST(25, 50, 100 and 200㎍/㎖)를 24시간 동안 처리하였을 때 LPS만 처리한 세포에서는 IL-6의 발현량이 22.75 ± 1.89%로 나타났고, LPS와 WST를 함께 처리한 세포에서는 농도별로 17.95 ± 2.28%, 17.10 ± 0.92%, 16.13 ± 2.13% 및 14.49 ± 4.61%로 나타났다. WST의 농도가 증가함에 따라 IL-6의 mRNA의 발현량이 감소하는 것을 확인하였다(Fig. 5).
Fig. 5.
Effect of WST on LPS-induced Expression of IL-6 mRNA. Con: untreated group; LPS: treated with LPS(1㎍/㎖); 25, 50, 100 and 200: treated with LPS and WST(25, 50, 100, 200㎍/㎖).
*p<0.05 compared to the control group.
Download Original Figure
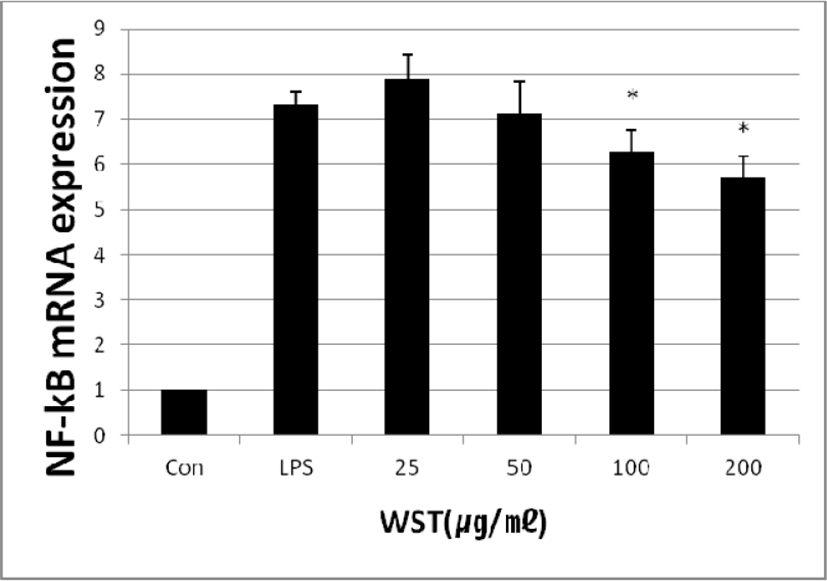
4) NF-κB의 유전자 발현 억제 효과
WST가 NF-κB의 발현량에 미치는 영향을 확인하기 위하여 real-time PCR을 실행하였다. 배양한 세포에 LPS와 WST(25, 50, 100 and 200㎍/㎖)를 24시간 동안 처리하였을 때 LPS만 처리한 세포에서는 NF-κB의 발현량이 7.34 ± 0.29%로 나타났고, LPS와 WST를 함께 처리한 세포에서는 농도별로 7.89 ± 0.53%, 7.12 ± 0.70%, 6.29 ± 0.48% 및 5.70 ± 0.48%로 나타났다. WST의 농도가 증가함에 따라 NF-κB의 발현량이 감소하는 것을 확인하였다(Fig. 6).
Fig. 6.
Effect of WST on LPS-induced Expression of NF-κB mRNA. Con: untreated group; LPS: treated with LPS(1㎍/㎖); 25, 50, 100 and 200: treated with LPS and WST(25, 50, 100 and 200㎍/㎖).
*p<0.05 compared to the control group.
Download Original Figure
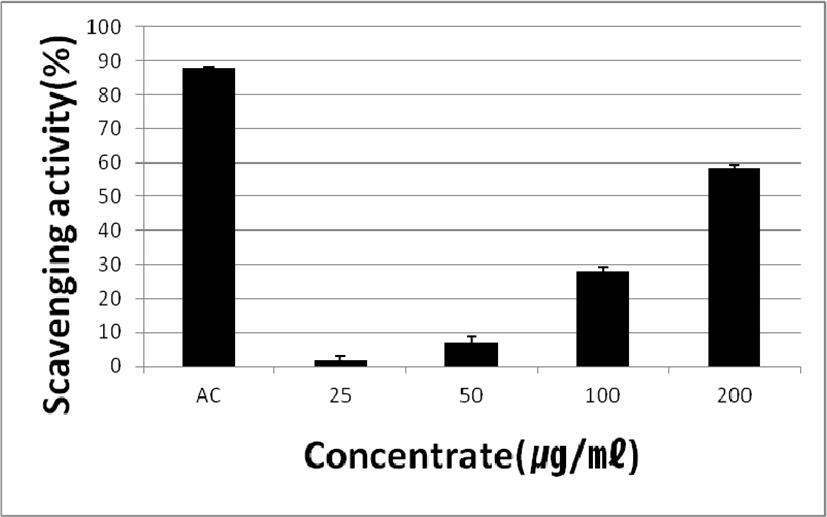
4. DPPH radical 소거능 측정
WST의 항산화력을 측정하기 위하여 DPPH radical 소거능을 확인하였다. 대조군으로 radical 소거율이 뛰어난 ascorbic acid(AC)와 WST를 농도별(25, 50, 100 and 200㎍/㎖)로 처리한 결과 AC는 radical 소거율이 88.07 ± 0.27%로 나타났고, WST는 농도별로 1.76 ± 1.23%, 6.82 ± 2.07%, 28.05 ± 1.09% 및 58.48 ± 0.99%로 나타났다. WST의 농도가 증가할수록 radical 소거율도 증가하는 것을 확인하였다(Fig. 7).
Fig. 7.
Effect of WST on DPPH Radical Scavenging Test. AC: treated with ascorbic acid. 25, 50, 100 and 200㎍/㎖: treated with various concentrations of WST.
Download Original Figure
Ⅳ. 고 찰
WST는 淸代 程國彭의 《醫學心悟 附錄 外科症治方藥》9)에 수록되어 있으며 “解毒消癰 淸熱 活血 止痛 初起相宜” 이라 하여 癰을 치료하는 처방으로 제시되어 있다. 한의학 피부질환 중의 하나인 癰은 體表의 皮肉之間에 발생하는 急性 化膿性 疾患의 일종으로 部位가 浮淺하며 局部가 光軟無頭하며 紅腫疼痛하면서 發病이 신속하고 易腫, 易膿, 易潰, 易斂하며 혹 惡寒, 發熱, 口渴 등 全身症狀이 나타나는 특징이 있다10). 이와 같은 癰의 특징은 통증, 열감, 발적, 기능저하의 증상을 보이는 조직 손상에 대한 자가 방어능력 중의 하나인 염증 반응의 산물이라 볼 수 있다11).
염증반응성 질환인 癰의 치료에 사용하는 WST는 白芷, 連翹, 天花粉, 荊芥, 甘草, 牛蒡子, 防風, 乳香, 沒藥, 金銀花, 貝母, 當歸尾로 구성된 처방으로 약재별 항염효과에 대해서는 다음과 같이 연구되어져있다. 白芷는 furanocoumarin류의 화합물로서 imperatorin을 함유하며, imperatorin은 LPS로 유도된 COX-2의 발현 및 PGE synthase의 발현을 현저히 억제하는 것으로, 連翹는 5-lipoxygenase 및 elastase에 대한 억제 활성 및 free radical 생성 시스템에서 지질과산화를 억제하는 것으로, 荊芥는 COX-2 및 iNOS 발현 억제 및 Th1·Th2 세포에서 cytokine 유리 억제에 효과가 있는 것으로, 牛蒡子는 electron spin resonance spectrometer 측정 시 활성산소 제거능이 있는 것으로, 防風은 furanocoumarin류의 화합물로서 imperatorin 및 deltoin을 함유하며, imperatorin 및 deltoin은 iNOS의 발현을 억제하여 NO의 유리를 현저히 줄이는 효과가 있는 것으로, 沒藥은 IL-1β로 유발된 염증 상황에서 IL-6와 IL-8의 생성을 감소시키는 효과가 있는 것으로, 金銀花는 TNF-α의 분비 및 iNOS의 활성화를 일부분 감소시키는 효과가 있는 것으로12), 天花粉은 LPS로 유도된 염증 상황에서 NO를 감소시키는 효과가 있는 것으로13), 甘草는 iNOS 활성화 억제 및 NO, PGE2를 감소시키는 효과가 있는 것으로14), 乳香은 LPS로 유도된 염증 상황에서 iNOS의 mRNA을 감소시킴으로써 NO를 억제하는 것으로15), 貝母는 MAPK를 이루는 JNK와 P38의 인산화를 억제하여 염증성 사이토카인인 IL-4와 TNF-α의 발현을 억제하는 것으로16), 當歸는 DNCB로 유도된 염증 상황에서 TNF-α, IL-6, COX-2를 억제 하는 것으로 알려져 있다17).
WST를 구성하는 개별 약재들의 항염효과는 상술한 것과 같이 연구가 되어 있으나, 개별 약재들의 복합물인 WST의 경우 연구가 전무한 상황이기에 본 연구는 LPS로 유도된 RAW264.7 cells에서 열수추출된 WST의 항염효과를 평가하였다.
염증반응에 주요한 역할을 하는 NO는 반응성이 높은 물질로 L-arginine과 O2로부터 NOS를 거쳐 생성되는 radical이다. NO의 생성은 혈액응고, 혈압 및 신경전달 기능을 조절한다. 하지만 과다 생성된 NO는 유해물질을 생성하여 생체에 치명적인 산소독성을 일으키며 염증의 유발과 세포막 분해, 단백질 분해, DNA변성, 지질 산화 등을 초래하여 염증을 비롯해 노화, 자가면역질환, 암 등 각종 질병을 일으키는 것으로 알려져 있다3,18). 그렇기에 NO 생성의 감소는 염증반응을 조절하는 가능성 때문에 많은 연구가 진행되고 있다. 본 연구에서 WST는 LPS에 의해 과도하게 생성된 NO의 함량을 농도의존적으로 감소하여 항염증 효과를 보였다(Fig. 2).
iNOS는 염증 반응을 촉진하기 위해 COX-2와 시너지 효과를 발휘한다19). 염증과정에서 염증성 매개체인 NO와 PGE2가 iNOS와 COX-2에 의해 생성된다20). NO는 NOS를 거쳐 생성되는 물질로써, WST의 NO생성억제에 iNOS의 mRNA가 관여하는지 알아보기 위하여 iNOS의 mRNA발현량을 조사하였다. LPS 처치 시 iNOS의 mRNA가 발현되었으며, LPS에 WST를 농도별로 처치한 실험군에서는 iNOS의 mRNA발현량이 농도의존적으로 감소하였다(Fig. 4).
COX-1은 대부분의 포유동물 조직에서 발현되고 위 점막의 세포보호, 신장 혈류조절 및 혈소판 응집 조절과 같은 생리기능 유지에 관여하는 것으로 알려져 있다. 반대로 COX-2는 정상적인 생리 조건에서 나타나지 않지만 염증을 유발하는 인자 등에 의해 일시적으로 유도될 수 있다. COX-2가 과발현하게 되면 악성세포 또는 형질 전환 된 세포의 생존을 연장시킨다21). COX는 arachidonic acid를 PG로 전환시키는 효소로서 대표적으로 COX-2는 cytokine, 염증반응, 성장촉진인자 등에 의해 유도되어 다량의 PG를 생성함으로써 염증관련질병, 자가면역성질환 등에서 중요한 역할을 하는 것으로 알려져 있다2,21). 본 실험에서 COX-2는 LPS 처치 시 mRNA의 발현이 유의하게 증가되었으며, LPS에 WST를 처치한 실험군에서는 농도의존적으로 COX-2의 mRNA발현과 활성을 억제하였다(Fig. 3).
한편 면역반응 및 세포주기의 조절과 세포 생존 유전자의 조절로 대표적인 염증관련진핵세포 전사조절인자 NF-κB는 COX-2, iNOS 및 IL-6 등과 같은 pro-inflammatory cytokine 및 염증매개물질의 발현을 조정하는데 중요한 역할을 하는 것으로 알려져 있다22,23). 최근 연구들은 NF-κB가 LPS 등의 염증유발 자극에 의해 NF-κB pathway가 활성화되어 iNOS나 COX-2 등 유전자 발현에 관여함을 입증했다21). NF-κB가 핵 안으로 전위하여 iNOS 및 COX-2의 전사를 유도하는데, 전사과정에서 NF-κB의 mRNA발현량은 LPS에 의해 유의성 있게 증가되었으며, LPS에 WST를 처치한 실험군에서는 NF-κB의 mRNA발현량이 유의하게 감소하였다(Fig. 6).
단핵구나 macrophage cell에서 분비되는 lL-6는 pro-inflammatory cytokine으로서 iNOS의 발현을 자극하여 NO의 생성을 촉진시키는 것으로 알려져 있다. 또한 IL-6는 B cell이 plasma cell로 분화되어 항체의 생산을 증가시키는 것으로, IL-6의 level은 염증성 병변에서 항상 증가하는 것으로 보고되고 있다4,24). 본 실험에서 LPS에 의해 IL-6의 분비를 증가시켰으며, WST는 LPS로 유도된 IL-6를 농도의존적으로 유의성 있게 감소시켰다(Fig. 5).
유해산소라 불리는 활성산소는 에너지 대사과정에서 생산된다. 생성된 활성산소는 생체에 산소독성을 일으키며 여러 질환의 원인이 되고 있다19,25). 본 실험에서 WST는 DPPH radical 소거율을 농도의존적으로 유의성 있게 증가시켰다(Fig. 7).
이상의 결과는 WST가 LPS로 유도된 RAW 264.7 세포의 염증매게물질에 대한 억제효과 가 있음을 확인하였다. 따라서 이러한 WST의 염증 억제효과는 아토피 피부염, 류마티스 관절염 등의 염증성 제반 질환에 활용할 수 있을 것으로 판단된다. 하지만 본 연구에서는 WST가 어떠한 기전으로 항염증 및 항산화 효과를 내는지에 대해서는 밝히지 못하였기에 향후 추가적인 연구가 필요할 것으로 사료된다.
Ⅴ. 결 론
본 연구는 LPS로 유도된 RAW 264.7 세포의 염증반응에 대한 衛生湯(WST)의 염증매개물질에 대한 억제효과를 확인하기 위하여 진행하였으며, 다음과 같은 결론을 얻었다.
-
RAW 264.7 세포에 WST를 처리하여 세포독성을 확인한 결과, RAW 264.7세포에서 WST(25-200㎍/㎖)가 세포독성을 나타내지 않음을 확인하였다.
-
WST는 LPS로 처리한 대조군에 비해 산화질소(NO)의 생성을 유의하게 억제하였고 COX-2, iNOS, IL-6, NF-κB에 대한 유전자 발현을 농도 의존적으로 감소시켰음을 확인하였다.
-
라디칼 소거능을 확인하기 위해 대조군인 Ascorbic acid와 비교한 결과, WST가 농도 의존적으로 라디칼 소거능을 가진 것으로 확인되었다.
Ⅵ. 감사의 글
본 연구는 2019년도 세명대학교 대학혁신지원사업으로 지원되었음.
References
Du B, Zhu F, Xu B. An insight into the anti-inflammatory properties of edible and medicinal mushrooms. Journal of functional food. 2018;47(1):334-42. .


Jeong HR, Sung MS, Kim YH, Ham HM, Choi YM, Lee JS. Anti-Inflammatory Activity of Salvia plebeia R. Br. Leaf through Heme Oxygenase-1 Induction in LPS-Stimulated RAW264.7 Macrophages. J Korean Soc Food Sci Nutr. 2012;41(7):888-94. .


Kim DH, Park SJ, Jung JY, Kim SC, Byun SH. Anti-inflammatory Effects of the Aqueous Extract of Hwangnyeonhaedok-tangin LPS-activated Macrophage Cells. Kor.J.Herbology. 2009;24(4):39-47.

Bae NY, Kim MJ, Kim KBWR, Ahn NK, Choi YU, Park JH, et al. Anti-Inflammatory Effect of Ethanol Extract from Grateloupia elliptica Holmes on Lipopolysaccharide-Induced Inflammatory Responses in RAW264.7 Cells and MiceEars.J. Korean Soc. Food Sci. Nutr. 2015;44(8):1128-36. .


Kim CH, Lee MA, Kim TW, Jang JY, Kim HJ. Anti-inflammatory Effect of Allium hookeri Root Methanol Extract in LPS-induced RAW264.7 Cells. J Korean Soc. Food Sci. Nutr. 2012;41(11):1645-8. .


Kang BK, Kim KBWR, Kim MJ, Bark SW, Pak WM, Ahn NK, et al. Anti-inflammatory Effect of Sargassum coreanum Ethanolic Extract through Suppression of NF-
κB Pathway in LPS Induced RAW264.7 Cells in Mice. Microbiol. Biotechnol. Lett. 2015;43 (2):112-9. .


Jo IJ, Choi MO, Park MC, Song HJ, Park SJ. Anti-Inflammatory Effect of Aqueous Extract of Scolopendrae Corpus in RAW 264.7 Cell. Kor. J. Herbology. 2011;26(3):23-9.

Kim YS, Lee SJ, Hwang JW, Kim EH, Park PJ, Jeong JH. Anti-Inflammatory Effects of Extracts from Ligustrum ovalifolium H. Leaves on RAW264.7 Macrophages. J. Korean Soc. Food Sci. Nutr. 2012;41(9): 1205-10. .


Jung GP. Yihaksimo. Seoul:Jipmoondang Publishing Co. 2017:618.

Ko WS, Kim KJ, Kim NK, Kim YB, Kim JH, Kim HT, et al. Text of Traditional Korean Dermatology & Surgery. Busan:Seonu. 2007:152.

Kim TJ, Kim YM, Kim HT. Effects of Naetakcheongeum-san on Anti-inflammatory Activities in RAW 264.7 cells. J Korean Med Ophthalmol Otolaryngol Dermatol 2018;31 (1):12-21.

Korean pharmacology Textbook Editing Board. Korean pharmacology. Seoul: Shinilbooks. 2010:134-237.

Hong YP, Choi I, Lee E. Effect of Trichosanthes kirilowii Extract on the Inflammatory Response Induced by Lipopolysaccharide in Broiler Chickens. Korean J. Plant Res. 2012;25(4):482-9. .


Han MH, Lee MH, Hong SH, Choi YH, Moon JS, Song MK, et al. Comparison of Anti-inflammatory Activities among Ethanol Extracts of Sophora flavescens, Glycyrrhiza uralensis and Dictamnus dasycarpus, and their Mixtures in RAW 246.7 Murine Macrophages. Journal of Life Science. 2014;24(3):329-35. .


Lee TJ, Woo KJ, Shu SI, Shin SW, Kim SC, Kwon YK, et al. Effects of Water Extracts from Chaenomeles sinensis, Polygonum cuspidatum and Boswellia carterii on LPS-Induced Nitric Oxide Production in Raw 264.7 Cell. Korean J. Oriental Physiology & Pathology. 2006;20(3):603-8.

Kim EY, Lee BN, Kim JH, Hong SY, Kim MS, Park JH, et al. Effect of Fritillariae Thunbergii Bulbus for Allergic Inflammationon HaCaT and RBL2H3 Cells. Kor. J. Herbol. 2019;34(1):23-31.

Ryu DH, Oh SR, Jung TS, Ryu DS. The Effect of Angelica gigas Nakai Extract and Bacillus Polyfermenticus KJS-2 on Atopic Dermatitis induced by DNCB in mice. J Korean Med. 2017;38(3):30-42. .


Yu MH, Im HG, Lee HJ, Ju YJ, Lee IS. Components and Their Antioxidative Activities of Methanol Extracts from Sarcocarp and Seed of Zizyphus jujuba var. inermis Rehder. Korean J. Food Sci. Technol. 2006;38(1):128-34.

Hseu YC, Wu FY, Wu JJ, Chen JY, Chang WH, Lu FJ, et al. Anti-inflammatory potential of Antrodia Camphorata through inhibition of iNOS, COX-2 and cytokines via the NF-
κB pathway. Int Immunopharmacol. 2005;5(13-14):1914-25. .



Surh YJ, Chun KS, Cha HH, Han SS, Keum YS, Park KK, et al. Molecular mechanisms underlying chemopreventive activities of anti-inflammatory phytochemicals: down-regulation of COX-2 and iNOS through suppression of NF-
κB activation. Mutation Research. 2001;480-481(1):243-68. .


Kim YJ, Son DY. Antioxidant and Inhibitory Effects of Korean Panax ginseng Extract on Pro-inflammatory Mediators in LPS-stimulated RAW264.7 Macrophages. J. Korean Soc. Food Sci. Nutr. 2012;41(10): 1371-7. .


Kim KB, Yoo KH, Park HY, Jeong JM. Anti-oxidative Activities of Commercial Edible Plant Extracts Distributed in Korea. J. Korea Soc. Appl. Biol. Chem. 2006;49(4): 328-33.