Ⅰ. 서 론
최근 현대사회의 발전으로 인해 주거환경 및 식생활의 변화가 생기면서 환경오염이나 화학물질에 대한 노출, 스트레스 등에 의하여 생체에 대한 여러 질병이 발생하고 있다1). 이러한 질병은 생체 내 대사과정 중 산화반응에서 발생한 활성산소(reactive oxygen species, ROS)로 인해 발병된다고 볼 수 있다2). 활성산소는 생체에 들어온 세균이나 이물질을 격퇴시키는 이로운 역할을 하지만, 과도하게 생성되면 세포막, DNA, 단백질 등의 손상을 초래하여 염증반응을 유도함으로써 심혈관질환, 암, 치매, 당뇨병, 관절염, 백내장 및 노화를 촉진한다고 알려져 있다3).
염증반응은 외부에서 유해물질, 세균감염과 같은 자극으로 인해 면역세포가 이를 인지하여 생체를 방어하려는 기전이다4). 염증반응과 관련된 세포는 macrophage가 있으며, 그람음성균의 세포외막에 존재하는 내독소인 lipopolysaccharide(LPS)의 자극에 의해 tumor necrosis factor-α(TNF-α), interleukin1β (IL-1β), interleukin1α(IL-1α) 및 interleukin6 (IL-6)와 같은 염증매개성 cytokine과 염증유발인자인 nitric oxide(NO), inducible nitric oxide synthase (iNOS), cyclooxygenase-2(COX-2)를 생성한다5).
염증반응을 일으키는 활성산소를 경감시킬 수 있는 항산화, 항염증제에 대한 현대인들의 관심이 높아짐에 따라 항산화 및 항염증에 대한 연구가 활발히 진행되고 있는데, 특히나 친환경적이고 보다 안전한 천연물과 한방제제 추출물을 이용한 연구가 활발히 진행되고 있다6,7).
丹皮湯(Danpi-tang, DPT)은 《醫宗金鑑》 卷67 編輯外科心法要訣에 수록되어 있는 처방으로 牧丹皮, 瓜蔞仁, 桃仁, 朴硝, 大黃으로 구성되어 있으며, “丹皮湯療腸癰證, 腹濡而痛時下膿, 硝黃丹蔞桃仁共, 水煎服之有奇功.”라 하여 腸에 종기가 난 것을 치료하고 창자를 潤하게 하여 통증과 고름이 나오는 것을 다스리는 처방으로 알려져 있으나8), DPT에 대한 항염증 및 항산화 효과에 대한 연구는 전무한 실정이다. 따라서 본 연구에서는 DPT가 항염증 및 항산화 작용에 어떠한 효과가 있는지 조사하기 위해 RAW 264.7 세포를 이용하여 세포독성, NO, COX-2, iNOS, IL-1α, IL-1β 및 IL-6의 발현을 알아보고자 하였다.
Ⅱ. 재료 및 방법
DPT에 사용되는 약재는 ㈜HMAX에서 구매하여 사용하였다. 구입한 약재들은 다음과 같다(Table 1).
| Herbal name | Pharmacognostic Name | Weight(g) |
|---|---|---|
| 牧丹皮 | Moutan Radicis Cortex | 36 |
| 瓜蔞仁 | Trichosanthis Semen | 36 |
| 桃仁 | Persicae Semen | 36 |
| 朴硝 | mirabalite | 24 |
| 大黃 | Rhei Radix et Rhizoma | 12 |
| Total | 144 |
구입한 건조 한약재를 정량한 후 3차 증류수 2,000㎖과 함께 heating mantle을 이용하여 4시간 가열하였다. 추출물을 6시간 냉각시킨 후 거즈로 1차 여과하고 filter paper(Advantec, Tokyo, Japan)로 2차 여과를 진행하였다. 여과액을 감압 농축하여 100㎖ 농축액을 얻은 후 초저온 냉동고에서 24시간 냉각시키고 동결건조기를 이용하여 건조분말 13.5g을 얻었다. 이 때 수율은 약 9%이다.
마우스 대식세포주인 RAW 264.7 세포는 한국세포주은행(KCLB)에서 분양 받아 사용하였으며 배지는 10% fetal bovine serum(FBS, GenDEPOT, USA)과 penicillin/streptomycin(GenDEPOT, USA)을 첨가한 Dulbecco’s modified eagle’s medium(DMEM, GenDEPOT, USA)배지를 사용하였다. 배양은 37℃, 5% CO2 조건에서 배양하였다.
RAW 264.7 세포에서 DPT의 세포독성과 생존율을 알아보기 위하여 3-(4,5-dimethylthiazole-2-yl)-2,5-diphenyl-tetrazolium bromide(MTT) assay를 진행하였다. RAW 264.7 세포를 96 well plate에 5×104 cells/well의 세포수가 되도록 분주하고, 24시간 동안 37℃, 5% CO2 incubator에서 배양하였다. 24시간이 지난 후 각각의 농도 50, 100, 200 및 400㎍/㎖의 DPT를 100㎕씩 처리하고 다시 24시간 동안 배양한 후, MTT용액(4㎎/㎖)을 20㎕ 가한 뒤 4시간 동안 반응시켰다. 반응 후 상층액을 제거 하고 DMSO 100㎕로 세포를 용해시켰다. MTT 환원에 의해 생성된 formazan을 spectrophotometer(SpectraMax 190; Molecular Devices, Sunnyvale, California, USA)를 이용하여 570㎚에서 흡광도를 측정하였다.
RAW 264.7 세포를 96 well plate에 5×104 cells/well의 세포수가 되도록 분주하고, 24시간 동안 37℃, 5% CO2 incubator에서 배양하였다. 24시간이 지난 후 대조군을 제외하고 각각의 농도 50, 100, 200 및 400㎍/㎖의 DPT 50㎕와 1㎍/㎖의 LPS 50㎕를 동시에 처리하여 24시간 배양하였다. 그 다음 세포의 배양액을 새로운 96 well plate에 옮긴 후, Griess reagent(Sigma, USA)를 100㎕ 처리하였다. 실온에서 10분 동안 방치한 후 spectrophotometer를 이용하여 540㎚에서 흡광도를 측정하였다.
DPT의 COX-2, iNOS, TNF-α, IL-1α, IL-1β 그리고 IL-6의 mRNA 발현량을 확인하기 위해 6 well plate에 RAW 264.7 세포를 5×105cells/well가 되도록 분주하고 37°C, 5% CO2 incubator에서 24시간동안 배양하였다. 그 후 LPS(1㎍/㎖)와 DPT를 농도별(50, 100, 200 및 400㎍/㎖)로 50㎕씩 동시에 처리하여 24시간 배양하였다. 24시간 후 Trizol reagent (Ambion, USA)를 사용하여 RNA를 추출하였다. RNA는 diethyl pyrocarbonate(DEPC treated-water; Sigma, USA) 20㎕로 용해하고 Nano Drop 2000(Thermo fisher, USA)으로 정량하였다. Total RNA는 2㎍으로 보정한 후 cDNA 합성kit(Revetra ACE-α-; Toyobo, Japan)를 사용해 cDNA로 합성하였다. cDNA로부터 TNF-α, COX-2, iNOS, IL-1α, IL-1β 및 IL-6의 유전자 발현량을 확인하기 위해 Tagman master mix(Thermo fisher, USA) 10㎕, 멸균수 4㎕, primer 1㎕, cDNA 5㎕를 혼합하여 실시간으로 중합반응을 수행하였다. 실험에 사용된 probe들은 Table 2에 나타내었다.
DPT의 iNOS 및 COX-2 발현에 미치는 영향을 관찰하기 위해 western blot을 진행하였다. 6 well plate에 RAW 264.7 세포를 5×105cells/well가 되도록 분 주하고 37℃, 5% CO2 incubator에서 24시간동안 배양하였다. 24시간 후 대조군을 제외하고 각각의 농도 50, 100, 200 및 400㎍/㎖의 DPT와 1㎍/㎖의 LPS를 동시에 처리 해준 뒤 iNOS를 확인할 세포는 12시간, COX-2를 확인할 세포는 24시간동안 배양하였다. 그 후 상층액을 제거하고 PBS 1㎖로 세척 후 lysis buffer을 사용하여 세포를 용해하였다. 얻은 단백질은 BCA assay(Thermo fisher, USA)를 이용하여 정량하였다. 정량한 단백질에 loading dye를 첨가한 뒤 3분간 열처리하여 전하를 일치시켜 주었다. 10% Tris HCI gel에 단백질을 넣어 전기영동한 후 membrane에 transfer를 진행하였다. 단백질이 이동한 membrane을 5% skim milk로 blocking 해준 뒤 각각 iNOS, COX-2 및 β-actin의 항체를 냉장보관의 조건에서 shaking을 하면서 overnight하였다. 그 후 Tris Buffered Saline with Tween 20(TBST)로 5분간 5회 세척 후 2차 항체에 2시간 동안 shaking 해주었고 다시 TBST로 5분간 5회 세척 후 단백질을 측정하였다.
DPPH radical 소거능을 측정하기 위해 DPPH assay을 실시하였다. 99% methanol (Honey well, USA)과 증류수를 1:1 비율로 섞은 용액에 DPT를 최종농도 50, 100, 200 및 400㎍/㎖가 되도록 첨가하였다. 각각 만들어진 시료를 50㎕씩 취하여 DPPH(250mM) 50㎕와 혼합한 뒤 실온에서 30분간 반응 후 spectrophotometer을 이용하여 517㎚에서 흡광도를 측정하였다. Positive control은 ascorbic acid(200㎛)를 사용하였다.
Ⅲ. 실험결과
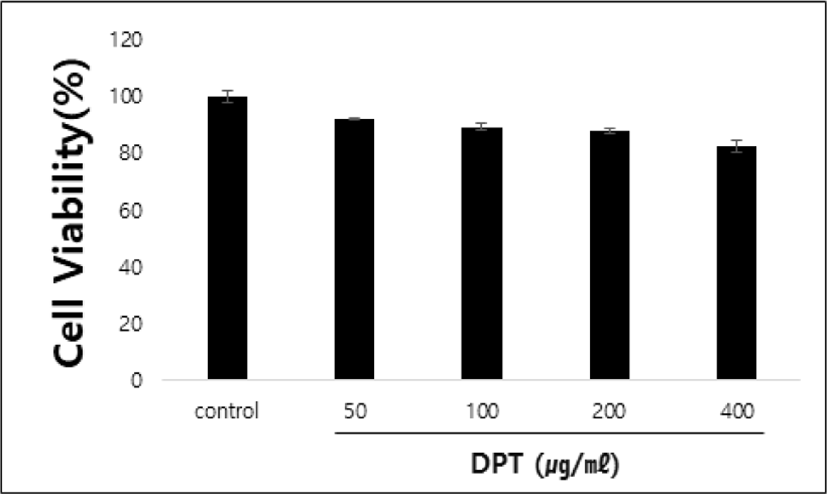
DPT를 각각 50, 100, 200 및 400㎍/㎖의 농도로 처리한 RAW 264.7 세포의 생존률을 확인한 결과 control군에 비해서 93.8±1.15%, 92.6±0.3%, 89.7±1.15%, 88.2±0.86%, 82.8±2.2%로 나타났다. RAW 264.7 세포에서 DPT의 50, 100, 200 및 400㎍/㎖ 농도범위에서 독성이 없음을 확인하였다(Fig. 1).
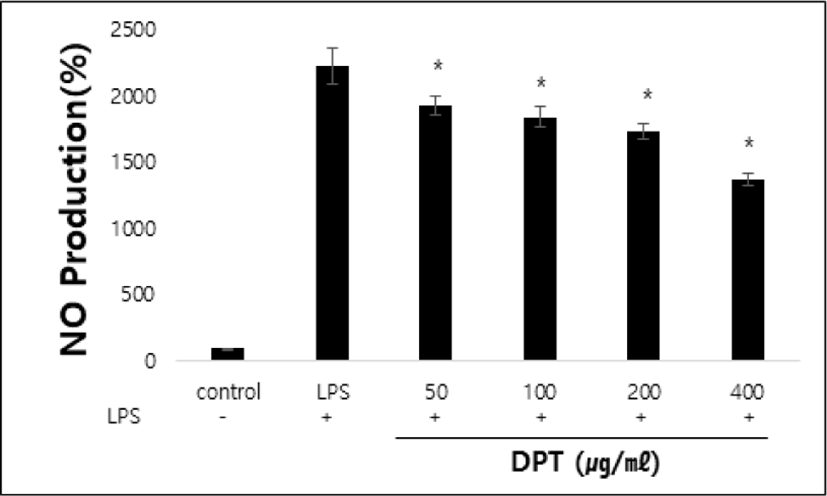
LPS로 자극한 RAW 264.7 세포에서의 NO 생성에 대한 DPT의 저해효과를 측정한 결과, 단독 처리한 LPS군의 NO 생성율은 대조군에 비해 2,228.21±134.3% 증가하였다. 한편 LPS와 DPT를 50, 100, 200 및 400㎍/㎖의 농도로 처리한 군에서는 2,063.07±116.8%, 1,933.94±70.8%, 1,855.5±66.1%, 1,735.3±56.9%, 1,374.08±49.5%로 나타나 LPS 처리군에 비하여 농도 의존적으로 감소하였다(p<0.05)(Fig. 2).
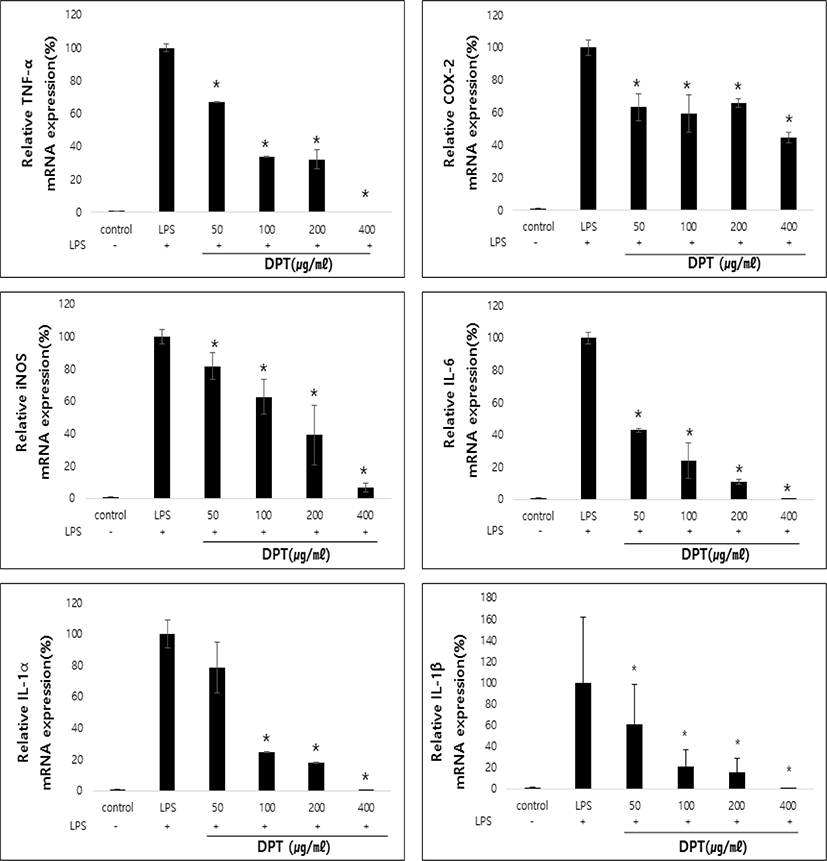
LPS로 유도된 RAW 264.7 대식세포에서 갖는 TNF-α, COX-2, iNOS, IL-1α, IL-1β 및 IL-6의 mRNA 발현을 분석하였다. 유전자의 발현은 LPS 처리군과 비교하였을 때 농도 의존적으로 감소하는 것을 확인하였다. 따라서 DPT는 염증매개물질 발현 저해를 통한 항염증 효능이 있음을 나타냈다(p<0.05)(Fig. 3).
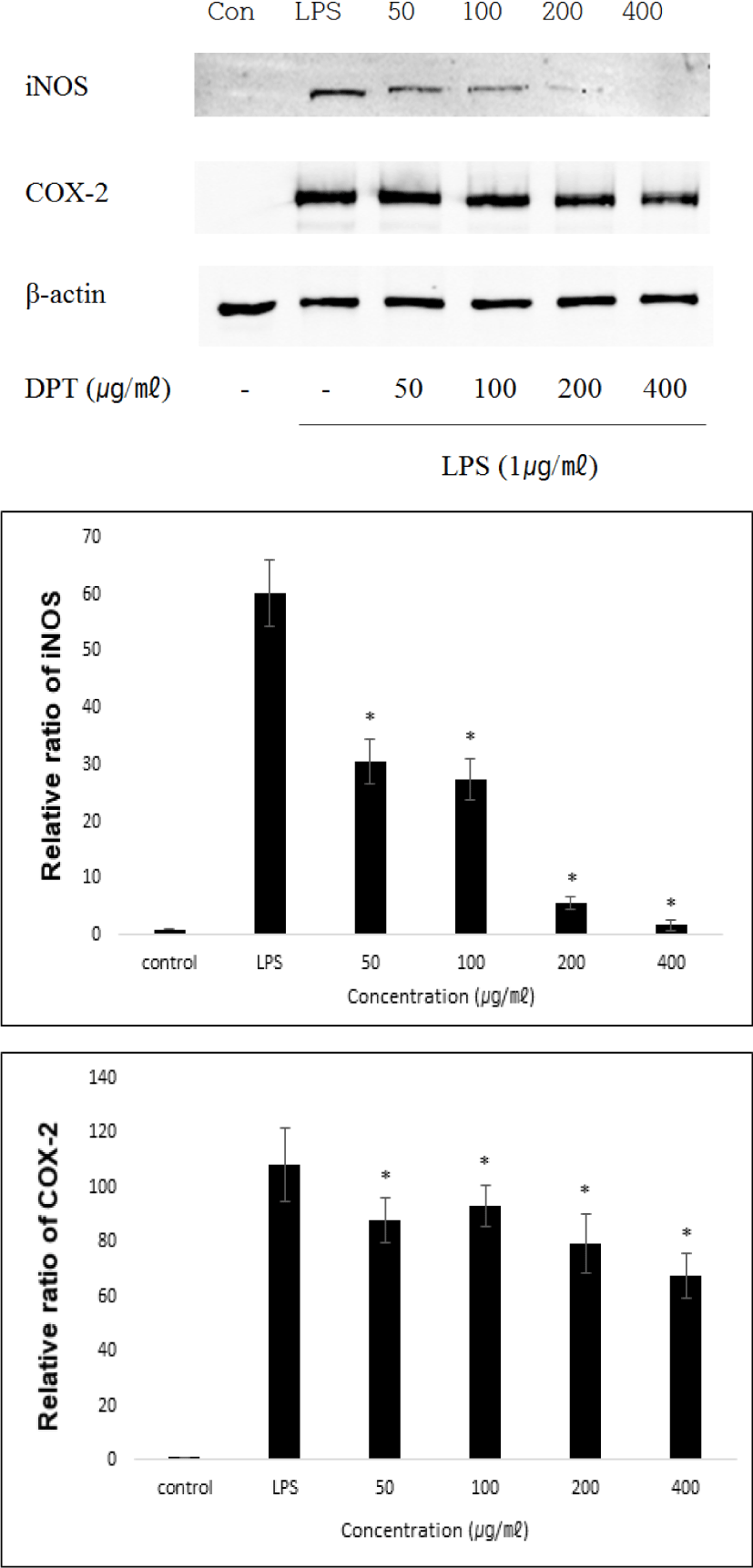
LPS로 유도된 RAW 264.7 macrophage cells에서 western blotting을 사용하여 염증 매개 단백질인 COX-2 및 iNOS의 발현량을 확인하였다. LPS 처리 군은 COX-2와 iNOS의 발현이 증가하였고, LPS만 처리한 군에 비해 DPT를 50, 100, 200 및 400㎍/㎖로 처리한 군에서 COX-2와 iNOS의 발현량이 농도 의존적으로 감소하는 경향을 나타냈다. Western blot을 통하여 단백질의 발현정도를 측정하기 위해 image J(Wayne Rasband National Institutes of Health, USA)를 이용한 image analysis를 통해 확인하였다(Fig. 4). 이러한 결과는 DPT가 RAW 264.7 대식세포에서 COX-2와 iNOS의 발현을 감소시키는 것으로 보인다.
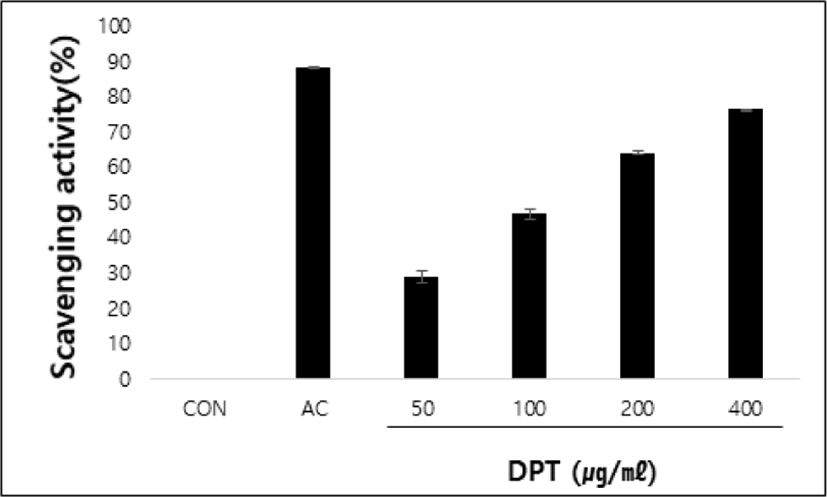
DPPH를 사용하여 radical 소거능을 측정하였다. 양성대조군으로 사용한 ascorbic acid는 radical 소거능이 88.38±0.08%로 나타났고 DPT를 농도별로 50, 100, 200 및 400㎍/㎖ 처리한 결과 radical 소거능이 16.22±0.8%, 29.08±1.56%, 46.87±1.53%, 64.17± 0.58%, 76.53±0.08%로 농도 의존적으로 증가함을 나타냈다(Fig. 5).
Ⅳ. 고 찰
염증반응은 외부의 자극에 대한 생체의 방어반응으로, 자극을 받으면 염증반응에 관여하는 세포인 대식세포가 활성산소, Cytokine 등과 같은 염증매개인자를 분비하는데, 염증반응이 반복되면 활성산소종의 과다 생성을 유발함으로써 만성질환을 일으킬 수 있다9,10).
NO는 L-arginine으로부터 NO synthase(NOS)에 의해 생성되며 종류에 따라 세포 기능유지를 돕는 기능을 하거나, 세포독성을 일으킬 수 있다. NOS는 inducible NOS(iNOS), endothelial NOS(eNOS), neuronal NOS(nNOS)로 분류되며 이중 eNOS, nNOS는 자극에 대한 반응이 아닌, 칼슘농도에 의존적이고 세포에 지속적으로 존재한다. 반면 iNOS는 칼슘 농도에 의존하지 않고 외부 자극에 의해 과량 생성되면서 염증반응에 기여한다11).
COX는 세포막의 인지질로부터 arachidonic acid가 유리되어 prostaglandin(PG) 으로 변화하도록 촉진시키는 효소로 COX-1, COX-2로 분류된다. COX-1은 생체 내 대부분의 조직에서 발현되며 인체의 항상성 유지에 기여하는 반면, COX-2는 cytokines 및 LPS 등의 다양한 자극에 의해서 다량 발현되며, 이로 인해 PG를 생성하여 염증반응을 일으킨다12).
본 연구에 사용된 丹皮湯(Danpi-tang, DPT)은 《醫宗金鑑》 卷67 編輯外科心法要訣, 內癰部 , 大小腸癰에 수록되어 있는 처방으로, “腹濡而痛, 少腹急脹, 時時下膿者, 毒未解也, 宜丹皮湯治之.… 丹皮湯療腸癰證, 腹濡而痛時下膿, 硝黃丹蔞桃仁共, 水煎服之有奇功.”이라 하여 배가 말랑말랑하면서 통증이 있고 아랫배가 당기고 불러 오르며 때때로 대변에 고름이 나오는 것은 독이 풀리지 않은 것이므로 丹皮湯으로 치료해야 한다고 하였고, 또한 丹皮湯은 腸癰證으로 배가 유연하면서 아프고 수시로 고름을 설사하는 것을 치료하며 朴硝, 大黃, 牧丹皮, 瓜蔞仁, 桃仁을 함께 물에 넣고 달여 복용하면 신효한 처방이라고 기록되어 있다8). 그리고 《醫宗金鑑》 卷67 編輯外科心法要訣, 內癰部, 胃癰에서는 “此證初起, 中脘穴必隱痛微腫, 寒熱如瘧, 身皮甲錯, 並無咳嗽, 咯吐膿血. 由飮食之毒, 七情之火, 熱聚胃口成癰. … 若脈濇滯者, 瘀血也, 宜服丹皮湯下之.”라 하여 이 증상의 초기에는 中脘穴이 반드시 은은히 아프고 경미하게 부어오르며 瘧疾과 같이 寒熱이 往來하고 전신의 피부가 갑옷비늘처럼 일어나며, 기침은 하지 않고 객혈을 토해내는데, 이것은 음식으로 인해 생긴 독에다 七情으로 인한 火가 더해져 熱이 胃口에 몰려 癰이 成한 것이며, 맥이 껄끄럽고 막히는 것은 瘀血로 인한 것이므로, 마땅히 丹皮湯을 복용하여 설사시켜야 한다고 하였다8).
丹皮湯은 牧丹皮, 瓜蔞仁, 桃仁, 朴硝, 大黃으로 구성되어 있는데, 牧丹皮는 淸熱凉血, 活血行瘀, 散瘀消腫 등의 효능으로 溫熱病血의 熱入血分, 發斑, 癥積, 跌撲傷痛, 風濕熱痺, 惡血積聚作痛, 外癰內癰 등의 옹종을 치료하며13), 牧丹皮의 메탄올 추출물은 in vitro에서 IL-8 및 MCP-1의 유리를 억제하는 등의 항염 및 항산화의 약리 작용을 한다고 알려져 있다14). 瓜蔞仁은 淸肺化痰, 滑腸通便 등의 효능으로 痰熱咳嗽, 癰腫瘡腫(乳癰, 腸癰), 腸燥便秘 등을 치료하고 和談散結消腫 등의 효능으로 癰疽惡瘡의 병증을 치료하기도 하며, 瓜蔞仁의 50% 에탄올 추출물을 경구 투여 시 아세트산으로 유도한 혈관의 투과성, 카라기닌(carrageenin)으로 유도된 족부종 및 writhing을 유의적으로 억제하는 등의 항염 작용을 가진다고 보고된 바 있다14).
桃仁은 破血祛瘀의 要藥으로서 癰腫의 消散을 촉진시키는 작용으로 瘀血阻滯腹痛, 癥瘕積聚, 肺癰, 腸癰 등을 치료하고, 潤腸通便의 효능이 있어 津虧腸燥便秘를 치료한다13). 朴硝는 천연산의 광물인 芒硝를 熱水에 용해해서 여과한 뒤 냉각시키면 結晶이 되는데 이것을 朴硝라고 통칭하는 것이며, 淸熱通便, 潤燥軟堅, 淸火消腫 등의 효능으로 實熱便秘, 積滯腹痛, 腹脹痞痛, 腸癰腫痛, 乳癰, 痔瘡腫痛, 丹毒, 口瘡 등의 병증을 치료한다13). 大黃은 瀉下通便의 要藥으로서 攻積導滯, 瀉下凉血, 行瘀解毒, 淸利濕熱 등의 효능이 있어 熱結胸痞, 積滯腹痛, 熱毒瘡瘍, 腸癰, 瘀血經閉, 口舌生瘡, 産後瘀滯腹痛, 癥瘕積聚, 丹毒, 燙傷 등의 병증을 치료한다고 알려져 있다13).
《金匱要略》에 수록된 大黃牧丹皮湯은 牧丹皮, 桃仁, 瓜蔞仁, 大黃, 芒硝로 구성되어 있어 丹皮湯과 처방 구성 약재가 대동소이하다고 볼 수 있는데, 大黃牧丹皮湯을 방제학적으로 살펴보면 桃仁, 牧丹皮, 瓜蔞仁은 모두 淸熱凉血活血 등의 작용으로 消炎, 消腫의 효과가 있고, 大黃과 芒硝의 攻下작용이 함께 작용하면 소염, 소종의 효능을 더욱 증가시킬 수 있다15). 大黃은 腸間에 結聚한 瘀熱을 瀉下하여 淸熱解毒하고 牧丹皮는 淸熱凉血의 작용이 있으므로 大黃과 牧丹皮를 배합하면 通降下行하며, 芒硝는 大黃과 협조하여 蕩滌速下하고, 桃仁은 活血祛瘀, 潤腸通便하며, 瓜蔞仁은 淸濕熱하여 消癰排膿散結한다15). 따라서 大黃牧丹皮湯은 소염, 항균, 배농 작용과 함께 瀉下작용, 蠕動運動 촉진 등으로 장내의 변을 제거하여 독소 재흡수를 억제하는 처방이며15),大黃牧丹皮湯과 처방 구성이 같은 丹皮湯 또한 이와 같은 한방 방제 원리에 입각한 처방으로서 항염, 항균 및 항산화 등의 효과를 가질 것으로 판단된다.
따라서 본 연구는 LPS로 유도된 RAW 264.7 세포에서 DPT의 항산화 및 항염증 효과를 평가하고자 진행되었다. 우선 MTT assay로 마우스 대식세포인 RAW 264.7 세포에서 생존률을 확인하였다. 그 결과 DPT 농도 400㎍/㎖에서도 생존률이 82.8% 이상이므로 세포독성이 나타나지 않았음을 확인하였다(Fig. 1).
LPS는 그람 음성균의 세포외막에 존재하는 내독소로 iNOS와 COX-2 및 염증매개성 cytokine(TNF-α, IL-6, IL-1α, IL-1β)의 발현을 조절한다16). TNF-α는 대식세포가 자극을 받음과 동시에 합성되어 분비되는 cytokine이며, IL-6는 단핵구를 포함한 여러 세포에서 분비되어 면역 반응에서 중요한 역할을 한다. IL-1β는 IL-6, TNF-α와 함께 대표적인 염증매개성 cytokine 중 하나로 낮은 농도에서는 세포 성장이나 체내 항상성 유지에 필요하지만, 염증반응으로 인해 과하게 생성되면 각종 질환을 일으킨다4,17). 이에 본 연구에서는 LPS로 RAW 264.7 세포를 자극하여 LPS로부터 유도된 NO의 생성량과 염증매개성 cytokine의 유전자 발현량을 조사하였다. 그 결과 DPT가 LPS의 자극을 통해 염증반응에 중요한 역할을 하는 NO의 형성을 저해하였음을 확인하였다(Fig. 2). 또한, TNF-α, IL-1α, IL-1β 및 IL-6와 같은 염증매개성 cytokine과 iNOS 및 COX-2의 유전자 발현을 조절하여 DPT가 RAW 264.7 대식세포에서 항염증 효과가 있는 것으로 보여진다(Fig. 3).
iNOS는 NOS로부터 constituent NOS(cNOS) 및 iNOS로 구분된다. cNOS는 eNOS, nNOS로 분류되며 eNOS는 신경세포에 존재하고 nNOS는 내피세포에 존재하여 체내 항상성조절에 기여하는 것으로 알려져 있다18). 반대로 iNOS는 외부로부터 유해한 자극을 받게 되면 NO의 생성을 촉진시켜 염증반응을 일으킨다19). 또한 외부 자극으로 인해 손상을 입은 세포는 세포막 인지질로부터 arachidonic acid 가 유리되어 COX가 되며, COX는 PG류의 다양한 염증반응 매개인자를 생성하는데, PG중에서도 PGE2가 염증반응에 관련이 있어 종양의 세포사멸을 억제하여 종양생성에 기여한다. 따라서 DPT가 iNOS와 COX-2에 대한 유전자 발현을 억제시키는 것이 확인되어 추가로 단백질 발현의 억제능을 확인하고자 하였다. RAW 264.7 세포에 LPS와 DPT을 동시에 처리하여 iNOS와 COX-2의 단백질 발현을 확인한 결과, 유전자 발현량 조사와 동일한 경향을 보였음으로 DPT의 항염증 효과를 분명히 하였다(Fig. 4).
DPT의 항산화 효과를 입증하기 위해 DPPH를 진행하였다. DPPH는 radical이 포함된 시약으로 산화반응으로부터 라디칼을 형성하게 되는데, 이 라디칼이 항산화제를 통해 전자나 수소를 받게 되면 비라디칼로 전환되면서 산화안정성 즉, 항산화 효과를 확인할 수 있다20). DPPH를 진행한 결과, 양성대조군으로 사용한 ascorbic acid는 radical 소거능이 88.38%로 나타났으며 DPT 또한 농도 의존적으로 소거능이 증가하여 DPT의 농도 400㎍/㎖에서 radical 소거능이 76.53% 까지 나타났다. 이러한 결과로 DPT는 산화방지제로서의 항산화 효과를 확인하였다(Fig. 5).
이상의 결과는 DPT가 LPS로 유도된 대식세포의 염증 반응을 억제하고, DPPH 소거능을 통해 항산화 효과가 있음을 확인하였다. 따라서 이러한 DPT의 항염증 및 항산화 효과는 염증성 피부질환에 대한 효과적인 대안이 될 수 있음을 시사하나, 본 연구에서는 DPT가 어떠한 기전으로 항염증 및 항산화 효과를 내는지에 대해서는 규명하지 못하였기에 향후 이와 관련된 추가적인 연구가 필요할 것으로 생각된다.
Ⅴ. 결 론
본 연구는 LPS로 유도된 RAW 264.7 대식세포주의 염증반응에 대한 DPT의 항염증, 항산화 효과를 확인하기 위하여 진행하였으며, 다음과 같은 결론을 얻었다.
-
마우스 대식세포주인 RAW 264.7 세포에 DPT을 처리하여 세포독성을 확인한 결과, RAW 264.7 세포에서 DPT(50-200㎍/㎖)가 세포독성을 나타내지 않음을 확인하였다.
-
DPT는 LPS로 처리한 대조군에 비해 산화질소(NO)의 생성을 유의하게 억제하였고 iNOS, COX-2 및 염증성 Cytokine(TNF-α, IL-1α, IL-6)에 대한 유전자 발현이 농도 의존적으로 감소시켰음을 확인하였다.
-
라디칼 소거능을 확인하기 위해 대조군인 Ascorbic acid와 비교한 결과, DPT가 농도 의존적으로 라디칼 소거능을 가진 것으로 확인되었다.






