Ⅰ. 서 론
杏仁은 천식, 기관지염, 폐기종, 변비, 오심, 나병과 백반 등의 치료를 위해 사용되어왔다1,2). 최근에는 杏仁이 항염과 진통효과가 있다고 연구 보고되었다3).
Amygdalin은 杏仁의 주성분 중의 하나로 살구나무류, 아몬드, 살구들과 다른 장미과 식물들의 씨에서 풍부하다. Amygdalin은 비타민 B17로 알려졌으며, 또한 laetrile로 불려져왔다4).
Prostaglandins(PGs) 은 Cyclooxygenase(COX)과정들을 통해 아라키돈산(Arachidonic acid)으로부터 파생되고, 이들은 염증과정들과 유해수용기의 증감과 통증을 유발하는데 핵심적인 역할을 한다8,9).
COX는 Prostaglandins을 합성하는데 있어 반응 속도를 제한하는 효소이다. 이 효소는 COX-1과 COX-2의 두 이성체로 존재한다. 두 COX 이성체 구조는 매우 유사하나, 활성화되는 곳의 아미노산 배열은 다르다. COX-1은 대부분의 생리기능을 담당하는 세포에서 발현된다. COX-2는 생리학적인 조건하에서 낮은 단계에 존재하고, 다양한 자극체에 의해서 급속하게 유도된다8). COX-2는 PGs의 높은 단계들에서의 생산과 특히 염증 과정내에서 Prostaglandin E2(PGE2) 의 생산을 담당하는 것으로 알려져 있다10).
Nitric oxide(NO)는 내생적으로 Nitric oxide synthase(NOS)에 의해 L-arginine으로부터 생성되고, 많은 병리생리학적 과정들을 규정하는데 중요한 역할을 한다11). 여러 종류의 질소산화물 합성제(NOS) 이성체들이 존재하고, 이들은 크게 3종류로 분류된다. 그것은 유도성 NOS(iNOS), 내피성 NOS(eNOS), 그리고 신경성 NOS(nNOS)이다. nNOS와 eNOS 둘다 구성 성분적으로 발현되지만, iNOS는 면역학적인 활성화와 계속된 전사에 반응함으로써 유도될 수 있다11).iNOS는 염증과정에 있어서 NO 과생산의 원인이 된다12).
이에 저자는 쥐의 BV-2 미교세포들에서 LPS자극에 의한 COX-1, COX-2, iNOS, PGE2 합성과 NO의 생성에 杏仁 물추출물과 杏仁으로부터 추출된 Amygdalin 용액의 효과들을 비교하기 위해 3-(4,5-dimethylthiazol-2-yl)-2, 5-diphenyltetrazolium bromide (MTT) 측정, Reverse transcription-polymerase chain reaction(RT-PCR), Prostaglandin E2 면역측정과 NO 생성을 측정하여 유의한 결과를 얻었기에 보고하는 바이다.
Ⅱ. 실 험
쥐의 BV-2 미교세포들은 37℃, 5% CO2와 95% O2 가습 세포배양기 내에서 10% heat-inactivated fetal bovine serum(FBS)이 추가된 Dulbeccos Modified Eagle Medium(DMEM; Gibco BRL, Grand Island, NY, USA)으로 배양하였다.
杏仁은 GMP 승인업체(nanumherb)에서 구입했다. 杏仁 500g을 1분 동안 0.1% 구연산에 담궈 행군 후 실내온도에서 24시간 동안 건조하였다. 그 후에 분쇄기(Hanil, Seoul, Korea)를 사용하여 가루로 만든 다음 고운 가루들은 구멍 직경이 2㎜인 체를 사용하여 굵은 알갱이들을 체질해냈다. 杏仁 물추출물을 얻기 위해 고운 가루들을 증류수로 열 추출하고, 압력 여과한 후 회전 증발기(Eyela, Tokyo, Japan)로 농축하였다. 건조기(Ilsin, Kyungkido, Korea)로 동결건조를 하여 물추출물 34.48g(사출률 6.88%)을 얻었다
껍질을 제거한 杏仁 500g 과 4% 구연산(citric acid) 용액 10ℓ를 2시간 동안 재환류하였다. 혼합물이 아직도 뜨거울 때 이를 여과한 후에 여과액을 HP-20으로 채워진 관에 통과시켰다. 관내에 흡수된 물질은 에탄올로 추출한 후 농축하였다. 에탄올 추출물의 재결정을 통해 4.2g의 Amygdalin을 얻었다(사출률 0.84%). Amygdalin은 High-pressure liquid chromatography(HPLC; Shiseido, Tokyo)를 사용하여 순도가 99.0% 이상으로 만든 후 사용하였다.
MTT 측정 kit(Boehringer Mannheim GmbH, Mannheim, Germany)을 사용하여 세포 생존율을 측정하였다. 杏仁 물추출물, Amygdalin의 세포독성을 측정하기 위하여 세포들을 杏仁 물추출물, Amygdalin 용액 1㎍/㎖, 10㎍/㎖, 100㎍/㎖, 1,000㎍/㎖ 과 10,000㎍/㎖ 농도로 24시간 동안 처리하였으며, 비교군에는 아무런 처리도 하지 않았다. 각각의 실험 배양접시에 10㎕의 MTT시약들을 첨가하고 4시간동안 배양하였다. 그 후에 각각의 실험접시에 100㎕의 가용성 용액을 첨가하였고, 세포들은 다시 12시간 동안 배양하였다. 595㎚의 실험파장과 690㎚의 표준파장에서 Microtiter plate reader(Bio-Tek, Winooski, VT, USA)로 측정하였다. 광학밀도는 표준파장과 실험파장에서의 흡수도의 차이로 계산하였다. 생존율(%)은 (약 처리된 표본의 광학밀도/비교군 광학밀도) × 100으로 계산하였다.
COX-1, COX-2와 iNOS mRNA 의 발현들을 확인하기 위하여 RT-PCR을 수행했다. RNAzolTMB (TEL-TEST, Friendswood, TX, U.S.A)를 사용하여 쥐의 BV-2 미교세포로부터 RNA를 분리하였다. 2㎕의 RNA와 2㎕의 random hexamers(Promega, Madison, WI, USA)를 함께 섞은 후 10분 동안 65℃로 혼합물을 가열했다. 그 후에 1 ㎕의 AMV 역전사효소(Promega), 5㎕의 10mM dNTP(Promega), 1㎕의 RNasin 과 5㎕의 10 × AMV RT 완충제(Promega)를 혼합물에 첨가하였고, diethyl pyrocarbonate(DEPC)로 처리된 물을 사용하여 최종 부피를 50㎕로 맞추었다. 그 후에 반응 혼합물은 42℃에서 2시간 동안 배양하였다.
1㎕의 적당한 cDNA, 10 pM 농도인 1㎕의 각 프리머셋, 4㎕의 10 × RT 버퍼, 1㎕의 2.5mM dNTP와 2단위의 Taq DNA polymerase(TaKaRa, Shiga, Japan)를 포함하는 40㎕의 반응물에서 PCR 확대를 수행하였다.
쥐의 COX-1의 경우는 primer sequences가 5'-AGTGCGGTCCAACCTTATCC-3'(a 20-mer sense oligonucleotide) 그리고 5'-CCGCAGGTGATACTGT CGTT-3'(a 20-mer anti-sense oligonucleotide)였다.
쥐의 COX-2경우는 프리머 시퀀스들이 5'-CCA GATGCTATCTTTGGGGAGAC-3'(a 23-mer sense oligonucleotide) 그리고 5'-CTTGCATTGATGGTGG CTG-3'(a 19-mer anti-sense oligonucleotide)였다.
쥐의 iNOS의 경우는 primer sequences가 5'-ATGAGGTACTCAGCGTGCTCCAC-3' (a 23-mer sense oligonucleotide)와 5'-CCACAATAGTACAAT ACTACTGG-3'(a 24-mer anti-sense oligonucleotide)였다. 이 연구에 있어 internal control로 사용된 Cyclophilin의 경우는 primer sequences가 5'-ATGAGGTACTCAGCGTGCTCCAC-3' (a 20-mer sense oligonucleotide)와 5'-CCACAATAGTACAAT ACTACTTGG-3'(a 20-mer anti-sense oligonucleotide)였다. PCR 생산물의 예상된 크기는 COX-1의 경우 381 bp, COX-2의 경우 249 bp, iNOS의 경우 395 bp, Cyclophilin의 경우 299 bp였다.
다음과 같은 조건들 하에서 GeneAmp 9600 PCR system(Perkin Elmer, Norwalk, CT, USA)을 사용하여 COX-1과 iNOS에 대해 PCR과정을 수행하였다. 94℃에서 5분 동안 초기 변성단계, 이어서 각각 94℃에서 30초 동안 변성단계로 구성된 35번의 확대 싸이클, 58℃에서 30초 동안 담금 단계와 72℃에서 30초 동안 연장단계, 그리고 72℃에서 10분 동안 각 과정들 끝에 부과적인 연장단계. Cylophilin의 경우는 동일한 조건에서 PCR과정을 수행하였다. 다만 25번만의 확대싸이클을 수행하였다. COX-2의 경우는 동일한 조건에서 PCR과정을 수행하였다. 다만 30번만의 확대싸이클을 수행하였다. 각 mRNA 종들의 RT-PCR 생산물의 최종량은 분자분석(Molecular Analyst)TM version 1.4.1(Bio-Rad, Hercules, CA, USA)를 사용하여 농도계적으로 계산하였다.
PGE2 competitive enzyme immunoassay kit (Amersham Pharmacia Biotech. Inc., Piscataway, NJ, USA)를 사용하여 PGE2 합성을 측정하였다. 각각의 배양액과 표준액의 100㎕의 상청액(supernatant)을 kit에서 제공된 goat anti-mouse IgG-coated microtiter plate상의 다른 well들에 주입하였다. Mouse anti-PGE2 antibody와 peroxidase-conjugated PGE2를 각 well에 첨가하였고, plate는 한 시간 동안 실내온도에서 흔들어서 배양하였다. 배양액을 제거하고 well을 씻은 다음에 3,3',5,5'-tetramethylbenzidine/hydrogen peroxide solution을 첨가했다. Plate는 흔들어서 실내온도에서 배양하였고, 반응은 30분 후에 H2SO4를 가하여서 멈추었다. 450㎚ 파장에서 각각 well 내용물의 흡광도를 측정하였다.
杏仁 물추출물과 Amygdalin의 NO 합성에 미치는 효과를 측정하기 위하여 상업용으로 구입 가능한 NO detection kit(Intron, Inc., Seoul, Korea)을 사용하여 세포가 없는 배양 상청액의 아질산염(NO2-)의 양을 측정하였다. 100 ㎕의 상청액을 모은 후, 50㎕ N1 완충액을 각 well에 첨가하였고, 상온에서 10분 동안 plate에서 배양하였다. 그후에 50㎕의 N2 완충액을 가했고, plate는 상온에서 10분 동안 배양하였다. 540㎚ 파장에서 각 well 내용물의 흡광도를 측정하였다. 아질산염의 농도는 표준 아질산염 곡선을 사용하여 측정하였다.
Ⅲ. 결 과
24시간 동안 1㎍/㎖, 10㎍/㎖, 100㎍/㎖, 1,000㎍/㎖ 그리고 10,000㎍/㎖ 의 농도에서 杏仁 물추출물로 배양된 세포의 생존율은 각각 대조값의 102.84± 1.81%, 102.97 ± 0.86%, 103.96 ± 1.45%, 90.05 ± 0.97% 그리고 79.81 ± 0.47% 이었다. MTT 측정은 쥐의 BV-2 미교세포들에 대해 100㎍/㎖농도에 도달하기 전까지는 杏仁 물추출물은 독성이 없는 것을 보여주었다(Fig. 1).
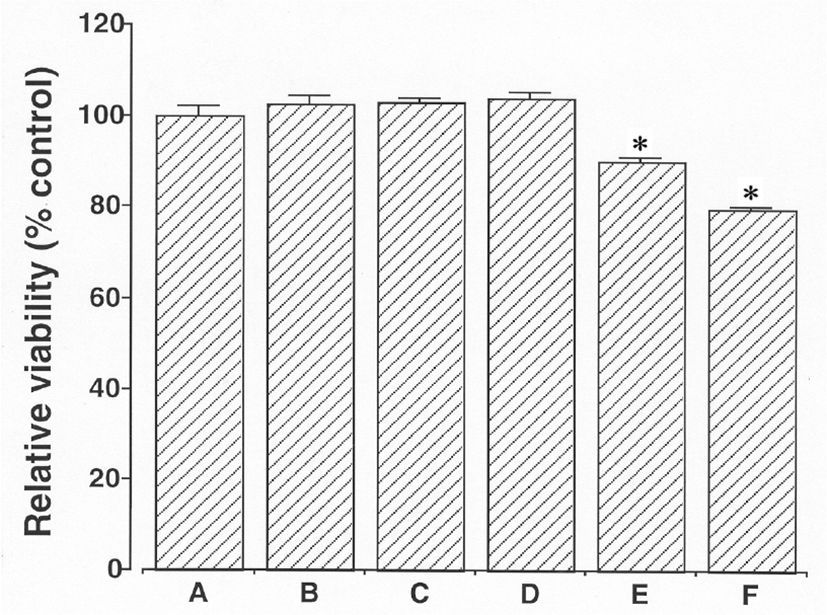
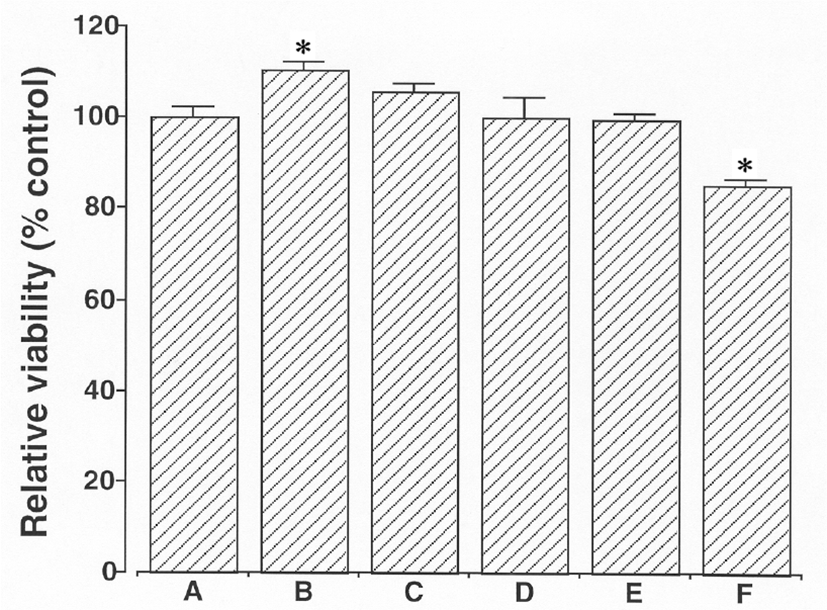
24시간 동안 1㎍/㎖, 10㎍/㎖, 100㎍/㎖, 1,000㎍/㎖ 그리고 10,000㎍/㎖ 의 농도에서 Amygdalin으로 배양된 세포의 생존율은 각각 대조값의 110.70 ± 1.53%, 105.61 ± 1.74%, 100.00 ± 4.61%, 99.64 ± 1.19%, 그리고 85.54 ± 1.16% 이었다. MTT 측정은 쥐의 BV-2 미교세포들에 대해 1,000㎍/㎖농도에 도달하기 전까지는 Amygdalin은 독성이 없는 것을 보여주었다. 杏仁 물추출물은 Amygdalin과 비교했을 때 10배정도 세포독성의 잠재성을 나타냈다(Fig. 2).
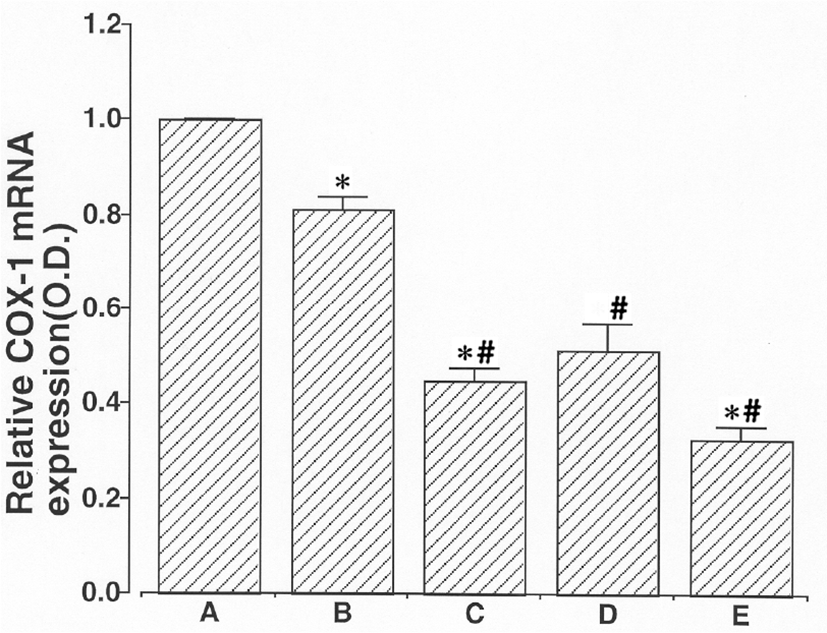
COX-1, COX-2 그리고 iNOS의 mRNA 레벨을 결정하기 위해 RT-PCR 분석을 수행했다. 이 연구에서 비교세포에서 COX-1, COX-2, 그리고 iNOS의 레벨은 1.00으로 정했다. 6시간 동안 2㎍/㎖ LPS으로 처리한 후, COX-1 mRNA의 수준은 0.94 ± 0.06 였다. 이 값은 2㎕/㎖ LPS 노출 1시간 전에 100㎕/㎖ 杏仁 물추출물, 100㎕/㎖ Amygdalin과 50㎍/㎖ aspirin으로 처리한 세포 내에서는 각각 0.48 ± 0.02, 0.72 ± 0.08 그리고 0.35 ± 0.04로 감소하였다. LPS처리는 쥐 BV-2 미교세포내에서 COX-1 mRNA 발현에 큰 효과를 발휘했다. 2㎍/㎖ LPS 노출 1시간 전에 100㎍/㎖ 杏仁 물추출물, 100㎍/㎖ Amygdalin과 50㎍/㎖ aspirin의 전처리는 COX-1 mRNA 발현을 유의하게 억제하는 것으로 드러났다. Amygdalin과 비교했을 때 杏仁 물추출물은 COX-1 mRNA 발현에 억제효과가 더 있었다(Fig. 3).
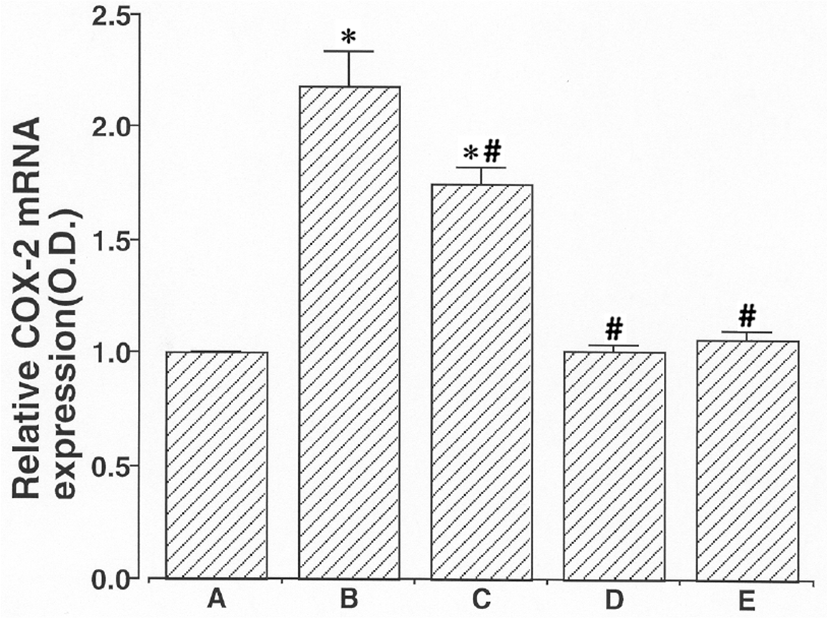
6시간 동안 2㎍/㎖ LPS 처리를 한 후 COX-2 mRNA 수준은 눈에 띄게 2.18 ± 0.36로 증가하였으나, 2㎍/㎖ LPS 노출 한 시간 전에 100㎍/㎖ 杏仁 물추출물, 100㎍/㎖ Amygdalin과 50㎍/㎖ aspirin으로 처리한 세포 내에서 값은 각각 1.75 ± 0.16, 1.01 ± 0.05 과 1.06 ± 0.08로 감소하였다. LPS 처리는 쥐 BV-2 미교세포 내에서 COX-2 mRNA 발현을 유의하게 증가시켰다. 100㎕/㎖ 杏仁 물추출물, 100㎕/㎖ Amygdalin과 50㎍/㎖ aspirin의 전처리는 LPS-유도된 COX-2 mRNA 발현을 억제했다. 杏仁 물추출물과 비교했을 때 Amygdalin은 LPS-유도된 COX-2 mRNA 발현에 더 억제효과가 있었다(Fig. 4).
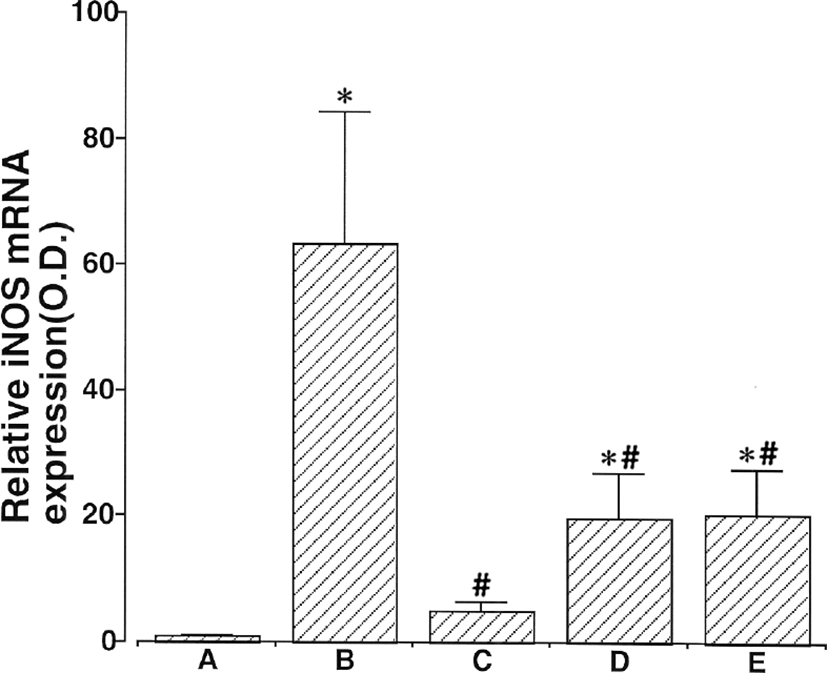
6시간 동안 2㎍/㎖ LPS로 처리한 후에 iNOS mRNA 의 수준은 5.53 ± 0.53으로 증가했다. 반면에 2㎍/㎖ LPS 노출 한시간 전에 100㎍/㎖ 杏仁 물추출물, 100㎍/㎖ Amygdalin과 50㎍/㎖ aspirin으로 처리한 세포 내에서는 이 값이 각각 2.20 ± 0.22, 3.34 ± 0.49와 2.80 ± 0.39로 감소하였다. LPS 처리는 쥐 BV-2 미교세포 내에서 iNOS mRNA발현을 유의하게 증가시켰다. 100㎕/㎖ 杏仁 물추출물, 100㎕/㎖ Amygdalin과 50㎍/㎖ aspirin의 전처리는 LPS로 유도된 iNOS mRNA 발현을 억제했다. 杏仁 물추출물과 Amygdalin은 LPS로 유도된 iNOS mRNA 발현에 유의한 억제효과가 있었다(Fig. 5).
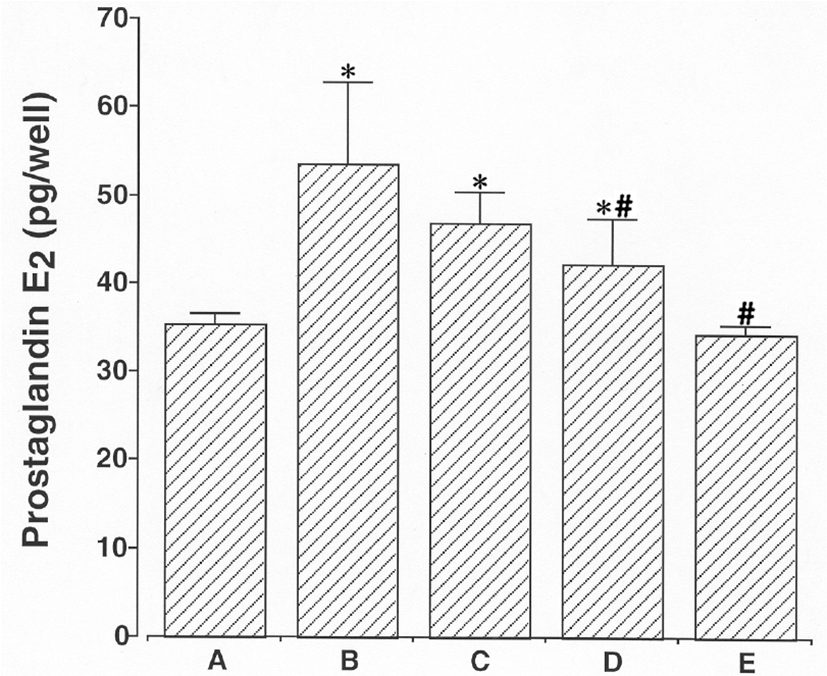
PGE2 면역측정 결과에서 본 바와 같이, 2㎍/㎖ LPS에 24시간 동안 노출시킨 후 배지에서의 PGE2의 양은 35.33 ± 1.20pg/㎖ 에서 53.67 ± 9.06pg/㎖로 증가하였다. 그러나 이 값은 100㎕/㎖ 杏仁 물추출물, 100 ㎕/㎖ Amygdalin과 50㎍/㎖ aspirin으로 처리하면, 각각 47.00 ± 3.46 pg/㎖, 42.17 ± 5.17 pg/㎖ 과 34.5 ± 0.76으로 감소하였다. LPS 처리는 쥐 BV-2 미교세포내 PGE2 합성을 증가시켰다. 100㎕/㎖ 杏仁 물추출물, 100㎕/㎖ Amygdalin과 50㎍/㎖ aspirin으로 전처리는 LPS로 유도된 PGE2 합성을 유의하게 억제하였다(Fig. 6).
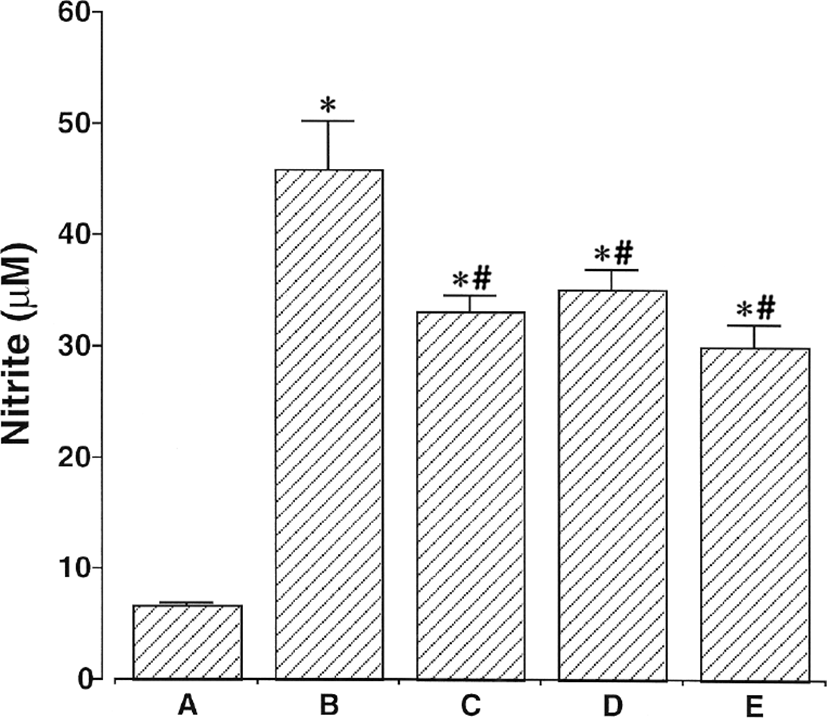
NO 탐지 측정의 결과에서 본 바와 같이, 2㎍/㎖ LPS에 24시간 동안 노출시킨 후 아질산염의 양은 6.63 ± 0.20㎛ 에서 45.97 ± 4.30㎛으로 증가하였다. 반면에 이 값은 100㎕/㎖ 杏仁 물추출물, 100㎕/㎖ Amygdalin과 50㎍/㎖ aspirin으로 처리하면, 각각 33.20 ± 1.36㎛, 35.19 ± 1.68㎛과 30.22 ± 2.12㎛으로 감소하였다. LPS 처리는 쥐 BV-2 미교세포 내에서 NO 생산을 증가시켰다. 100㎕/㎖ 杏仁 물추출물, 100㎕/㎖ Amygdalin과 50㎍/㎖ aspirin의 전처리는 LPS로 유도된 NO 생산을 유의하게 억제하였다. 杏仁 물추출물과 Amygdalin은 LPS로 유도된 NO 생산에 매우 유의한 억제효과가 있었다(Fig. 7).
Ⅳ. 고 찰
Amygdalin은 杏仁의 중요한 구성성분으로 알려져 있다. 杏仁 물추출물은 약 10%의 Amygdalin을 포함한다. 이 연구에서 Amygdalin과 비교했을 때 杏仁은 10배의 세포독성 잠재성이 나타났다.
LPS는 cell walls of gram-negative bacteria에서 추출하였고, 많은 감염의 염증후유증들을 중개한다13). LPS는 감염 세포들의 활성과 cytokines과 다른 매개재들의 생성을 포함하는 감염반응들의 발병에 중요한 역할을 담당하는 몇몇의 주요 세포반응을 시작하게 한다. 이 연구에서 LPS에 활성화된 미교세포들은 많은 양의 PGE2와 NO를 생산함을 보였고, 이러한 물질들은 병리학적 자극에 대한 microglial 반응의 최종 산물을 결정하는데 결정적인 요인으로 알려졌다. COX와 NOS의 유도성 이성체가 발현될 때 PGs 합성과 NO 생산은 눈에 띄게 증가하였다.
COX-1 이성체는 대부분의 조직에서 생리적 역할을 하는 단백질이고, 정상적인 생리학적기능을 위해 PGs 합성을 촉진시킨다. COX-1 은 일정한 값으로 발현되었고, 이 값들은 다양한 자극에도 변하지 않았다. 대조적으로 유도성 이성체 COX-2의 발현은 다양한 세포 형태에 있어서 종양 촉진자들, 성장요소들, cytokine들과 pro-inflammatory 분자들에 의해서 급속하게 자극되었다9). COX-2는 감염과 같은 여러 병리학적 조건상에서 많은 양의 PGs을 생산하는 것으로 알려져 있고, microglia을 포함하는 염증세포에서 발현되는 주된 이성체이다10). Aspirin과 같은 비스테로이드 항 염증약(NSAIDs)은 COX의 두 이성체를 억제하고, COX-2를 억제함으로 유익한 효과를 나타내고, COX-1을 억제하는 유해효과를 나타냈다. NSAIDs는 세계적으로 가장 많이 처방 받는 약의 한 부분이기 때문에 COX-2를 선택적으로 억제하는 물질을 찾는 것은 미래에 광범위한 임상적인 유익함을 제공할 것이다14).
본 연구결과들은 杏仁 물추출물과 Amygdalin 둘 다 쥐 BV-2 미교세포 내에서 COX-1 mRNA 발현을 억제함을 보였다. 杏仁 물추출물은 Amygdalin보다 좀 더 잠재적으로 COX-1 mRNA 발현을 억제함을 보였다. 이러한 결과들은 杏仁 물추출물과 비교했을 때 Amygdalin이 잠재적으로 소화성 궤양 형성과 COX-1 억제와 연관된 신부전증과 같은 부작용에 대해 상대적으로 적음을 제시한다.
본 연구결과들은 쥐 BV-2 미교세포 내에서 COX-2 mRNA 발현이 LPS 처리에 의해 눈에 띄게 증가함을 보였고, 杏仁 물추출물과 Amygdalin 용액이 LPS로 유도된 COX-2 mRNA 발현을 저해함을 보인다. 杏仁 물추출물과 비교했을 때 쥐 BV-2 미교세포 내에서 Amygdalin은 LPS로 유도된 COX-2의 mRNA 발현과 PGE2 생산에 좀더 잠재적인 억제효과가 있었다. 창 등3)은 쥐 BV-2 미교세포 내에서 COX-2 mRNA의 억제에 의한 杏仁의 항염증과 진통효과는 Amygdalin의 함량에 의존할 수 있다고 제안하였다.
쥐 BV-2 미교세포 내에서 PGE2 합성은 LPS 처리에 의해 증가되고, 杏仁 물추출물과 Amygdalin은 LPS로 유도된 PGE2 합성을 억제했다. LPS로 유도된 PGE2 합성에 대한 억제효과는 杏仁 물추출물과 비교했을 때 Amygdalin 용액에서 좀 더 효능이 있었다.
염증질환 동안에 NO생산은 iNOS 경로를 통해 증가되었고, 과잉 NO생산은 세포 손상을 유도하였다. iNOS 염색체의 발현은 여러 병리생리학적 조건하에서 증가되고, 이것은 다시 cytokine들과 LPS 같은 분자들의 염증 신호에 응답해서 많은 양의 NO를 생산한다9,14).
본 연구는 쥐 BV-2 미교세포 내에서 iNOS mRNA 발현은 LPS에 의해 증가되었고, 杏仁 물추출물과 Amygdalin 용액은 LPS로 유도된 iNOS mRNA 발현을 억제함을 보였다. 杏仁과 Amygdalin은 쥐 BV-2 미교세포 내에서 LPS로 유도된 iNOS mRNA 발현에 유사한 억제효과가 있었다. 쥐 BV-2 미교세포 내에서 NO생산은 LPS처리에 의해 증진되었고, 杏仁 물추출물과 Amygdalin 용액은 유사한 효과로 LPS로 유도된 NO 생산을 억제했다. 이 연구 결과에 따르면 Amygdalin은 COX-2 경로 억제를 통해 LPS- induced inflammation에 대항하는 항염증과 진통효과를 발휘할 수 있고, 반면에 杏仁은 iNOS 경로의 억제를 통해 LPS-induced inflammation에 대항하는 항염증과 진통효과를 발휘할 수 있음을 보였다. 본 연구에서 杏仁으로부터 추출한 Amygdalin이 杏仁 물추출물보다 염증질환치료에 있어 훨씬 안전하고 믿을만한 약임을 알 수 있었다.
Ⅴ. 결 론
杏仁 물추출물과 杏仁에서 추출된 Amygdalin 용액의 Prostaglandin E2 합성과 NO 생성에 미치는 효과들을 연구하기 위해 3-(4,5-dimethylthiazol-2-yl)-2, 5-diphenyltetrazolium bromide(MTT) 측정, Reverse transcription-poly merase chain reaction (RT-PCR), Prostaglandin E2 면역측정과 NO 생성을 측정하였는바 다음과 같은 결과를 얻었다.
-
杏仁 물추출물과 Amygdalin 용액이 세포 생존력에 미치는 효과를 보면, 杏仁은 물추출물 100㎍/㎖, Amygdalin은 1,000㎍/㎖ 농도까지는 BV-2 미교세포에 독성이 없었다.
-
杏仁 물추출물과 Amygdalin 용액이 COX-1과 COX-2의 mRNA 발현에 미치는 효과를 보면, 杏仁 물추출물과 Amygdalin 각각 100㎍/㎖ 투여한 군들은 LPS만 투여한 군에 비해 COX-1과 COX-2의 mRNA 발현 모두 유의한 감소를 나타냈다.
-
杏仁 물추출물과 Amygdalin 용액이 iNOS 의 mRNA 발현에 미치는 효과를 보면, 杏仁 물추출물과 Amygdalin 각각 100㎍/㎖ 투여한 군들은 LPS만 투여한 군에 비해 iNOS 의 mRNA 발현 모두 유의한 감소를 나타냈다.
-
杏仁 물추출물과 Amygdalin 용액이 PGE2 합성에 미치는 효과를 보면, Amygdalin 100㎍/㎖ 투여한 군에서만 LPS만 투여한 군에 비해 PGE2 합성에 유의한 감소를 나타냈다.
-
杏仁 물추출물과 Amygdalin 용액이 NO 생성에 미치는 효과를 보면, 杏仁 물추출물과 Amygdalin 각각 100㎍/㎖ 투여한 군들은 LPS만 투여한 군에 비해 NO 생성 모두 유의한 감소를 나타냈다.
이상의 결과로 보아, 杏仁 물추출물과 Amygdalin은 항염증과 진통효과를 발휘한다.






