Ⅰ. 서 론
아토피 피부염은 영유아기의 흔한 피부 질환 중 하나로 소양감과 피부의 홍반, 부종, 삼출, 태선화 등의 증상이 특징적인 만성 재발성 피부염이다1). 2017년 국민건강영양조사에 따르면 청소년의 25.1%, 성인의 4.1%가 의사로부터 아토피 피부염으로 진단받은 경험이 있었으며2), 성인의 경우 유병률이 꾸준하게 증가하는 추세이다3).
아토피 피부염의 원인은 유전적 소인과 후천적 소인으로 나눌 수 있다. 특히 성인의 아토피 피부염의 증가 추세는 아토피 피부염의 발생과 악화에 있어서 유전적 소인뿐만 아니라 산업화, 주거 행태 및 식습관의 서구화 등으로 인한 생활환경적 요인과 같은 후천적 소인이 중요하게 작용하고 있음을 시사한다4).
최근 위장 질환과 아토피 질환과의 관련성이 보고되고 있는데5), 위장은 음식의 소화 흡수로 인체 내 영양분의 원활한 공급하는 기능을 할뿐만 아니라 면역시스템에서의 중요한 작용을 하고 있다6).
한의학에서는 胎中遺熱 혹은 先天稟賦不耐 등으로 표현되는 유전적인 소인과 출생 이후의 부적절한 생활환경 습관 관리 또는 飮食失節을 아토피 피부염의 병인으로 보고 있다7).
藿香正氣散은 기능성 소화불량, 설사 등 위장관 기능 저하 증상뿐만 아니라8) 알레르기 질환과 밀접한 과민성 대장증후군 환자에서도 프로바이오틱스와의 병용투여로 효과적인 것으로 보고되었다9). 또한 이 등10)은 소음인 아토피 피부염 환자에서 藿香正氣散이 효과가 있었다는 증례를 보고한 바 있으며, 양 등11)은 藿香正氣散을 포함한 3종의 한약이 아토피 피부염의 SCORAD 수치를 개선시키며, 혈액 내 cytokine의 변화를 일으킨다고 보고한 바 있다.
이전 연구로 미루어 볼 때, 藿香正氣散은 아토피 피부염 증상 개선을 시킬 수 있을 것으로 추측되나, 기존에 연구된 藿香正氣散은 《東醫寶鑑》 또는 《東醫壽世保元》에 기반한 처방으로 현재 시판되는 한약제제 藿香正氣散과는 그 구성 및 용량에 차이가 있다. 본 연구에서는 藿香正氣散의 아토피 피부염 치료 효능을 확인하고자, DNCB로 유발된 아토피 피부염 동물 모델에서 육안 피부상태, 표피와 진피에서의 TSLP (thymic stromal lymphopoietin), mast cell 침윤을 확인하고, 피부조직의 interleukin(IL)-4, tumor necrosis factor(TNF)-α 및 혈중 IL-4, IL-6, TNF-α 수치변화를 관찰하여 藿香正氣散 경구투여가 아토피 피부염에 미치는 영향을 규명하고자 하였다.
II. 재료 및 방법
본 실험에 사용한 藿香正氣散(Gwakhyangjeonggi- san, 이하 GJS)은 한풍제약에서 제조한 엑스과립을 구입하여 사용하였다(Table 1). GJS는 성인 1일 3회, 3g 복용을 권고하고 있으며, 임상농도를 마우스 투여농도로 환산하여 사용하였다.
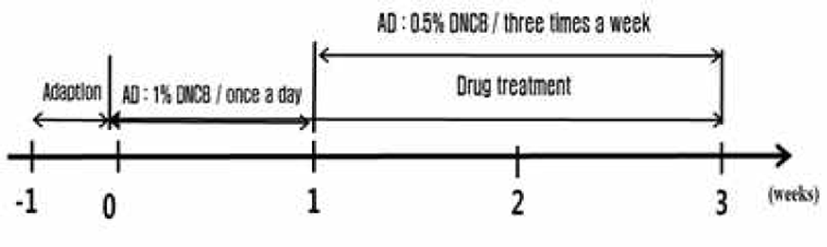
아토피 피부염을 유발하기 위해 1-Chloro-2,4-dinitrobenzene(이하 DNCB, sigma, USA)를 도포하였다. 병태 모델 유발을 위해 olive oil과 acetone(sigma, USA)을 4대 1로 섞은 혼합액에 DNCB가 혼합된 용액을 사용하였다. 먼저 Balb/c 마우스의 등 부위를 깨끗이 제모한 후 피부의 미세상처가 치유되도록 24시간 방치하였다. 실험 1주일간 1% DNCB용액(acetone:olive oil=4:1)를 매일 등 부위(100㎕)에 도포하고 2주간 일주일에 3번 0.5% DNCB용액 200㎕를 등 부위(100㎕)에 도포하여 염증을 유발하였다. 정상군은 acetone:olive oil(4:1)을 같은 용량과 시기로 도포하였다.
藿香正氣散의 효능을 관찰하기 위하여 실험군을 정상군(sham), 아토피 피부염 대조군(AD), 그리고 藿香正氣散군(GJS)으로 총 3개 군으로 각각 5마리씩 총 15마리로 나누어 실험을 시행하였다. GJS군(617㎎/㎏, 임상농도를 마우스 투여농도로 환산)은 실험 1주일 후부터 2주간 매일 0.1㎖씩 경구 투여하였다. Sham군과 AD군은 생리식염수를 GJS와 같은 용량, 용법으로 투여하였다(Fig. 1).
12)
Balb/c 마우스의 피부염은 아토피 피부염에서 일반적으로 사용되는 임상적 육안 평가법을 이용하였다. 육안평가 결과는 다음의 5가지 항목을 각각 평가한 점수의 총 합으로 나타내었으며 평가항목은 홍반(erythema), 가려움과 건조피부(pruritus & dry skin), 부종과 혈종(edema & excoriation), 짓무름(erosion), 그리고 태선화(lichenification)로 나누어졌다. 이 각각의 항목은 없음(0), 약함(1), 중등도(2), 심함(3)으로 나누어서 채점하였다.
-
① 채혈 및 혈장분리
각각의 실험군의 혈장 내 IgE와 cytokine에 약물이 미친 영향을 측정하기 위해 채혈 후 혈장을 분리하였다. 이를 위해서 최종적으로 실험이 진행된 마우스에 isoflurane(JWpharm, Korea)와 O2 혼합 gas로 호흡마취를 시킨 후 심장채혈을 통해 채취한 혈액을 Lithium heparin tube(BD, USA)에 수집한 후 원심분리기로 3,000 rpm으로 30분간 원심분리하여 상층의 혈장을 분리하였다.
-
② 혈장 내 IgE 측정
혈장 IgE량은 실험 종류 후 희생하여 채취한 혈장을 이용하여 ELISA kit(Bethyl, USA)로 측정하였다. 실험방법은 먼저 혈장 샘플 및 standards를 100㎕씩 96well plate에 넣고 1시간 동안 실온에 반응시킨다. 그 후 anti-IgE를 well당 100㎕씩 넣고 1시간 동안 실온에 반응한 후 IgE를 인지하는 2차 항체를 well당 100㎕씩 넣고 30분간 실온에 반응시킨다. Substrate인 TMB(tetramethylbenzidine) solution을 well당 100㎕씩 넣고 30분간 반응시킨 후, 100㎕의 stop solution을 넣었다. 실험결과는 ELISA reader기의 450㎚의 filter에서 값을 측정하였다.
-
③ 혈장 내 cytokine(IL-4, TNF-α 및 IL-6) 측정
혈장 내의 cytokine인 IL-4, TNF-α, 그리고 IL-6는 Bio-Plex Pro Mouse Cytokine Th1/Th2 Assay kit(Bio-rad, USA)를 통해 측정하였다. IL-4, TNF-α, 그리고 IL-6의 beads를 50㎕씩 96well plate에 넣고 활성화시킨 후 혈장 및 standards를 50㎕씩 넣어 상온에서 30분간 beads와 결합시킨다. antibody를 25㎕씩 넣고 상온 850rpm으로 30분간 반응시킨 후 SA-PE(streptavidin-phycoerythrin)를 50㎕씩 넣고 상온 850rpm으로 10분간 반응시킨다. 실험결과는 Bio-Plex 200 System(Bio-Rad, USA)으로 측정하였다.
명확한 조직병리학적 관찰을 위해 등 피부 전체 두께(㎛), 단위 면적당 등 피부 진피 내 축적 염증세포와 비만세포 수(cells/㎟), 등 피부 진피 및 표피 내 TSLP 세포 수(cells/㎟)를 관찰하였다.
-
① 조직병리학적 평가
GJS 투여로 개선된 생쥐 피부의 조직을 관찰하기 위하여 H&E(hematoxylin & Eosin stain) 염색과 TB 염색(Toluidine blue stain)을 시행하였다. 마우스를 희생시킨 후 피부조직을 일정부분 절제한 후 이를 10% 포르말린에 고정한 다음 파라핀에 포매하였다. 포매된 조직을 미세절단기(Leica, Germany)를 사용하여 4 ㎛ 두께로 박절하였다. 이후 슬라이드에 부착시킨 후 탈수와 투명(cleansing) 과정을 거쳐 흐르는 물에 침전시켰고 파라핀을 제거하는 과정을 거친 조직 절편은 일반 조직학적 검사를 위해 H&E 염색을 실시하였고, 비만세포를 관찰하기 위해 TB 염색을 실시하여 광학현미경(Nikon, Japan)으로 관찰하였다.
-
② 면역조직학적 검사
10 % 포르말린으로 고정하여 파라핀으로 포매한 피부 조직의 표피와 진피에서 TSLP의 면역반응을 확인하였다. TSLP antibody(Thermofisher, USA)를 이용하여 ABC(Avidin-Biotin Complex, Thermofisher) 기반 면역조직화학적 방법을 통해 실시하였고, 광학현미경(Nikon)으로 관찰하였다.
채취한 마우스의 피부 조직을 RIPA buffer를 넣고 분쇄기로 균질화 한 후 4°C에서 30 분간 반응 시킨 후, 13,000rpm 으로 10 분간 원심 분리하여 단백질을 추출하였다. 단백질정량은 bicinchoninic acid (BCA, Thermofisher)법을 이용하여 단백질의 동량을 4-12% Bis-Tris Protein Gels(Thermofisher)로 전기 영동하여 분리한 후 nitrocellulose membrane으로 transfer하였다. 비특이적 antibody 결합을 방지하기 위해 membrane을 5% skim milk가 함유된 Tris-buffered saline(TBS) 용액에 상온에서 1 시간 동안 blocking하였다. 그 후 1:1,000으로 희석한 각 타겟 단백질인 1차 항체 IL-4, TNF-α, 그리고 β-actin(Santacruz, USA)를 12 시간 이상 처리하였다. 그 후 TBS-Tween 20으로 3회 세척한 다음 1:2,000으로 희석시킨 2차 antibody(ENZO, USA)를 상온에서 1 시간 반응시키고 TBS-tween 20으로 3회 세척한 후 ECL solution(Bio-Rad)을 반응시켜 발현 정도를 Chemidoc image analyzer(Bio-Rad)을 사용하여 측정 후 정량하였다.
Ⅲ. 결 과
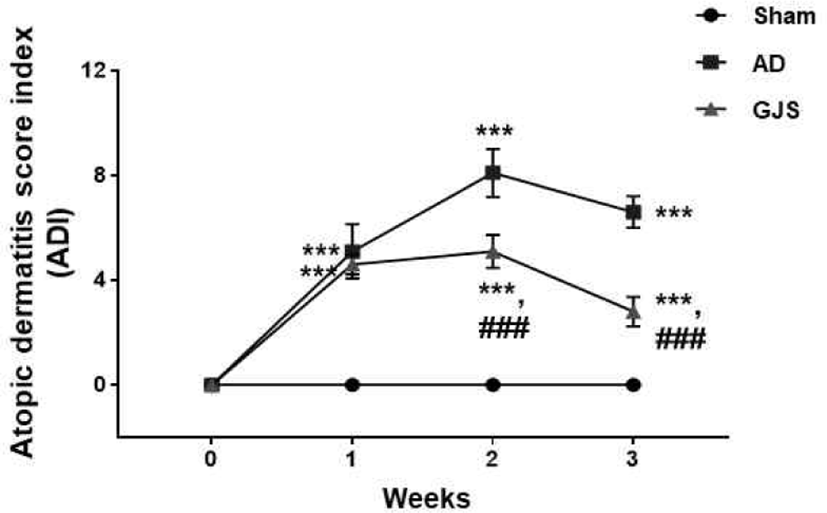
DNCB로 피부염을 유발한 아토피 동물 모델에서 GJS 2주 투여 후 홍반, 가려움과 피부건조, 부종과 혈종, 짓무름, 태선화 정도를 3점 척도로 점수를 부여하여 Atopic dermatitis index(ADI)를 측정하였다(Fig. 2). AD군은 홍반, 가려움과 피부건조, 부종과 혈종, 짓무름, 태선화 등의 증상이 2주에 가장 심해서 ADI 평균 점수가 8.0±0.41 이었으며 3주의 ADI는 2주에 비하여 약간 감소하는 경향을 보였다(6.6± 0.27, Fig. 3). GJS군의 경우 2주부터 AD군에 비해 유의하게 아토피 증상이 감소하였으며(p<0.05, Fig. 3), 치료가 끝난 3주까지 AD군에 비하여 ADI 평균 점수가 유의하게 감소하였다(p<0.01, Fig. 3).

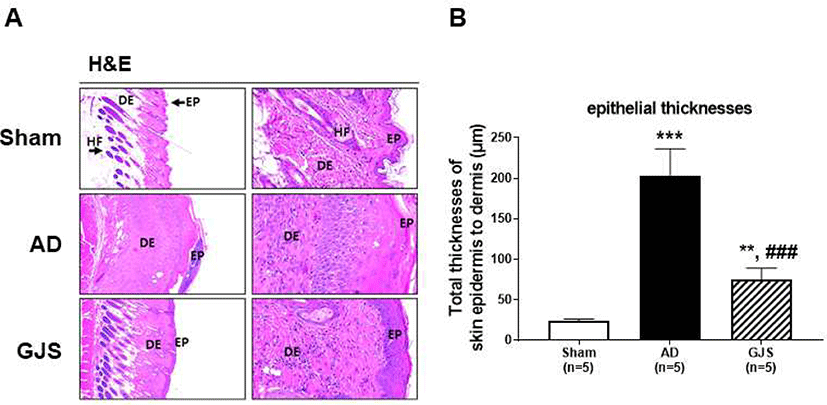
H&E 염색법을 이용하여 피부조직을 분석한 결과, Sham군의 귀 조직에서는 표피, 진피 등이 정상적으로 관찰되었으나, AD군은 표피의 각질화가 발생되었으며 GJS군에서는 표피의 각질화도 심하지 않은 것으로 관찰되었다(Fig. 4A). 더불어 GJS의 투여가 생쥐의 표피 두께에 미친 영향을 H&E 염색을 통해서 분석한 결과, Sham군에 비해서 AD군에서 유의하게 두꺼워져 있는 것을 확인하였다(p<0.001, Fig. 4B). 특히 아토피 유발 후 GJS 투여군은 Sham군에 비해서 유의하 게 증가하기는 하였으나(p<0.05), AD군에 비해서는 유의하게 두께의 감소가 있음을 확인할 수 있었다(p<0.001, Fig. 4B).
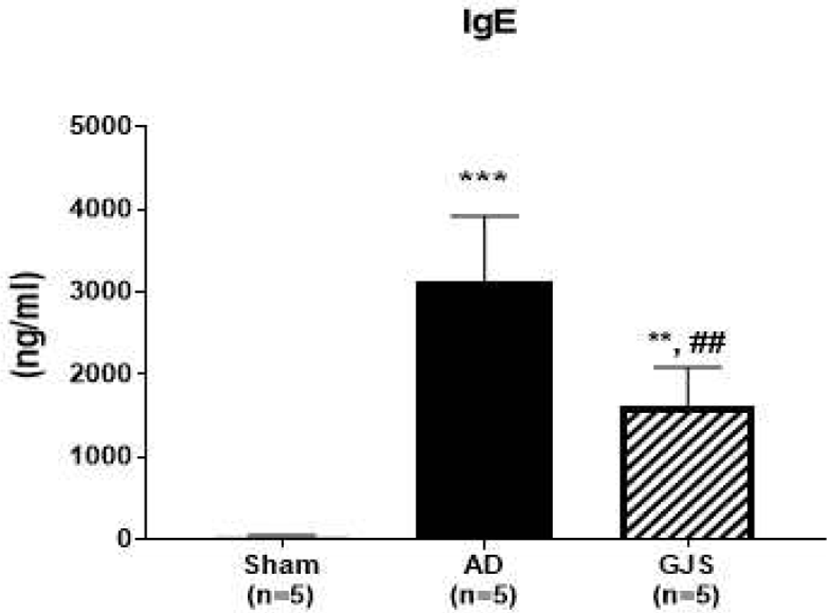
GJS 2주 투여 종료 후 혈액 내 IgE를 측정하였다. Sham군에 비하여 AD군은 유의하게 IgE수치가 증가하였으며(3126±791.8, p<0.001, Fig. 5), GJS군은 Sham군에 비하여서는 유의하게 증가하였으나(p<0.01, Fig. 5), AD군에 비해서는 유의하게 감소하고 있음을 관찰하였다(p<0.01, Fig. 5).
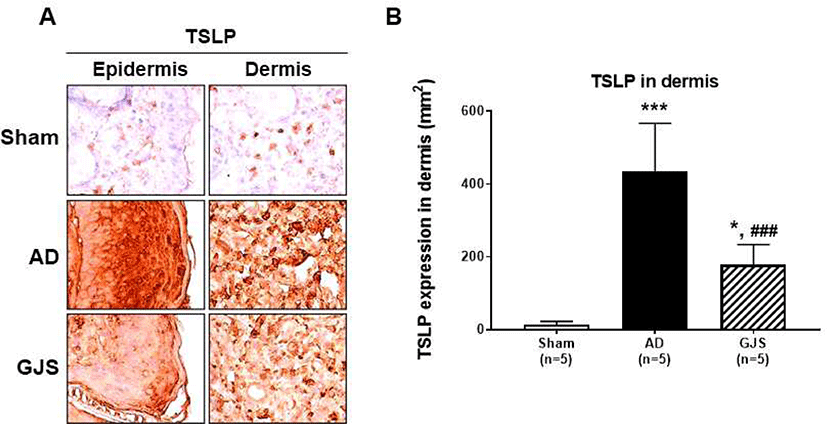
피부조직의 TSLP 발현을 살펴본 결과, 표피와 진피에서 TSLP가 AD군에서 증가하였다가 GJS군에서 비교적 감소하는 것을 확인하였다. 특히 단위면적당 진피의 TSLP의 발현량은 AD군에서 Sham군에 비하여 유의하게 증가하고 있음을 확인하였다(p<0.001, Fig. 6A). 더불어, GJS는 Sham 군에 비하여서는 유의하게 증가하였으나(p<0.05, Fig. 6B), AD군에 비하여서는 유의하게 감소하고 있었다(p<0.001, Fig. 6B).
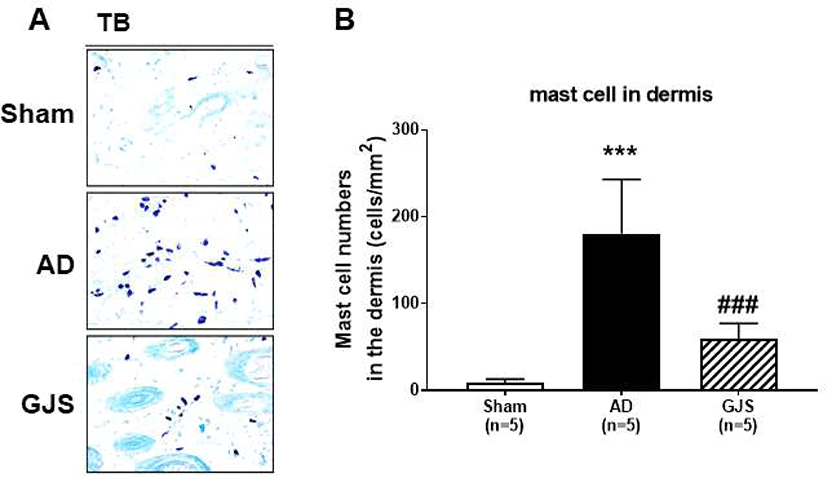
피부 조직의 mast cell 침윤을 확인하기 위하여 toludine blue(TB) 염색을 시행한 결과, Sham 군에 비하여 아토피 유발군에서 확연한 염증 세포의 침윤정도가 증가함을 확인할 수 있었다(Fig. 7A). 특히 단위 면적당 mast cell 수치 또한 AD군에서 Sham군에 비하여 증가하였으며(p<0.001, Fig. 7B), GJS군에서는 침윤정도가 유의하게 감소하였다(p<0.001, Fig. 7b).
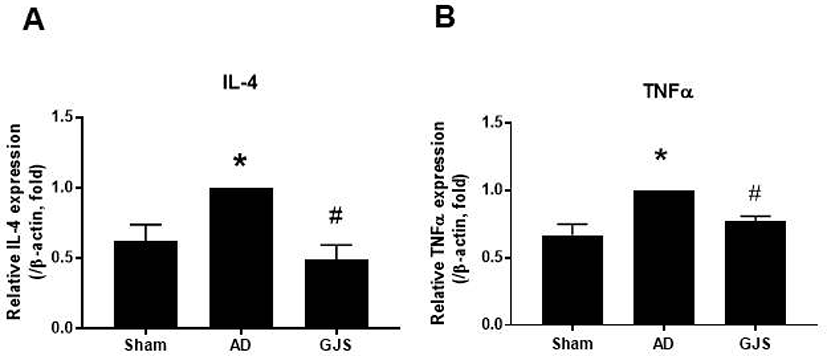
TSLP의 발현에 따른 Th1면역 관련한 IL-4 발현을 측정하였다. AD군은 Sham에 비하여 유의하게 증가한 IL-4 발현을 보였으며(p<0.05, Fig. 8A), GJS에서 는 AD군에 비하여 유의하게 감소하였다(p<0.05, Fig. 8A). 더불어 pro-inflammatory cytokine인 TNF-α의 발현 또한 AD군은 Sham에 비하여 유의하게 증가하였으나(p<0.05, Fig. 8B), GJS에서는 AD군에 비하여 유의하게 감소하였다(p<0.05, Fig. 8B).
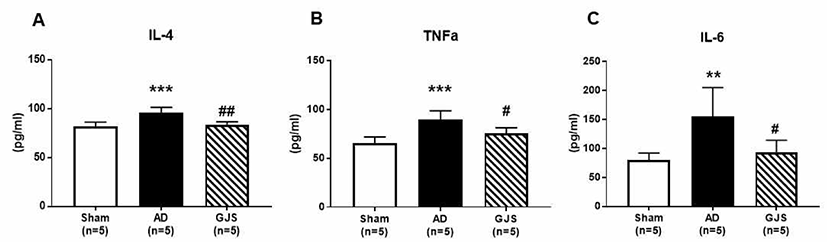
GJS의 아토피 피부염 효과가 피부 조직의 cytokine 분비 뿐 만 아니라 혈중의 cytokine에도 영향이 있는지 살펴보기 위하여 T helper type 2(Th2) cytokine인 IL-4와 proinflammatory cytokine인 TNF-α, IL-6 수치를 분석하였다. AD군은 Sham군 대비 IL-4(p<0.001, Fig. 9A), TNF-α(p<0.001, Fig. 9B), IL-6(p<0.001, Fig. 9C)가 모두 유의하게 증가하였으며, GJS는 AD군 대비 혈중 IL-4(p<0.01, Fig. 9A), TNF-α(p<0.05, Fig. 9B), IL-6(p<0.05, Fig. 9C) 수치 또한 유의하게 감소하였다.
Ⅳ. 고 찰
아토피 피부염은 다양한 원인으로 인해 호전과 악화를 반복하는 만성 염증성 피부 질환으로, 병태 생리에 대하여 다양한 연구들이 수행 중이나 아직 명확한 원인이 밝혀지지 않고 있다. 다만, 유전적 요인, 환경적 요인 등이 복합적으로 작용하는 것으로 보고되고 있으며,13) 부모에게 아토피 피부염의 기왕력이 있으면 자녀에게서 아토피 피부염이 발생하는 경우가 부모에게 아토피 피부염의 기왕력이 없는 경우보다 많았으며, 피부장벽을 구성하는 핵심 단백질인 필라그린(filaggrin)의 돌연변이가 대표적인 유전적 요인으로는 보고되고 있다14). 또한 유전적 요인을 가지고 있어도 아토피 피부염이 반드시 나타나는 것은 아니기 때문에 David Strachan은 위생환경이 매우 좋아짐에 따라 세균에 대한 면역반응이 줄어들고 알레르기를 일으키는 면역반응이 증가하고 있다고 제시한 바 있다15). 이러한 알레르기를 일으키는 원인으로는 집먼지 진드기, 음식물, 애완동물의 털, 바퀴벌레, 꽃가루 등이 꼽히고 있으며16), 치료가 되었더라도 외부항원 노출 시 재발되는 질병으로 적극적인 치료와 예방관리가 중요하다.
아토피 피부염의 한약 치료효과에 대해 확인한 체 계적 문헌고찰 연구 결과, 아토피 피부염에서 한약 치료는 양약치료(conventional medicines)에 비해 전반적인 유효율(RR 1.43, 95% CI 1.27-1.61)이 더 높았으며, 가려움증은 감소하는 것(SMD 0.83, 95% CI 1.43-0.22)으로 보고된 바 있으며17), 消風散, 補中益氣湯이 아토피 치료에 효과적인 것으로 확인된 바 있다18),19).
藿香正氣散은 《東醫寶鑑》에 傷寒陰證으로 머리가 아프고 몸이 아픈 것을 치료하는 것으로 제시되어 있는 처방으로20), 정 등21)은 藿香正氣散은 LPS (Lipopolysaccharide)로 염증반응을 유도한 RAW 264.7 세포주에서 proinflammatory cytokine인 TNF-α, IL-6, Prostaglandin E2의 생성을 억제 시킨다는 사실을 보고한 바 있으며, 또한 Han 등22)의 연구에서 藿香正氣散은 DNFB로 유도한 알레르기 피부염 동물모델에서 귀부종 및 비만세포 탈과립지수에서 대조군에 비해 효과적으로 억제하는 것으로 확인되었다. 이와 같이 藿香正氣散은 항염증, 항알레르기 효능이 있어 아토피 피부염에 효과가 있을 것으로 추정되나, 본 연구에서 사용한 藿香正氣散 한약제제에 대한 유효성 연구는 보고되지 않았다.
본 연구에서는 藿香正氣散의 효능을 관찰하기 위해 Th2에 특화되어 면역학 분야에 광범위하게 활용되는 종인 Balb/c mouse에 hapten 자극으로 DNCB를 이용하여 피부염을 유발하여 아토피 피부염 증상을 유발하였다23). 매일 1차례 1% DNCB를 1주일간 도포하여 피부염을 유발하고, DNCB 도포 7일째부터 藿香正氣散을 매일 1회 경구투여한 후 2주 후 육안 피부상태, 표피와 진피에서의 TSLP 발현 및 mast cell 침윤을 확인하였고, 피부조직의 IL-4, TNF-α 및 혈중 IL-4, IL-6, TNF-α 변화를 관찰하였다.
연구 결과, 홍반, 가려움 및 건조, 부종 및 혈종, 짓무름, 태선화 상태를 측정하여 점수를 구성한 ADI24) 수치 부분에 있어서, GJS군은 AD군 대비 ADI 수치를 유의하게 감소시키는 것을 알 수 있었다. 특히, 그 효과는 치료 1주 후부터 유의했으며, 2주까지 지속되었다. 이를 통해 藿香正氣散은 아토피 피부염의 피부 임상 양상을 개선시키는 것을 알 수 있었다.
긁기, 미생물, 알레르겐 등의 자극은 keratinocyte로 하여금 TSLP를 유발시키고, 생성된 TSLP는 naive T세포를 Th2 세포 분화시키며, mast cell 생산을 촉진하여 아토피 피부염을 유발 및 악화 시키는 데 있어서 중요한 작용을 하는 것으로 알려져 있다25-27). 본 연구에서 피부 조직의 H&E 염색 결과, AD군은 Sham군에 비해 상피조직이 두꺼워졌고 GJS군에서는 AD군에 비해 감소하였다. 더불어 AD군의 피부조직에서 TSLP 발현 및 mast cell 침윤이 증가되어 있었으며, 이를 藿香正氣散이 유의하게 감소시켰다.
특히, TSLP가 유도하는 mast cell의 활성화는 Th2 면역에 중요한 cytokine 등을 활성화 시켜, 상피가 두꺼워 지거나, IgE 수치가 높아지는 등의 면역 반응을 유발시킨다. 이에 본 연구에서 TSLP 및 mast cell 침윤 증가와 연관 하여 IL-4와 IgE 수치를 분석한 결과, 피부 조직과 혈액에서 모두 IL-4의 수치가 藿香正氣散에 의해서 감소되었으며, IgE 수치 또한 유의한 감소를 보였다. IL-4는 Th2 면역 관련 cytokine 중 keratinocyte의 분화과정에서 유도된 유전자의 발현을 억제하며, fibronectin 생산을 감소시켜 피부의 상처치유반응을 손상시키는 것으로 알려져 있으며28), IgE는 mast cell과 결합하여 알레르기 반응을 유발하여 피부에 leukocyte를 응집시키고, 피부 염증, 알레르기 반응을 지속시키는 작용을 하는데29), 藿香正氣散이 이 기전에 작용하여, 아토피 피부염의 알레르기 반응을 감소시키는 것으로 추정된다.
AD군에서는 sham군에 비해 피부조직의 TNF-α 수치가 증가하였다가, GJS군에서는 감소하였다. TNF-α는 염증반응의 개시와 관련되어 있는 pro- inflammatory cytokine으로, TNF-α 단독 또는 Th2 cytokine과의 공동으로 작용하여 아토피 피부염 피부의 지질 장벽 기능을 조절하며, TSLP의 증식에도 관여한다30),31). 이에 藿香正氣散은 피부 조직의 TNF-α 조절을 통해 피부 조직의 염증 반응을 개선시키는 것으로 추측된다.
또한 피부 뿐 만 아니라 혈액 내의 TNF-α, IL-6 수치가 藿香正氣散에 의하여 감소하였다. 아토피 피부염 환자에서 혈중 pro-inflammatory cytokine인 TNF-α, IL-6 수치가 증가되어 있다는 사실이 여러 연구에서 밝혀진 바 있다31),32). 경구 투여한 藿香正氣散은 장에서 흡수되어 혈액 내 TNF-α, IL-6 수치를 조절하며, 전신의 면역 반응을 조절할 것으로 파악된다.
종합하면, 藿香正氣散은 체내에 흡수되어 아토피 피부염에서 Th2 cytokine인 IL-4와 pro- inflammatory cytokine인 TNF-α, IL-6를 감소시키며, 혈중 IgE 수치를 감소시킨다. 더불어 피부 조직에서 IL-4, TNF-α의 발현을 감소시키고, TSLP 및 비만세포 침윤을 억제하여 아토피 피부염 임상증상을 개선시키는 것으로 확인되었다.