Ⅰ. 서 론
淸心凉膈散은 《溫熱經緯》 卷五에 처음으로 기록된 방제로, 連翹, 薄荷, 黃芩, 梔子, 桔梗, 甘草, 石膏로 구성된다1). 連翹는 淸熱解毒, 薄荷는 宣散風熱하는 효능이 있으며, 黃芩, 梔子, 石膏는 胸膈의 邪熱을 淸熱瀉火하고, 桔梗, 甘草는 淸利咽喉하는 효능이 있어2,3), 淸心凉膈散은 淸熱, 散火, 利咽을 목적으로 한다. 노 등4)은 喉痧 초기에 인후 내 紅腫, 疼痛이 있으면서 發疹이 나타날 때 본 방을 처방하며, 또한 瘟毒內盛하여 咽喉가 紅腫, 疼痛하며 白點, 白痧, 白塊 등이 咽喉에 파급되었을 때 처방한다 하였다.
국내에는 淸心凉膈散을 투여한 증례가 보고된 바 없으나, 해외에서는 江 등5)이 인후 紅腫疼痛, 舌紅, 脣紅, 口渴 등의 증상을 나타내는 편도선염, 화농성 편도선염 등의 급성 喉症 환자에게 淸心凉膈散에 牧丹皮, 腊梅花, 金銀花, 赤芍藥, 白殭蠶, 牛黃 등을 加한 淸心凉膈散加味方을 적용하여 그 효과를 보고하였다.
이에 저자는 淸心凉膈散이 咽喉 紅腫疼痛, 發疹, 白痧 등의 양상을 보이는 咽喉科 염증 질환에 응용되는 것에 주목하여, 淸心凉膈散의 항염증 효과와 기전에 대해 규명하고자 하였다. In vitro 실험에서는 淸心凉膈散 열수추출물을 Raw 264.7 cell에 전처치하고 lipopolysaccharide(LPS)로 처리하여 세포 내 염증반응의 활성화 여부와 매개 인자들을 관찰하였다. 또한 생체 내에서 淸心凉膈散의 항염증 효과를 확인하기 위하여, in vivo 실험에서는 淸心凉膈散을 rat에 경구 투여 한 후 carageenan(CA)으로 족부종을 유도하여 부종 정도를 측정하였다. 이에 유의한 결과를 얻어 보고하는 바이다.
Ⅱ. 재료 및 방법
淸心凉膈散(Cheongsimyanggyeok-san)의 구성 약재인 連翹, 薄荷, 黃芩, 梔子, 桔梗, 甘草, 石膏는 대원약업사(대구, 대한민국)에서 구입하였으며, 불순물을 제거하고 grinder를 이용하여 분쇄하였다. 淸心凉膈散 160g에 1.5ℓ의 물을 첨가하고 100°C에서 3시간 동안 추출하였다(Table 1). 거즈로 1차 여과 후, No.2 filter paper(Clifton, NJ, USA)로 다시 여과하였다. 이를 진공 동결건조기(LABCONO, Kansas, Mo, USA)로 동결건조하여, 淸心凉膈散 열수추출물(CYS, Cheongsimyanggyeok-san water extract)을 제조하였다. 최종 수율은 31.89%였으며, 실험에 사용되기 전까지 4°C에서 보관하였다. 건조된 열수추출물은 정량하여 1㎎/㎖의 농도가 되도록 멸균 증류수에 용해 후, 0.2㎛ syringe filter(Nalgene, New York, NY, USA)로 여과하여 in vitro 실험에 사용하였고, in vivo 실험에서는 saline으로 용해하여 투여하였다.
세포 배양을 위한 시약으로 fetal bovine serum (FBS) 및 Dulbecco’s modified eagle’s medium (DMEM)은 HyClone laboratories(Logan, UT, USA)에서 매입하였으며, penicillin-streptomycin은 Gibco(Rockville, MD, USA)에서 매입하였다. Peptidoglycan(PGN)은 InvivoGen(San Diego, CA, USA)에서, iNOS 항체는 BD biosciences(San Jose, CA, USA), IκBα와 NF-κB의 1차 항체 및 actin 1차 항체는 Santa Cruz Biotechnology (Santa Cruz, CA, USA)에서 각각 매입하였다. Phospho-I-κBα(p-IκBα) 의 1차 항체와 Lamin A/C의 1차 항체는 Cell Signaling Technology (Danvers, MA, USA)에서, NC membrane은 Schleicher & Schuell(Dassel, Germany)에서 매입하였고, lipopolysaccharide(LPS), Dimethyl sulfoxide(DMSO), MTT, Griess reagent 및 그 외의 모든 시약들은 Sigma-Aldrich(St. Louis, MO, USA)로부터 매입하였다.
Raw 264.7 cell(murine macrophage cell line)은 한국세포주은행(서울, 대한민국)에서 분양 받아 사용하였다. 10% FBS, 100㎛/㎖ streptomycin, 100U/㎖ penicillin이 함유된 DMEM 배지를 37°C, 5% CO2 조건에서 80-90% confluence에 도달할 때까지 24-well plate에서 배양하였다. Raw 264.7 cell을 FBS가 함유되지 않은 DMEM에서 6시간 동안 추가 배양한 후, 최종 농도 10-300㎍/㎖ CYS를 함유한 DMEM으로 교환하였다. CYS 처치 1시간 후 실험 목적에 따라 추가 처치를 하지 않거나, 1㎍/㎖의 LPS 또는 30㎍/㎖의 PGN를 30분-18시간 동안 처치하여 실험에 이용하였다.
CYS 단독처리에 대한 생존율을 분석하기 위해 Raw 264.7 cell을 96 well plate에 5×104 cells/well로 분주한 다음, 3-300㎍/㎖ 농도의 CYS로 처치하여 18시간 후 MTT assay로 세포생존율을 측정하였다. LPS 또는 PGN 처치군은 Raw 264.7 cell을 96 well plate에 5×104 cells/well로 분주한 다음, 무처치 혹은 1시간 동안 CYS로 전처치한 후 LPS 1㎍/㎖ 또는 PGN 30㎍/㎖로 처치하여 18시간 후 MTT assay로 세포생존율을 측정하였다.
세포는 37°C, 5% CO2 조건의 배양기에서 배양하였고, MTT assay는 처치 후 세포배양액을 완전히 제거하여 0.2㎎/㎖ 농도의 MTT 용액 200µL를 첨가하여 4시간 동안 추가 배양하였다. MTT 용액을 완전히 제거한 후 생성된 formazan crystal에 200µL의 DMSO를 첨가하여 완전히 용해하고, 570 ㎚에서 흡광도를 Automated microplate reader (Infinite 200 Pro, Tecan, Männedorf, Switzerland)로 측정하였으며, 아래의 수식에 의해 상대적인 세포생존율을 계산하였다.
Raw 264.7 cell을 6 well plate에 5×105 cells/well로 분주하여 1시간 동안 10-300㎍/㎖ CYS로 처치 후 1㎍/㎖의 LPS 또는 30㎍/㎖의 PGN을 처치하여 18시간 후 세포 배양액을 회수하였다. 회수한 세포 배양액은 3000×g에서 3분간 원심분리하여 세포 배양액 내 불순물을 제거한 후, 96 well plate에 세포 배양액 100㎕와 Griess reagent 100㎕(5% sulphanilamide, 5% phosphoric acid, 0.1% N-[1-naphtyl]-ethylene diamine dihydrochloride)를 첨가하였다. 상온에서 10분간 반응시킨 후 automated microplate reader (Infinite 200 Pro, Tecan, Männedorf, Switzerland)로 540㎚에서의 흡광도를 측정하였다. 아래 수식을 활용하여 처치된 세포로부터 회수한 배양액 중 CYS와 세포배양액에 의한 540㎚에서의 흡광도를 보정하였다.
전세포 추출액(whole cell lysate)과 핵 분획(nuclear fraction)은 다음 방법에 따라 분리하였다. 전세포 추출액은 처치가 종료된 세포를 ice-cold PBS를 이용하여 세척한 후 cell을 scrapper로 수집하여 microtube에 옮기고, 이를 3000×g로 원심분리하여 상등액을 제거하였다. 여기에 100㎕의 용해 완충액 [10mM Tris-HCl, pH 7.1, 100mM NaCl, 10% glycerol, 1mM dithiothreitol, 0.5% Triton X-100, 1mM EDTA, 0.5% Nonidet P-40, 0.5mM phenylmethylsulfonyl fluoride(PMSF)]을 넣고 vortex한 후, 1시간 동안 4°C에서 용해한 후, 10분 동안 15000×g로 원심분리하였다. 핵 분획은 처치가 종료된 세포를 ice-cold PBS로 세척한 후 cell을 scrapper로 수집하여 microtube에 옮기고, 이를 3000×g로 원심분리하였다. 상등액을 제거하고 100㎕의 용해 완충액 [10mM HEPES(pH 7.9), 1mM DTT, 0.1mM EDTA, 10mM KCl, 0.5mM PMSF]을 넣고 vortex한 후, 세포를 완전히 용해하고 10분 동안 얼음 위에서 용해시켰다. 4°C에서 5분 동안 15000×g로 원심분리하여 상등액을 제거하고, microtube 하단에 남은 nuclei pellet에 50㎕의 추출 완충액 [20mM HEPES(pH 7.9), 1mM DTT, 1mM EDTA, 400mM NaCl, 1mM PMSF]을 가하여 vortex한 후, 얼음 위에서 1시간 동안 용해하여 4°C에서 15분 동안 15000×g로 원심분리하였다. 전세포 추출물 및 핵 분획의 단백질을 정량하여 10% SDS-PAGE로 전기 영동시킨 후, NC membrane로 다시 분리된 단백질을 전이시켰다. iNOS, p-IκBα, IκBα, NF-κB, Actin 및 Lamin A/C의 1차 항체와 반응시킨 후, 다시 2차 항체와 반응시키고 enhanced chemiluminescence detection reagents (Amersham Biosciences Corp., Piscataway, NJ, USA)를 사용하여 각 단백질의 발현 정도를 평가하였다. 상대적인 단백질 정량은 Image analyzing system(Ultra-Violet Products Ltd., Upland, CA, USA)을 이용하여 분석하였다.
6 well plate에 Raw 264.7 cell을 5×105 cells/well로 분주하여 100, 300㎍/㎖ 의 CYS를 1시간 동안 처리한 후 LPS를 18시간 동안 처리하여 세포 배양액을 회수하였다. 3000×g에서 5 분간 원심분리하여 세포 배양액 내 불순물을 제거한 후 TNF-α와 IL-1β, IL-6 함량은 각 cytokine에 해당되는 ELISA kit(Pierce endogen, Rockford, IL, USA)로 측정하였다.
실험동물은 Sprague Dawley계 수컷 rat(6주령, 160-180g)을 1주일간 환경에 적응시킨 후 실험에 사용하였으며, 온도 22-25°C, 습도 40-45%, 12시간 light/dark cycle이 유지되는 사육실의 ECRS에서 사육하였다. 사료(Nestle Purina Petcare Korea, Seoul, Korea)와 물은 자유롭게 섭취하도록 하였다. 동물실험은 대구한의대학교 동물실험윤리위원회(IACUC)의 승인을 통과(승인번호 : DHU2018-081)한 후 진행하였다.
실험군은 아무런 처리를 하지 않은 군을 normal군으로 하고, carrageenan 100㎕/rat(Sigma Chemical Co, St Louis, USA)를 주입한 군을 carrageenan군으로 하였으며, 양성대조군으로서 dexamethasone(1㎎/㎏, p.o.) 투여 후 carrageenan을 주입한 dexamethasone군, 0.3g/㎏의 CYS를 투여한 후 carrageenan을 주입한 0.3g/㎏ CYS군, 1.0g/㎏의 CYS를 투여한 후 carrageenan을 주입한 1.0g/㎏ CYS군으로 나누었다. 각 군당 rat의 수는 6마리로 하였다.
Ⅲ. 결 과
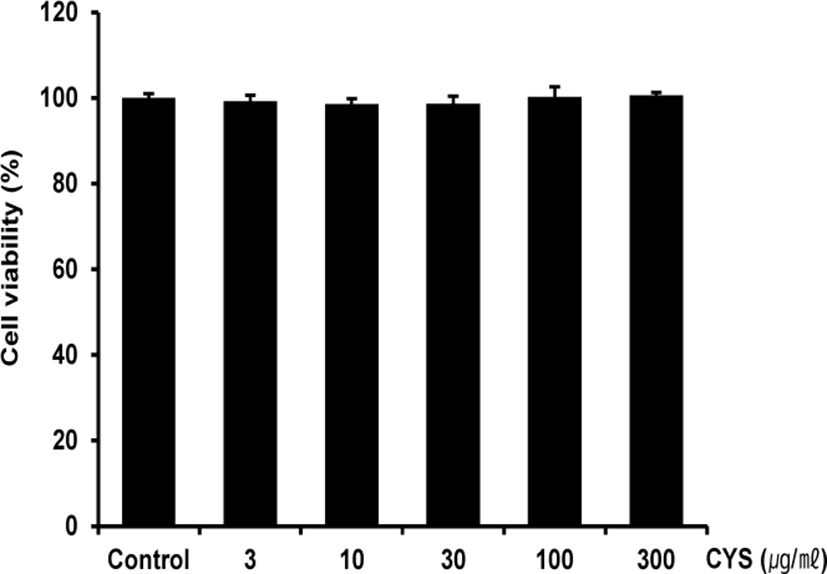
CYS의 세포 독성 유무을 확인하기 위하여 Raw 264.7 cell에 CYS를 3-300㎍/㎖ 농도로 처리하고 18시간 후 MTT assay를 이용하여 세포생존율을 측정하였다. 측정 결과 Raw 264.7 cell에 대하여 CYS의 단독 처리는 무처치 대조군과 비교하여 전 실험농도에서 유의한 세포 독성을 나타내지 않았다(Fig. 1).
LPS로 활성화된 Raw 264.7 cell에서 CYS의 NO 생성 억제 정도를 확인하기 위하여 CYS를 각각 10, 30, 100, 300㎍/㎖ 의 농도로 1시간 동안 전처치한 다음, 1㎍/㎖의 LPS를 18시간 동안 처치하여 Griess reagent와 반응시킨 후 흡광도를 측정하여 생성된 NO 양을 분석하였다. LPS 1㎍/㎖를 단독 처치한 군에서는 무처치 대조군과 비교하여 NO 생성이 3.27±0.15배 유의하게 증가하였다. CYS 30, 100, 300㎍/㎖ 에서는 LPS 단독 처치군에 비해 각각 2.42±0.01, 1.45±0.10, 1.12± 0.02배로 NO 함량을 통계적으로 유의하게 감소시켰다(Fig. 2A).
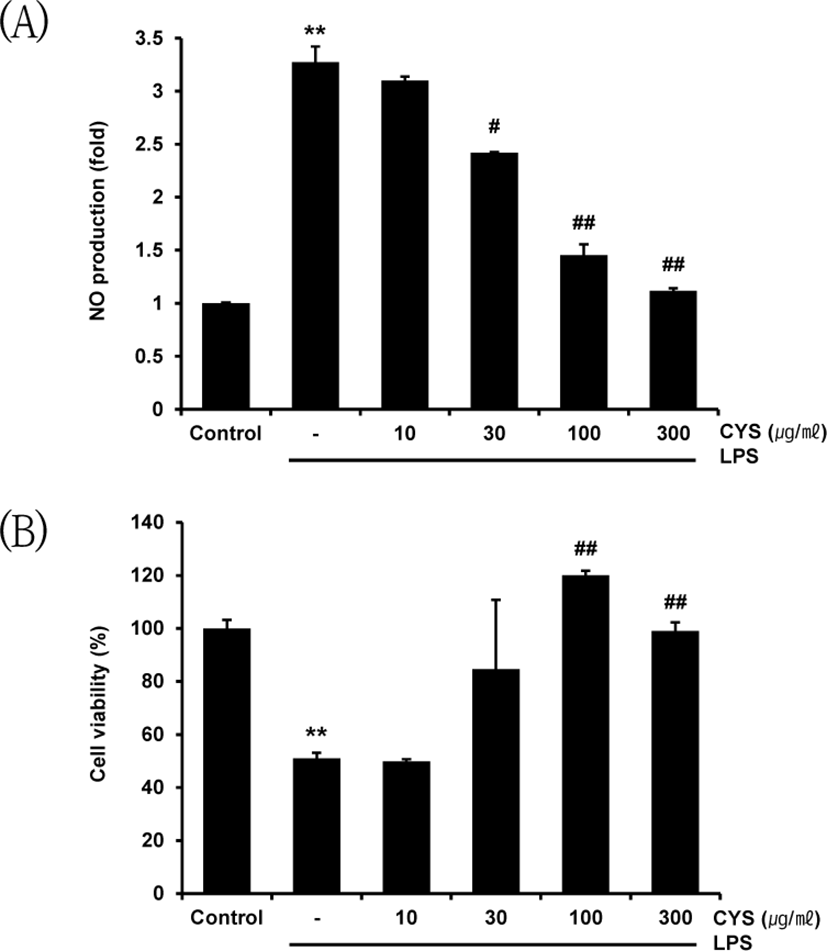
또한 CYS의 전처치가 LPS를 처리한 Raw 264.7 cell의 세포 독성에 미치는 영향을 확인하기 위하여 위와 동일한 처치 후 MMT assay를 통해 세포생존율을 측정하였다. 그 결과 세포생존율은 LPS 단독 처치를 하였을 때 무처치 대조군과 비교하여 50.94 ±2.20%로 유의하게 감소하였다. CYS 10㎍/㎖ 전처치군 또한 49.83±0.88%로 세포생존율의 감소를 유의하게 억제하지 못하였으나, CYS 30, 100, 300㎍/㎖ 처치군에서 각각 84.66±26.09, 120.05 ±1.75, 99.09±3.21%로 LPS 처치로 인한 세포생존율 감소를 유의하게 억제시켰다(Fig. 2B).
이를 통해 CYS가 30-300㎍/㎖에서 NO 생성 억제에 관여하며 세포 독성을 감소시킴을 확인하였고, 이후 본 실험 결과 유의성이 높았던 CYS 100, 300㎍/㎖의 농도에서 염증 억제 기전을 확인하기 위한 실험을 진행하였다.
LPS는 그람 음성 세균 세포벽의 구성성분 중 하나로 대식세포의 TLR4와 결합하여 염증반응을 유발 한다6). 본 실험에서는 CYS가 TLR4 ligand 외 다른 TLR ligand에 의한 염증반응 또한 억제할 수 있는지 확인하고자, TLR2 ligand인 peptidoglycan(PGN)으로 처치하여 염증반응을 유도하였다7). CYS 300㎍/㎖ 처치 후 PGN 30㎍/㎖을 1시간 동안 처리하여 NO 생성량을 분석하였고, MTT assay를 통하여 세포생존율을 측정하였다. PGN의 단독 처치는 무처치 대조군에 비하여 4.57±0.29배 NO 생성량이 증가하였고, CYS를 300㎍/㎖ 농도로 전처리 하였을 때 1.51± 0.01배 NO 생성이 억제되었다(Fig. 3A). 또한 PGN을 단독으로 처치하였을 때 세포생존율은 무처치 대조군에 비해 58.43±3.46%, CYS 300㎍/㎖ 처리 후 PGN 처치 시 69.07±3.19%로 세포생존율 감소를 유의하게 억제시켰다(Fig. 3B).
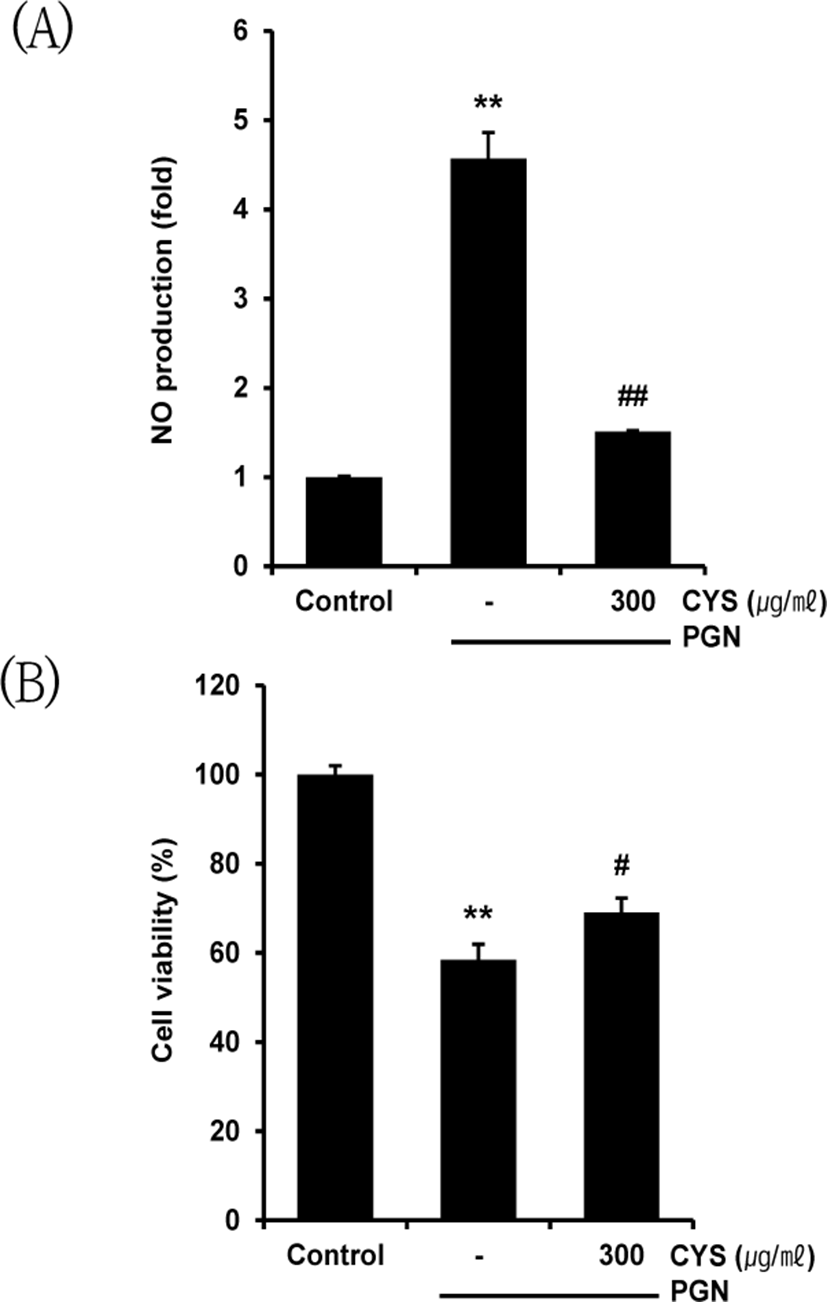
이를 통해 CYS가 TLR4 ligand인 LPS 자극 이외에도 TLR2 자극으로 인한 NO 생성량 감소 및 세포생존율 감소 또한 억제할 수 있음을 확인하였다.
LPS로 활성화된 Raw 264.7 cell에서 CYS가 iNOS의 발현을 억제하여 NO 생성을 억제한 것인지 확인하기 위하여, CYS를 100, 300㎍/㎖의 농도로 1시간 동안 전처치하고 1㎍/㎖의 LPS를 18시간 동안 처치하여 iNOS 단백질 수준을 western blot을 통해 측정하였다. 측정 결과 무처치 대조군과 비교하여 CYS 300㎍/㎖ 단독 처치는 iNOS 단백질의 발현을 유의하게 증가시키지 않았고, LPS의 단독 처치는 선행 연구와 같이 무처치 대조군과 비교하여 iNOS 단백질의 발현을 13.48±1.99배로 통계적으로 유의하게 증가시켰다. 100㎍/㎖ 의 CYS 전처치는 iNOS 단백질의 발현을 9.39±2.32배로 통계적으로 유의성 있게 감소 시키지 못하였으나, 300㎍/㎖ 의 CYS 전처치는 4.19±3.44배로 유의하게 감소시켰다(Fig. 4).
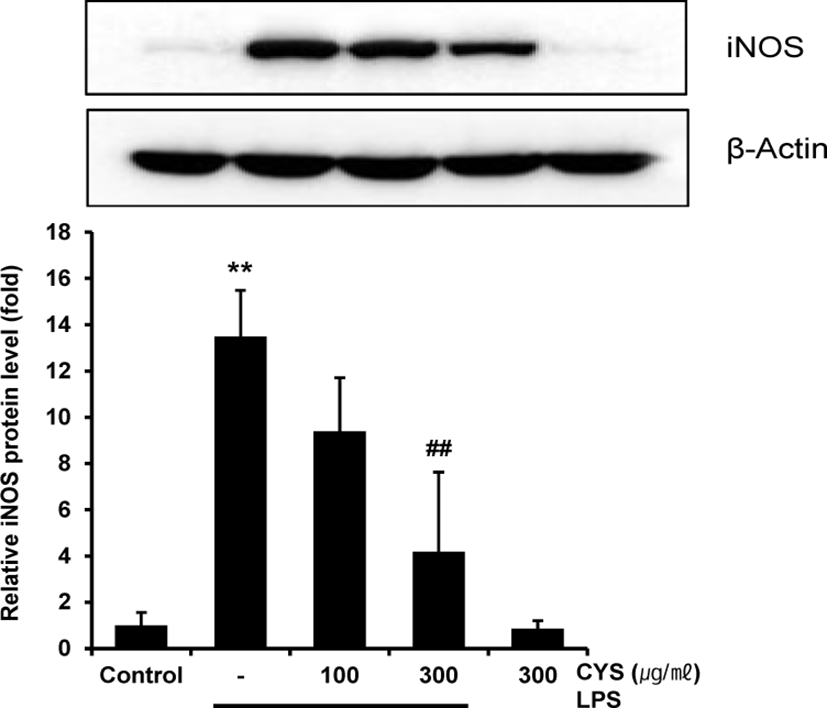
이를 통해 300㎍/㎖의 CYS의 전처치는 LPS에 의한 iNOS 단백질 발현을 억제하여 NO 생성량을 감소시켰음을 확인하였다.
CYS가 Raw 264.7 cell을 LPS로 활성화시켰을 때 분비되는 전 염증성 cytokine인 TNF-α, IL-1β, IL-6의 억제에 미치는 영향을 확인하기 위하여 CYS를 100, 300㎍/㎖의 농도로 1시간 동안 전처치하고 1㎍/㎖의 LPS를 18시간 동안 처치하여 각각의 ELISA kit를 사용하여 TNF-α, IL-1β, IL-6의 생성량을 측정하였다. TNF-α는 LPS에 의해 2353.08±28.42pg/㎖로 무처치 대조군(243.33±19.06pg/㎖) 에 비해 유의성 있게 증가하였으나, CYS 100, 300㎍/㎖의 전처리는 TNF-α 생성량을 각각 1001.67±52.73pg/㎖, 456.92± 23.07pg/㎖로 LPS 단독 처치군에 비하여 유의성 있게 감소시켰다(Fig. 5A). IL-1β는 LPS를 단독으로 처리 시 633.73±45.40pg/㎖로, 무처치 대조군(12.98±0.42 pg/㎖) 에 비해 유의성 있게 증가하였다. 반면 CYS 100, 300㎍/㎖ 의 전처치는 각각 169.12±15.70pg/㎖, 142.75±21.02pg/㎖로, LPS 단독 처치군에 비해 유의하게 감소하였다(Fig. 5B). IL-6는 LPS에 의해 1990.68±10.07pg/㎖로 무처치 대조군(0.70± 1.21pg/㎖) 에 비하여 유의하게 증가하였다. 반면 CYS 100, 300㎍/㎖ 전처치 후 LPS로 처리하였을 때 IL-6 생성량은 각각 1499.30±34.36pg/㎖, 652.65± 13.42pg/㎖로, LPS 단독 처치와 비교하여 통계적으로 유의하게 감소하였다(Fig. 5C).
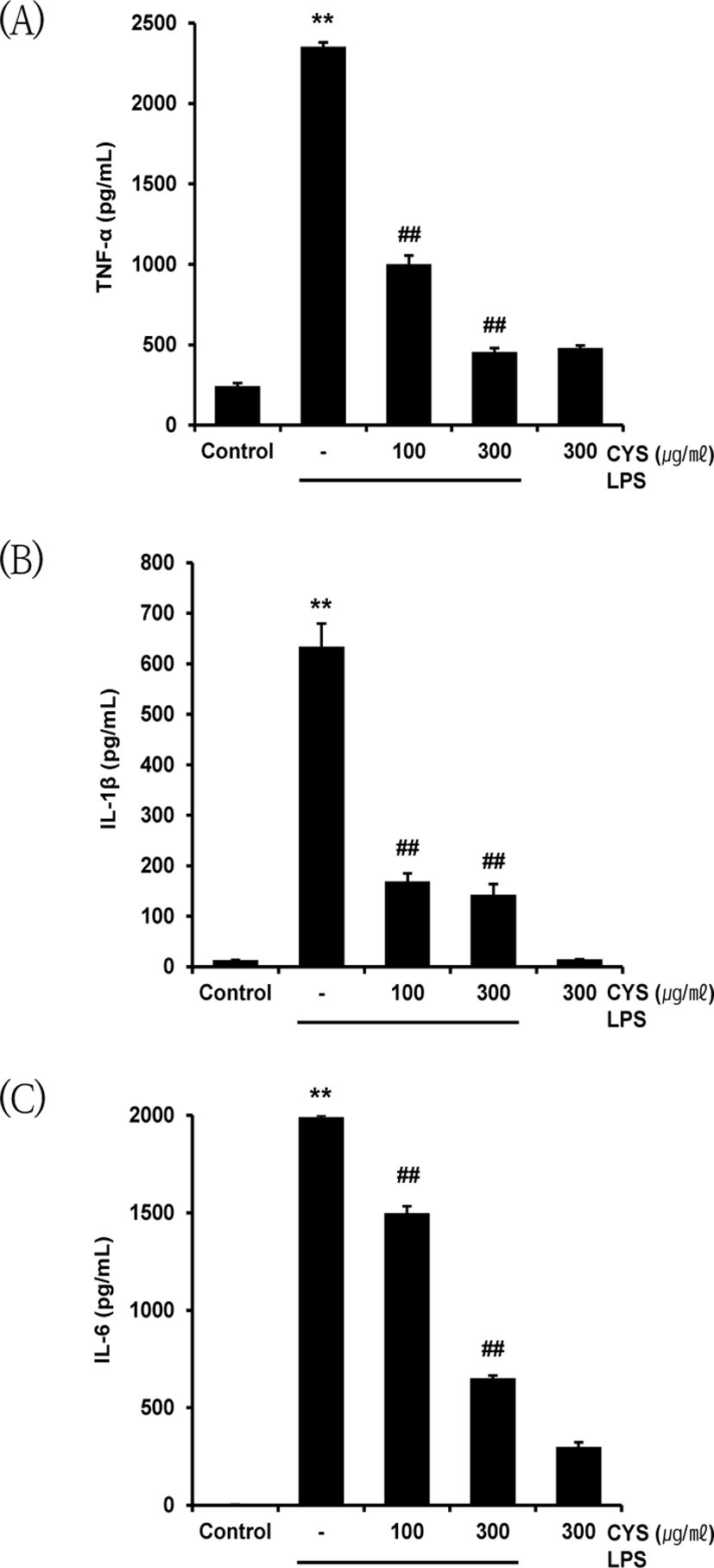
이를 통해 Raw 264.7 cell에서 CYS의 단독 처치는 TNF-α, IL-1β, IL-6와 같은 전 염증성 cytokine 생성에 영향을 미치지 않으며, CYS의 처치는 LPS로 유발되는 cytokine 생성을 용량의존적으로 억제할 수 있음을 확인하였다.
NF-κB 회로는 세포질 내 NF-κB 억제 단백질인 IκBα가 인산화됨에 따라, NF-κB가 IκBα로부터 분리되어 세포핵 내로 이동하면서 활성화된다8,9). 따라서 CYS의 염증 억제가 NF-κB 신호 회로의 조절에 의한 것인지 확인하기 위하여, CYS를 100, 300㎍/㎖의 농도로 1시간 동안 전처치하고 1㎍/㎖의 LPS를 30분 동안 처치한 후 세포질에서의 IκBα의 수준을 측정하였고, LPS를 1시간 동안 처치한 후 IκBα의 인산화 된 형태인 p-IκBα 및 세포핵 내에서의 NF-κB 단백질 발현 수준을 western blot으로 측정하였다. 측정 결과, IκBα 단백질 생성량은 CYS를 100㎍/㎖ 로 전처치하였을 때 LPS 단독 처치(0.52±0.01배)와 비교하여 0.58±0.05배로 유의한 결과를 나타내지 않았다. 반면 CYS를 300㎍/㎖ 로 전처치 후 LPS로 활성화하였을 때 LPS 단독 처치군(0.52±0.01배)에 비해 0.73±0.03배로 통계적으로 유의하게 증가하였다(Fig. 6A, B). p-IκBα 의 발현은 LPS에 의해 유의하게 증가하였으며, CYS 100㎍/㎖의 전처치는 LPS로 증가된(9.39±0.64배) p-IκBα의 발현 수준을 4.12±1.86배로 유의한 결과를 나타내지 않았다. 반면 CYS를 300㎍/㎖으로 전처치하였을 때, p-IκBα의 발현 수준은 LPS 단독 처치군(9.39±0.64배)에 비해 5.23±0.45배로 유의하게 감소하였다(Fig 6A, C). 또한 NF-κB 단백질은 LPS 단독 처치 시 무처치 대조군에 비하여 2.09±0.16배로 유의하게 증가하였으나, CYS 100, 300㎍/㎖의 전처치 후 LPS 처치 시 LPS 단독 처치군에 비해 각각 1.09±0.15배, 1.08±0.10배 유의하게 감소하였다(Fig. 6D, E).
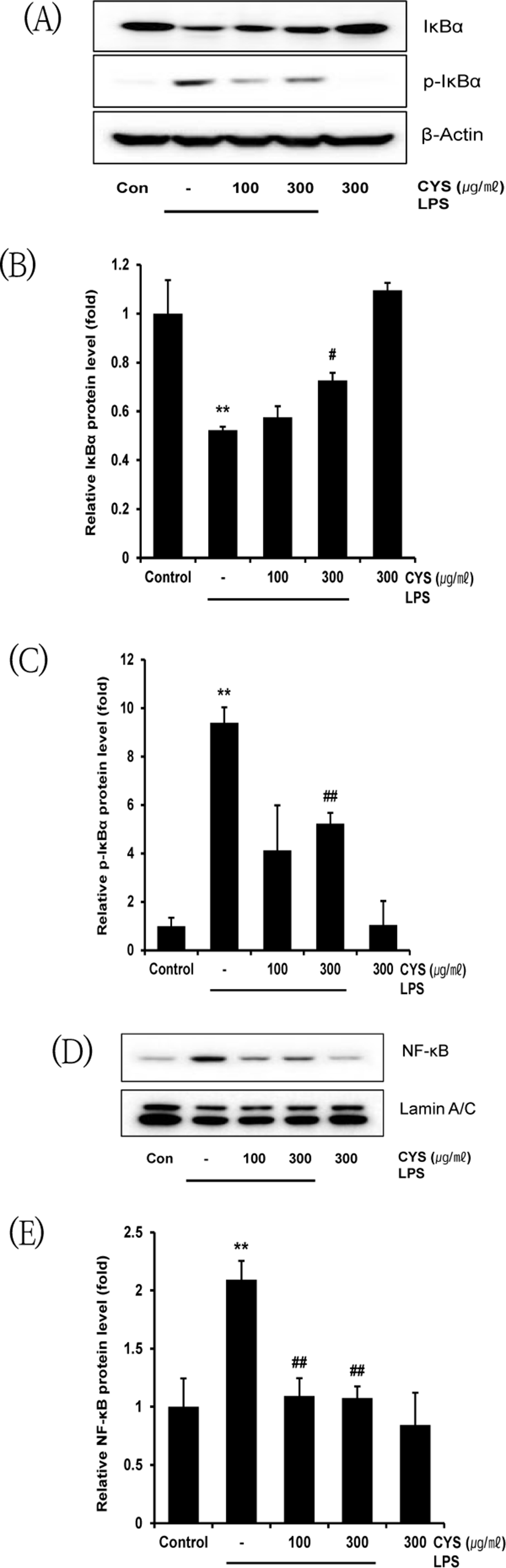
이를 통해 CYS는 세포질에서 IκBα의 인산화를 억제함으로써 NF-κB의 세포핵 내로의 유입을 감소시켜 염증반응을 억제함을 확인하였다.
매일 1회 3일간 CYS 0.3g/㎏, 1.0g/㎏ 또는 dexamethasone(DEXA) 1㎎/㎏를 경구 투여한 후, 1% carrageenan(CA) 100㎕/rat를 rat의 우측 뒷다리 발바닥에 피하 주사하여 CYS의 족부종 억제 효과를 확인하였다. 무처치 대조군에 비해 CA 처치군에서는 CA 주입 후 1, 2, 3, 4시간에 부종 측정값이 각 1.17±0.04, 1.36±0.03, 1.39±0.09, 1.29±0.07배로 증가하여 유의한 족부종이 유발되었으며, DEXA 투여 후 CA를 처치한 군에서는 1, 2, 3, 4시간에서 1.08±0.05, 1.12±0.07, 1.15±0.05, 1.11±0.05배로 유의한 족부종 억제를 나타내었다. CYS 0.3g/㎏ 투여 후 CA를 처치한 군에서는 1, 2, 3, 4시간에 각 1.07±0.03, 1.17±0.02, 1.24±0.03, 1.19± 0.03배로 유의한 족부종 억제를 나타내었으며, CYS 1.0g/㎏ 투여 후 CA를 처치한 군에서는 1, 2, 3, 4시간에서 1.02±0.01, 1.09±0.01, 1.17±0.03, 1.09± 0.04배로 유의성 있는 족부종 억제를 나타내었다(Fig. 7).
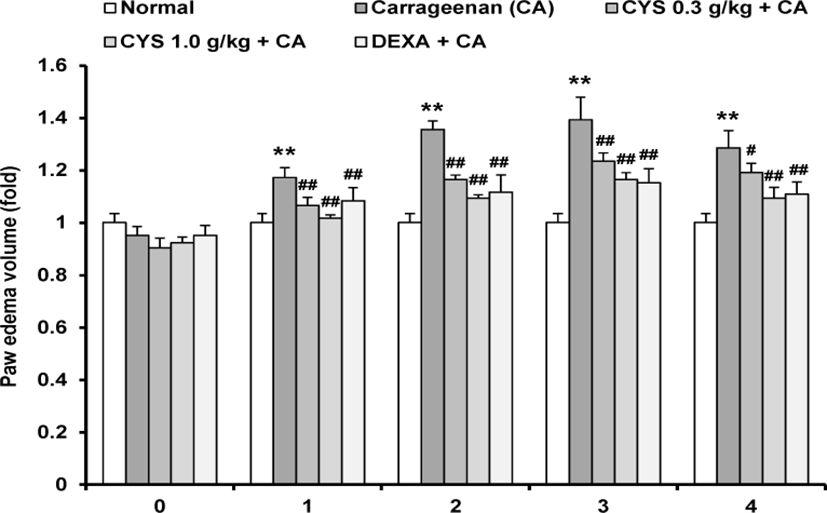
이를 통해 CYS가 CA로 유도된 급성 염증성 부종을 용량의존적으로 억제함을 확인하였다.
Ⅳ. 고 찰
淸心凉膈散은 咽喉의 급성 염증성 질환에 대한 활용도가 높은 처방으로 각 구성 약물에 대한 항염증 효과는 곡 등10), 이 등11), 윤 등12), 정 등13), 차 등14), 유 등15)에 의해 연구된 바 있으나, 복합제제인 淸心凉膈散에 대한 항염증 효과는 연구된 바 없다. 이에 淸心凉膈散의 염증 억제 효과의 근거를 제시하기 위해 in vitro 및 in vivo에서 그 효과 및 기전을 규명하고자 하였다.
Raw 264.7 cell은 mouse의 대식세포주로. 대식세포는 대부분의 조직에서 상주하며 포식작용을 하고, 염증매개물질을 분비하며, T 림프구를 활성화시킬 수 있는 항원전달세포로서 역할을 수행한다16).
한편 대식세포, 수지상세포 등의 면역반응을 유도하는 세균, 진균, 기생충, 바이러스 입자 등의 표면에 존재하는 분자를 pathogen-associated molecular patterns(PAMPs)라 하며, 이를 인식하여 면역과 관련한 유전자의 발현을 촉진하는 신호전달경로를 활성화시키는 수용체를 pattern recognition receptors(PRRs)라 한다17,18). Toll 유사 수용체(TLR)는 가장 먼저 발견된 PRR로, 인간과 mouse에서 여러 개의 TLR과 이들의 PAMP ligand가 확인되었다. 그 중 TLR4는 그람 음성 세균, 호흡기세포융합바이러스, 곰팡이 등의 미생물 ligand를, TLR6는 결핵균, 그람 양성 세균, 효모, 곰팡이 등의 ligand를 인지하여 면역반응을 일으킨다. TLR이 PAMP ligand와 결합하면 이합체화가 일어나는데, TLR1, 2, 6은 TLR2/1, TLR2/6으로 이종이합체를 이루고 그 외의 TLR은 동종이합체로서 기능을 하게 된다17,19).
본 연구에서 염증반응을 유도하기 위해 사용한 LPS는 그람 음성 세균의 세포벽 구성성분으로, TLR4/4와 결합하여 NF-κB회로의 활성 등을 포함한 세포 내 신호 전달체계를 개시하며, 이는 궁극적으로 IL-1, IL-6, IL-8, TNF-α 등을 포함한 전염증성 인자의 합성과 방출을 유도한다5). 또 PGN은 펩티드 다당류로 이루어져 그람 음성 및 그람 양성 세균의 세포벽 구성성분 중 하나이며, TLR2/6와 결합하여 세포 내 신호 회로를 활성화시킨다6).
이러한 미생물 성분들이 TLR과 같은 PRR에 결합하면 inducible nitric oxide synthase(iNOS) 등의 전사가 활성화된다. iNOS는 L-arginine을 산화시켜 L-citrulin과 nitric oxide(NO)를 생성하며 산화과정을 거쳐 reactive nitrogen species(RNS)의 발생을 유도한다. RNS는 산화독성을 유발하여 포획된 미생물에 대하여 세포 내 구성성분들에 손상을 유발한다20).
본 연구에서는 CYS가 항염증 효과를 가지는지 여부를 확인하기 위해 NO 생성량과 세포생존율 관찰을 통한 세포 독성을 관찰하였다. 그 결과 CYS 자체의 유의한 세포 독성은 나타나지 않았으며, CYS 전처리 후 LPS로 염증반응을 활성화하였을 때 CYS 30-300㎍/㎖의 농도에서 모두 NO 생성량이 감소함을 확인하였다. 세포생존율 또한 LPS를 단독으로 처치한 군과 비교하여 CYS가 30-300㎍/㎖의 농도에서 LPS로 인한 세포생존율 감소를 유의미하게 억제하였으므로, CYS의 처리가 LPS로 인한 NO 생성을 억제함으로써 세포 독성을 방어하는 효능이 있음을 확인하였다. 또한 추후 실험은 p<0.01로 유의미한 결과를 나타낸 100, 300㎍/㎖의 농도에서 염증 매개 인자들을 확인하였다.
또한 CYS가 TLR4/4 ligand인 LPS 자극 이외에도 다른 TLR 자극에 의한 항염증 효과의 유무를 확인하기 위하여, TLR2/6 ligand인 PGN 자극에 의한 NO 생성량 및 세포생존율을 CYS 300㎍/㎖에서 측정하였다. 그 결과 CYS는 LPS 처치와 마찬가지로, PGN으로 인한 세포생존율의 감소를 억제하였고, 이는 NO 생성량 감소에 기인한 것임을 확인하여, CYS가 그람 음성균 뿐 아니라 그람 양성균, 효모 등으로 인한 다양한 염증에 대하여 항염증 효과가 있음을 규명하였다.
CYS의 전처리에 의한 NO의 생성량 감소가 iNOS에 기인한 것임을 확인하기 위해, iNOS 단백질의 발현 수준을 확인하였다. 그 결과 CYS 300㎍/㎖을 전처치하였을 때 유의한 iNOS의 감소를 확인하여, CYS가 iNOS 단백질 발현을 억제함으로써 NO의 생성을 감소시킴을 확인하였다.
자극으로 인한 PRR의 활성화는 전 염증성 cytokine의 발현을 유도하여 국소적으로 혈관의 투과성을 높이고, 면역 세포들을 감염 부위로 유도하고 활성화시킨다19). 본 연구에서는 IL-1β, IL-6, TNF-α수준을 측정하여 CYS의 세포 내 신호분자의 제어를 통한 염증 억제 효과 여부를 확인하였다. 그 결과 CYS 100, 300㎍/㎖의 전처리는 LPS로 유발되는 IL-1β, IL-6, TNF-α 생성을 용량의존적으로 억제할 수 있음을 확인하였다.
한편 TLR과 PAMP의 결합은 MyD88-의존적 신호전달이라는 일련의 경로를 활성화시킨다. TLR이 해당 ligand와 결합되면 MyD88을 통해 TAK1을 활성화시키고, TAK1은 NF-κB와 결합되어 있는 IκB 인산화(IKK)복합체를 인산화시킨다. 인산화된 IKK복합체에서 NF-κB가 유리되고, 유리된 NF-κB가 핵으로 이동하여 전사를 유도함에 따라 염증 매개인자가 발현된다. 또한 TAK1은 IKK복합체로부터 분리된 이후 MAPK 경로를 활성화시켜, AP-1의 이합체를 구성하는 Fos 및 Jun의 전사를 유도한다7,8,19).
본 실험에서는 CYS가 IKK복합체의 인산화를 억제함으로써 NF-κB의 전사를 조절하는지 확인하고자 하였다. 300㎍/㎖으로 CYS를 전처치한 후 LPS로 활성화하였을 때, LPS 단독 처치군에 비하여 IKK복합체를 구성하는 IκBα 단백질 생성량이 유의하게 증가하였고, p-IκBα는 CYS 100, 300㎍/㎖ 농도에서 유의하게 감소하였다. 세포핵 내의 NF-κB는 CYS의 300㎍/㎖ 처리 시 유의하게 감소하여, CYS는 IκBα의 인산화를 억제함으로써 NF-κB의 전사와 염증 매개인자의 발현을 억제함을 규명하였다.
In vivo에서는 carrageenan(CA)으로 rat의 족부종을 유도하여 급성 염증의 억제 효과를 확인하였다. CA는 홍조류에서 추출한 다당류로, 동물 모델에서 항염증 물질의 평가에 있어 염증 유발 물질 및 발암 물질로 사용 된다21,22). 이를 rat의 연부조직으로써 염증 반응 여부를 확인하기 용이한 족부에 주입하여 부종 정도를 측정함으로써, CYS의 생체 내에서의 항염증 효과를 평가하고자 하였다.
실험 결과, CA만을 단독 처리한 군에서는 무처치 대조군에 비해 CA처리 후 1, 2, 3, 4시간에 유의한 족부종이 유발되었으며, CYS 0.3 및 1.0g/㎏ 투여 후 CA를 처치한 군에서는 1, 2, 3, 4시간에서 용량의존적으로 유의성 있게 족부종을 억제하여, CYS가 rat 수준에서 염증성 부종을 억제함을 확인하였다.
따라서 본 연구는 급성 인후부의 염증을 치료하는 淸心凉膈散(CYS)에 대한 대식세포 수준에서 항염증 효과 및 기전을 규명하고 동물 모델에서 급성 염증성 부종의 억제 효과를 확인하여 CYS의 임상적 활용 기반을 제공하였다는 점에서 의의가 있다. 하지만 NF-κB 경로 외에도 위에서 언급한 MAPK 경로 등과 같이 염증 매개 인자의 생성과 억제에 관여하는 기타 경로가 존재하므로, CYS가 핵심적으로 관여하는 염증 억제 기전을 규명하기 위해서는 추가적인 연구가 필요하며, 동물 모델에서의 염증 억제 효과가 세포 수준에서와 같이 NF-κB 경로를 경유하는가에 대한 후속 연구가 필요할 것으로 사료된다.
Ⅴ. 결 론
본 연구에서는 in vitro에서 LPS로 Raw 264.7 cell에 염증반응을 유도하여 CYS의 항염증 기전을 연구하였으며, in vivo에서 CA로 rat의 급성 부종성 염증을 유도하여 염증 억제 여부를 확인하여 다음과 같은 결과를 도출하였다.
-
CYS는 단독으로 사용되었을 때, 세포 독성을 유발하지 않는다.
-
CYS는 LPS에 의한 NO의 생성과 세포 독성을 억제하였으며, NO 생성에 관여하는 iNOS 발현을 통계적으로 유의하게 억제하였다.
-
CYS는 TLR4/4 ligand인 LPS 뿐 아니라 TLR2/6 ligand인 PGN에 의한 NO 및 세포 독성을 억제하였다.
-
CYS는 LPS에 의하여 증가한 TNF-α, IL-1β, IL-6의 생성을 억제하였다.
-
CYS는 LPS에 의하여 증가한 IκBα의 인산화를 억제하여 NF-κB 회로의 활성화를 억제하였다.
-
CYS는 Carrageenan으로 유도된 rat의 족부종을 유의하게 억제하였다.






