Ⅰ. 서 론
최근 산업화가 심화되면서 주거환경 및 식생활의 변화, 유전적 영향, 환경오염 등에 의해 발생되는 화학적, 생물학적 유해인자들의 노출로 다양한 연령층에서 면역조직 이상으로 유발된 염증 반응 및 아토피 질환과 같은 피부 염증성 질환의 발생이 크게 증가하고 있다1). 또한 산업화에 따른 현대 사회의 급격한 경제 성장으로 인해 현대인들의 삶의 질이 상승되고 건강과 미에 대한 욕구 및 노화에 대한 관심이 점차 늘어나면서 천연 자원이나 한약 추출물을 이용한 항산화 및 항염 작용에 관한 연구가 활발하게 이루어지고 있는 추세이다2).
현대 사회에서 급증하고 있는 만성 염증성 질환 및 생활습관병 등은 생체의 대사 과정 중 산화 반응에서 발생한 활성산소류(reactive oxygen species, ROS)에 의한다고 볼 수 있다3). 활성산소는 생체 내의 물질과 반응하여 산화적 스트레스를 유발하고 이러한 산화적 스트레스는 인체 내 다양한 조직 세포를 손상시켜 노화와 고혈압, 당뇨병, 동맥경화, 비만, 암, 아토피성 피부염 등 여러 만성 염증성 질환을 유발시키며4), 이러한 만성 염증성 질환들이 임상에서 차지하는 비율이 증가함에 따라 체내에서 활성산소 소거능을 가진 항산화 물질에 대한 관심이 높아지고 있다.
활성산소의 하나이면서 고농도에서 세포의 기질적 손상을 유발하는 nitric oxide(NO)는 염증 반응 시 inducible NO synthase(iNOS)에 의해 과생성되어 부종, 발열, 조직손상 등의 염증 반응을 촉발한다5). 염증반응은 상처나 감염 등의 외부의 자극에 의한 생체 조직의 1차적 면역 반응 과정 중의 하나로서 발열, 발진, 부종, 통증, 혈관투과성 등을 유발하는 국소적 반응으로3,5), 이러한 염증 과정 중에 iNOS에 의해 발생되는 NO와 cyclooxyfenase-2(COX-2)에 의해 생성되는 prostaglandin E2(PGE2) 등의 염증매개물질들은 대사 과정에서 NO 형성 과정으로 다시 이어지게 된다5,6). 또한 tumor necrosis factor- α (TNF-α), interluekin-1α(IL-1α), interluekin-1β (IL-1β), interluekin-6(IL-6) 등의 염증 매개 cytokine 등은 nuclear transcription factor-kappa B(NF-κB)라는 전사인자에 의해 합성이 조절되며, ROS의 생성을 촉진시킴에 따라 여러 염증성 질환들을 악화시킬 수 있다5,6).
창출금련탕(蒼朮芩連湯, Changchulgeumryeontang, CCGRT)은 《張氏醫通》 卷十五에 수록되어 창출, 황금, 황련, 목향, 지실, 반하, 시호, 승마, 천궁, 후박, 길경, 목통, 감초 등으로 구성되어 있고 “治瘴癘濕熱” 하는 효능으로 염증성 피부 질환에 사용 가능한 처방으로 생각되나, 현재까지 본 처방에 대한 실험적 연구는 보고된 바 없었다. 이에 본 연구에서는 CCGRT가 항염증 및 항산화 작용에 어떠한 효과가 있는지 조사하기 위하여 RAW 264.7 대식세포를 이용하여 세포 독성, NO, PGE2 생성량, iNOS, NF-κB, IL-1α, IL-1β 그리고 IL-6의 발현을 알아보고자 하였다.
Ⅱ. 재료 및 방법
CCGRT을 제조하기 위한 약재는 (주)HMAX(충청북도 제천시)에서 구입하였으며, 용량은 다음과 같다(Table 1).
상기의 한약재들을 3차증류수 2,000㎖와 함께 넣은 뒤 heating mantle을 이용하여 4시간 동안 가열하고 6시간 냉각시켜 CCGRT를 제조하였다. 추출물을 얻은 후 거즈로 1차 여과 한 후 여과지로 2차 여과를 진행하였다. 여과를 마친 후 여과액을 감압 농축하여 100㎖ 농축액을 얻었다. 농축액을 −80℃ 냉동고에 얼린 후 동결건조 한 뒤 분말을 얻어 시료로 사용하였다. 동결건조 추출물은 43g을 얻었고 수율은 약 20%이다.
본 연구에서 RAW 264.7 대식세포는 Amerian Type Culture Collection (ATCC)에서 분양 받아 실험에 사용하였다. 배양 시 배지는 10% fetal bovine serum (FBS; GenDEPOT, USA)와 1% penicillin/streptomycin (GenDEPOT, USA)이 첨가된 Dulbecco’s modified eagle’s medium (DMEM; GenDEPOT, USA)을 사용하였으며, 37℃, 5% CO2 incubator (MCO-17AIC, SANYO, Japan)에 서 배양하였다.
CCGRT의 세포독성을 검사하기 위해 3-(4,5-dimethylthiazol-2-yl)2,5-diphenyltetrazolium bromide (MTT; Bio basic, Canada) assay를 시행하였다. RAW 264.7 대식세포를 96 well plate에 5×104 cell/well의 세포수가 되도록 분주하고, 24시간 동안 37℃, 5% CO2 incubator에서 배양하였다. 그 후 CCGRT의 농도가 25, 50, 100 및 200㎍/㎖이 되도록 처리하였다. 24시간 동안 37℃, 5% CO2 incubator에서 배양 후, MTT용액 (4㎎/㎖)을 20㎕ 가한 뒤 4시간 동안 반응시켰다. 그 후 상층액을 제거하고 DMSO 100㎕를 첨가하여 용해시킨 후 MTT 환원에 의해 생성된 formazan을 ELISA microplate reader (SoftMax Pro5; Molecular Devices, Sunnyvale, California, USA)를 이용하여 570㎚에서 흡광도를 측정하였다. 세포생존율은 다음의 산출식에 따라 %로 나타내었다.
NO의 생성량은 염증 유도 물질인 lipopolysaccharide (LPS, Sigma, USA)와 CCGRT를 농도별로 처리하여 RAW 264.7 대식세포 배양액 중에 존재하는 NO의 양을 Griess reagent (Sigma, USA)을 사용하여 측정하였다. RAW 264.7 대식세포를 96 well plate에 5×104 cells/well의 세포수가 되도록 분주하고, 24시간 동안 37℃, 5% CO2 incubator에서 배양하였다. 그 후 CCGRT를 25, 50, 100 및 200㎍/㎖와 LPS (1㎍/㎖)을 동시에 처리하여 24시간 동안 배양하였다. 그 다음 세포의 배양액을 100㎕를 다른 96 well plate에 옮겨 준 후, Griess reagent를 100㎕ 처리하였다. 실온에서 10분 동안 방치한 후, ELISA microplate를 이용하여 540㎚에서 흡광도를 측정하였다.
LPS로 염증이 유도된 RAW 264.7 macrophage cells를 사용하여 PGE2의 생성을 PGE2 ELISA kit (abcam, UK)을 사용하여 측정하였다. 6 well plate에 RAW 264.7 대식세포를 5 x 105 cells/well로 분주 한 뒤 24시간 동안 37 ℃, 5% CO2 incubator에 안정화 시켰다. 24시간 뒤 CCGRT 농도 25, 50, 100 및 200㎍/㎖가 되도록 LPS (1㎍/㎖)와 동시에 처리하고 배양하였다. 배양 후 상층액을 13,000rpm에서 15분 원심 분리하여 PGE2 정량에 사용하였다. Goat anti-mouse IgG가 코팅되어있는 96 well plate에 상층액을 농도 별로 각 well에 첨가하였다. PGE2 alkaline phosphate conjugate를 50㎕첨가 한 뒤 PGE2 antibody를 50㎕ 첨가하여 실온에서 2시간 동안 반응시켰다. 반응 후 1 x wash buffer를 사용하여 2 − 3회 세척한 뒤 PnPP substrate를 200㎕ 첨가 하고 실온에서 45분 배양한 후 450㎚에서 흡광도를 측정하였다.
RAW 264.7 대식세포에서의 CCGRT가 갖는 iNOS, NF-κB, IL-1α, IL-1β 그리고 IL-6 발현 억제 효과를 확인하기 위해 realtime PCR 분석을 진행하였다. 6 well plate에 5 x 105 cells/well로 분주 한 뒤 24시간 동안 37℃, 5% CO2 incubator에서 안정화시켰다. 24시간 뒤 CCGRT 최종 농도가 25, 50, 100 및 200㎍/㎖가 되도록 LPS (1㎍/㎖)와 동시에 처리하고 배양하였다. 24시간 뒤 Trizol reagent (Ambion, USA)를 사용하여 RNA를 추출하였다. 추출된 RNA는 diethyl pyrocarbonate (DEPC treated-water; Sigma, USA)로 용해하여 사용하였고, cDNA 합성 kit (Revetra ACE-α-; Toyobo, Japan)를 통해 total RNA (2㎍)으로 cDNA를 합성하여 사용하였다. cDNA 합성 후 유전자들의 상대적인 양은 Tagman master mix (Thermo fisher, USA) 10㎕, 멸균수 4㎕, primer 1㎕, cDNA 5㎕를 혼합하여 iNOS, NF-κB, IL-1α, IL-1β, IL-6를 실시간으로 유전자별 mRNA분석에 사용하였다. 실험에 사용된 probe들은 Table 2에 나타냈다.
Ⅲ. 결 과
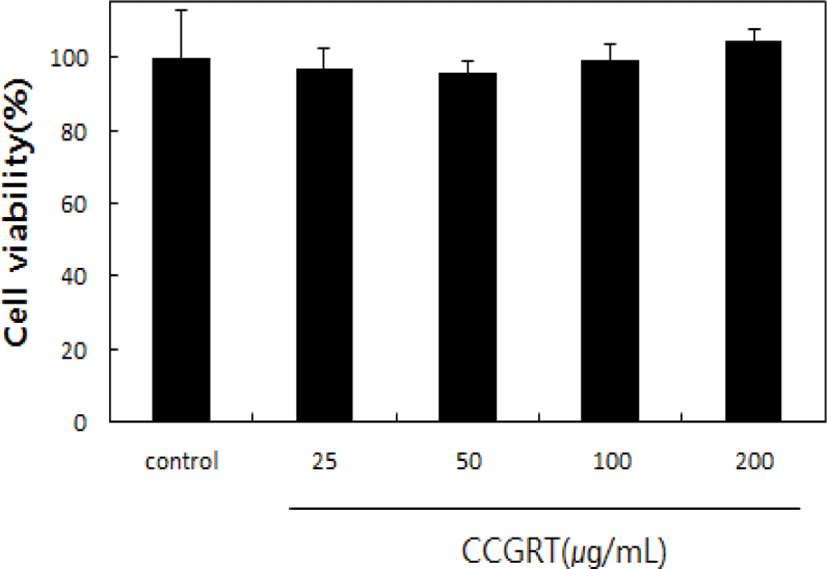
CCGRT를 각각 25, 50, 100 및 200㎍/㎖의 농도로 배양한 RAW 264.7 대식세포의 생존율을 관찰한 결과, control군에 비해서 96.86 ± 5.62%, 95.56 ± 3.42%, 99.15 ± 4.62% 및 104.4 ± 3.45%로 나타났다. 이러한 결과, CCGRT는 25, 50, 100 및 200㎍/㎖농도 범위에서 RAW 264.7 대식세포에서 통계학적으로 유의하게 독성이 없음을 확인하였다(p>0.05)(Fig. 1).
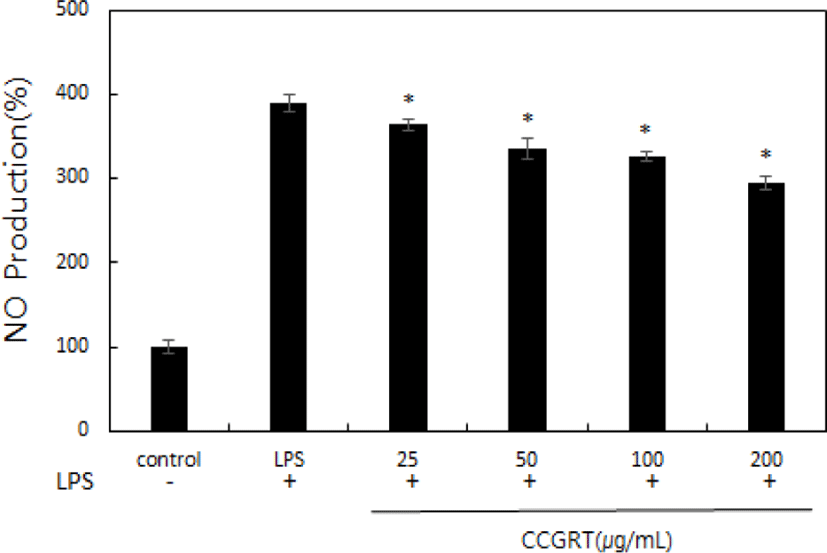
RAW 264.7 대식세포에서의 NO 생성에 대한 CCGRT의 저해효과를 측정하였다. LPS 단독 처리한 군의 NO 생성율은 389.71 ± 9.35%로 증가하였다. 한편 LPS와 CCGRT를 25, 50, 100 및 200㎍/㎖의 농도로 처리한 군에서는 364.27 ± 6.75%, 335.31 ± 13.2%, 326.6 ± 5.65% 및 294.69 ± 7%로 나타나 LPS 처리군에 비하여 농도 의존적으로 감소하였 다(Fig. 2).
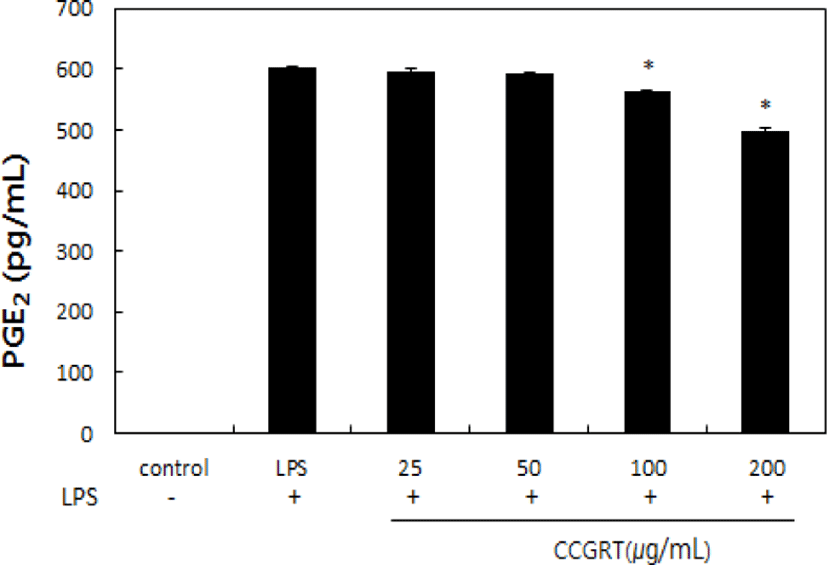
CCGRT의 NO 생성 저해능을 확인하고 또 다른 염증 유발 매개체인 PGE2의 생성 억제 효능을 평가하였다. LPS로 염증이 유도된 RAW 264.7 대식세포에서 PGE2의 생합성이 증가함을 확인하였다. LPS 처리 군에서 PGE2의 농도는 602.22 ± 2.907pg/㎖로 증가하였다. 또한 CCGRT (25, 50, 100 및 200㎍/㎖) 처리군에서 PGE2 농도는 594.5 ± 5.34, 592.78 ± 2.12, 564.78 ± 0.39 및 498.78 ± 4.64pg/㎖으로 나타나 CCGRT는 LPS로 유도된 PGE2의 생성이 농도 의존적으로 억제됨을 볼 수 있었다(Fig. 3
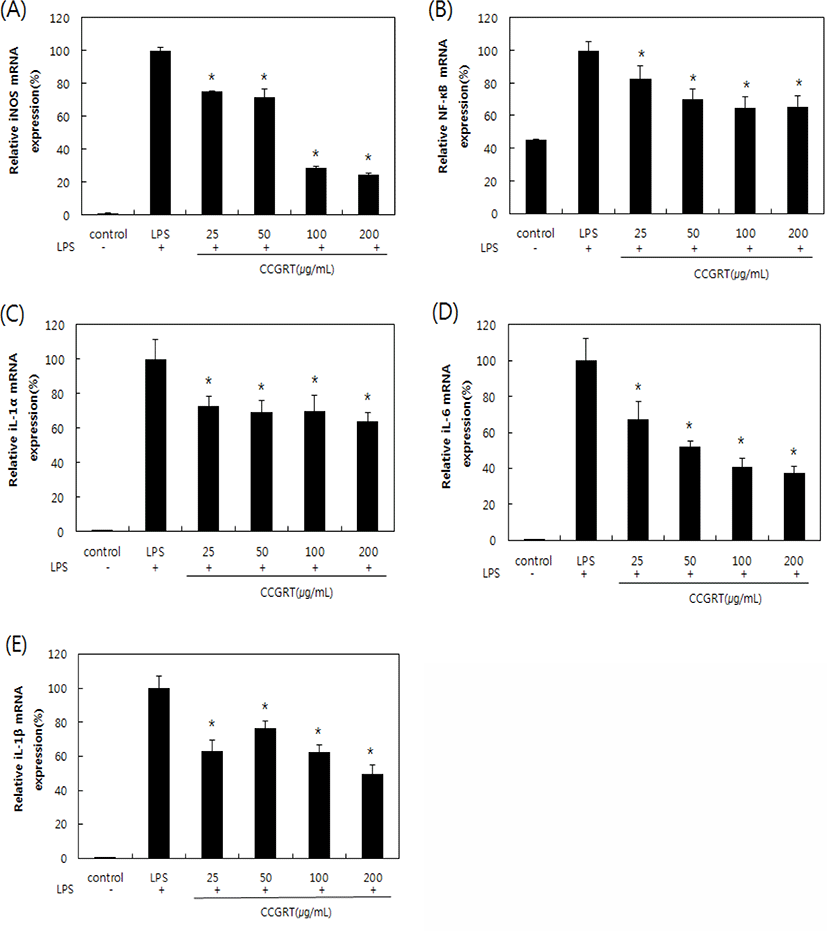
CCGRT가 LPS로 유도된 RAW264.7 대식세포에 서 갖는 iNOS, NF-κB, IL-1α, IL-1β 그리고 IL-6의 mRNA발현 효과를 분석하였다. INOS, NF-κB, IL-1α, IL-1β and IL-6의 발현은 LPS 처리 군과 비교하였을 때 농도 의존적으로 감소하는 것을 확인하였다. 따라서 CCGRT는 염증매개물질 발현 저해를 통한 항염증 효능이 있음을 나타냈다(Fig. 4).
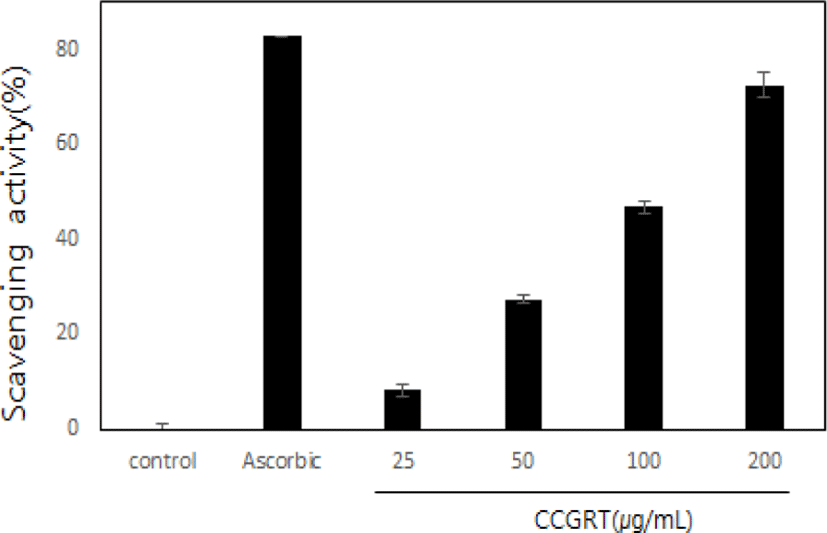
CCGRT의 의한 free radical 소거능을 통하여 항산화 효과를 알아보기 위하여 DPPH assay를 수행하였다. 또한 CCGRT를 25, 50, 100 및 200㎍/㎖의 농도 범위로 처리한 군에서는 DPPH free radical 소거능이 8.156 ± 0.14%, 27.33 ± 1.01%, 46.853 ± 1.35% 및 72.532 ± 2.69%로 나타났다. 이러한 결과 CCGRT의 농도 의존적인 free radical 소거능을 확인 할 수 있었다(Fig. 5).
Ⅳ. 고 찰
피부 염증반응은 생체조직에 물리작용이나 화학 물질, 세균 감염 등 어떠한 기질적 변화가 가해질 때, 이에 대해 방어할 수 있도록 다양한 작용 기전이 빠르게 활성화되는 숙주의 방어작용이다. 이러한 반응은 대식세포 (macrophage)에서 유도되는 면역반응에서 가장 중요한 반응으로 알려져 있다8). 염증 반응에서 중요한 역할을 하는 nuclear transcription factor-kappa B(NF-κB)는 다양한 사이토카인 합성을 조절하는 전사 인자이다9). NF-κB는 핵 안으로 들어가 전사인자로서 작용하여 interleukin-6 (IL-6), interleukin-1α (IL-1α), interleukin-1β (IL-1β) 등 염증관련 cytokine을 합성하고10,11), nitric oxide (NO), prostaglandin E2 (PGE2)와 같은 다양한 염증성 매개물질들이 생성한다.
구체적으로 살펴보면, NO는 체내 방어 기능, 신호전달기능, 신경독성, 혈관확장 등의 다양한 생리기능을 가지고 있으며, 3종류 NOS인 neuronal nitric oxide synthase (nNOS), endothelial nitric oxide synthase (eNOS), inducible nitric oxide synthase (iNOS)에 의해 합성 되고, 이들 NOS 중 iNOS에 의한 NO 생성이 절대적으로 많으며 이는 병리적으로 중요한 작용을 한다12). INOS는 외부 자극을 받으면 대식세포 등 다양한 세포에서 발현되어 다량의 NO을 생산한다고 보고되고 있다13). PGE2는 혈관의 확장과 혈관 벽의 투과성을 높이고 염증부위로 면역세포들이 모이게 할 뿐만 아니라 IL-6와 같은 염증성 사이토카인의 분비를 촉진시킨다14).
생화학적 산화 반응은 생체 내에서 필요한 에너지 공급을 위해 끊임없이 일어나며 이 과정에서 항상 발생하는 활성산소를 생성하는데15), 활성산소는 정상적인 대사과정에서도 소량씩 생성되며 세포 기능 유지에 필요한 물질이지만 환경오염이나 화학물질에 대한 노출, 스트레스, 비만 등에 의하여 생성량이 증가하거나 제거시스템의 기능이 약화되는 경우 활성산소가 세포 구성성분과 강하게 반응하여 세포와 조직에 손상을 가한다16). 또한 활성산소에 의한 세포 외 조직의 지속적인 손상은 DNA 변성17), 단백질 분해18), 이온 수송계 손상19), 암20), 노화21) 등을 초래하게 되며, 활성산소는 NF-κB를 활성화시켜 여러 조직에서 iNOS, IL-1 그리고 IL-6 등의 염증 촉진물질들을 증가하게 한다22,23).
이러한 과정에 의해 다양한 만성 염증성 질환이 유발되는데, 현대 사회의 서구화로 인해 아토피성 피부염, 암, 당뇨병, 비만 등 다양한 만성 염증성 질환이 증가하고 있고 급격한 경제 성장으로 인한 삶의 질 향상 및 미에 대한 욕구와 웰빙(well-being) 문화가 확산되고 있는 추세에 따라 노화 방지와 활성산소 소거능이 있는 항산화 물질 및 항염 작용을 갖는 생리활성물질 등을 천연물이나 한약재에서 찾는 연구가 활발하게 이루어지고 있다2-6).
본 연구에서 사용된 창출금련탕(蒼朮芩連湯)은 한의학 고서인 《張氏醫通》에 수록되어 있는 처방 중에 하나로 약재는 창출(蒼朮), 황금(黃芩), 황련(黃蓮), 목향(木香), 지실(枳實), 반하(半夏), 시호(柴胡), 승마(升麻), 후박(厚朴), 길경(桔梗), 목통(木通), 감초(甘草), 천궁(川芎) 으로 구성되어 있으며, “治瘴癘濕熱”이라 하여 체내에 濕熱과 같은 山嵐瘴氣 및 外邪 등이 피부 사이에 침투함으로 인해 염증 질환 발생 시 정기를 보존하고 邪氣를 몰아내어 소염시키는 작용을 가진다7).
구성 약재 중에서 군약으로 사용되는 창출은 박 등24)에 의해 소염 및 항산화 활성 작용을 갖는 것으로 연구되었으며, 황금은 윤 등25)이 LPS로 유도된 대식세포의 cytokine과 염증 인자 생성을 유의하게 억제함을 보고하였고, 황련은 이 등26)이 항염 효과를, 김 등27)이 항산화 활성 효과를 보고한 바 있다. 또한 목향은 항염, 항균작용 및 iNOS 생성 억제 등으로 항산화 효능이 있음이 보고되었으며28), 길경은 김 등29)의 연구에 의해 부종 억제를 통한 급성 염증에 항염 효과가 있음이 밝혀졌고, 감초 또한 박 등30)의 연구에서 NO생성에 영향을 미쳐 항염증 효과가 있다고 보고된 바 있다. 이외에도 지실은 항균 및 항산화 효과31,32), 반하는 cytokine을 억제하는 항염 효과33), 시호는 염증성 대장염에 대한 치료 효과 등34)이 보고되었고, 승마는 항알레르기 효과35), 후박은 항산화 및 항암 효과36), 목통은 항산화 및 항균 활성 효과37), 천궁은 항산화 및 항당뇨 활성 효과 등38)을 가지는 것으로 연구된 바 있다.
이를 통해 창출금련탕은 군약인 창출을 비롯해 항염, 항균, 항산화 작용 등을 가진 여러 약재들로 구성되어 있다고 볼 수 있으나, 현재 이러한 항산화 활성 및 항염증 효과가 있다고 보고되어 온 약재로 구성된 창출금련탕에 대한 항염증 및 항산화 작용과 관련된 연구는 전무한 실정이다.
이에 저자는 CCGRT의 항염증 및 항산화 효과를 알아보기 위해서 세포 생존률에 미치는 영향, 항산화 활성에 미치는 영향, NO생성에 미치는 영향, PGE2 생성, realtime PCR을 통한 iNOS, NF-κB, IL-1α, IL-1β 및 IL-6 mRNA 발현량 등에 대해 실험하였다.
실험에 앞서 CCGRT의 세포독성 평가를 위해 RAW 264.7 대식세포의 생존율을 측정하였다. RAW 264.7 대식세포의 생존율 측정에서 CCGRT 25, 50, 100 및 200㎍/㎖농도 별로 처리한 결과 모두 대조군과 비교하여 세포 생존율에 유의한 차이가 없었다(Fig. 1). 따라서 CCGRT는 200㎍/㎖의 농도까지 RAW 264.7 대식세포에서 통계학적으로 유의한 독성이 없음을 확인하였다(p<0.05).
CCGRT의 항염증 효과를 입증하기 위하여 NO 생성, PGE2 생성에 미치는 효과를 조사하였다. NO 생성 실험결과 LPS를 처리한 군은 대조군에 비해서 유의하게 증가하였고 (p<0.05), CCGRT 200㎍/㎖는 LPS처리 군과 비교하였을 때 약 35% 감소하였다(Fig. 2). PGE2의 생성 또한 CCGRT는 LPS 처리 군에 비해서 약 19% 감소하였다(Fig. 3).
위의 사실을 기초로 하여 NO의 생성 저해 기전을 알아보기 위한 realtime PCR을 수행하였다. INOS, NF-κB, IL-1α, IL-1β 및 IL-6 mRNA발현을 분석한 결과 iNOS 발현억제는 NO의 생성억제와 유사한 경향을 보였으며, NO의 생성억제는 iNOS의 발현저해에 기인하여 나타난 것임을 알 수 있었다. NF-κB, IL-1α, IL-1β 그리고 IL-6의 발현은 또한 농도 의존적으로 감소하는 것을 확인하였다(Fig. 4).
CCGRT의 항산화 효과를 입증하기 위하여, DPPH 소거 활성을 조사하였다. 본 실험에서는 DPPH시약을 사용하여 CCGRT를 25, 50, 100 및 200㎍/㎖ 농도 별로 항산화 효과를 측정한 결과, CCGRT의 농도 의존적으로 높은 활성을 보여 항산화 효과가 뛰어난 것을 확인하였다(Fig. 5).
이상의 결과는 CCGRT가 LPS 유도성 염증 모델에 있어서 항염증 효과가 있었고, 또한 DPPH 소거 활성을 통해 항산화 효과가 있음을 확인하였다. 따라서 CCGRT를 향후 급성 또는 만성 염증성 피부 질환에 활용할 수 있을 것으로 판단되나, 본 연구에서는 CCGRT가 어떠한 기전으로 항염증 및 항산화 효과를 발휘하였는지에 대해서는 밝히지 못하였기에 차후 추가적인 연구가 필요할 것으로 사료된다.
Ⅴ. 결 론
LPS로 유도된 RAW 264.7 대식세포에서의 염증반응에 대한 CCGRT의 항염증 및 항산화 작용을 규명하기 위해 CCGRT의 NO, PGE2 생성조절 및 DPPH free radical 소거능, realtime PCR에 대한 영향을 실험한 결과 다음과 같은 결론을 얻었다.
-
CCGRT는 RAW264.7 대식세포에서 MTT에 의한 세포독성을 관찰한 결과 25-200㎍/㎖에서 세포독성이 없었다.
-
NO, PGE2 생성을 측정한 결과 CCGRT는 LPS에 의해 유도된 RAW 264.7 대식세포에서 NO생성과 PGE2 생성을 농도 의존적으로 감소시켰다.
-
LPS에 의해 유도된 iNOS, NF-κB, IL-1α, IL-1β 그리고 IL-6 mRNA 발현 또한 유의하게 감소 시켰다(p< 0.05).
-
DPPH free radical 소거능을 관찰한 결과 CCGRT의 농도가 높아질수록 높은 항산화 효과가 나타났다.
이상의 실험결과 LPS로 유도된 RAW264.7 대식세포에서 NO, PGE2 iNOS, NF-κB, IL-1α, IL-1β 그리고 IL-6를 억제시킴으로써 항염증 효과를 나타내는 것으로 확인되었으며, 또한 DPPH free radical을 감소시킴으로써 항산화 효과를 내었다.
*이 논문은 세명대학교 석사학위 졸업논문임.






