Ⅰ. 서 론
환경오염은 인체에 호흡기질환, 심장질환 등 각종 질환을 유발시키며 특히 우리 몸의 가장 바깥쪽에서 외부 자극에 대응하고 있는 피부에 악영향을 끼친다1). 오존층의 파괴로 증가한 자외선과 중금속 및 유해물질로 구성된 미세먼지 등은 피부 속 깊이 침투하여 피부노화, 탄력감소 등의 문제를 발생시키거나 기존의 피부질환을 악화시키기도 한다1,2). 이에 자극물질로부터 피부를 보호하기 위한 자외선차단제 등 외용제에 대한 관심이 증가하고 있으며 첨단공법에 의한 제품의 원료나 재료가 인체에 해를 끼칠 수 있다는 것을 인지하게 되면서 천연물 자원을 이용한 제품의 개발이 늘어나고 있다3).
西施玉容散은 피부에 사용되었던 대표적인 외용처방으로 綠豆, 白芨, 白芷 등 14가지의 약재로 구성되어있으며 tyrosinase 저해활성과 Melanin 합성에 관여함으로써 미백효과를 가지는 것으로 밝혀졌다4,5). 또한 『東醫寶鑑』에 “面生一切風刺, 酒刺,粉刺,雀卵,斑䵟,䵳黶子宜玉容西施散”이라6) 하여 피부미용 뿐만 아니라 기미, 여드름 등 피부질환의 치료제로도 활용되었음을 알 수 있다.
최근까지의 연구동향을 살펴보았을 때 西施玉容散의 구성약재인 白芷, 白芨 등의 생리활성 연구는 활발하게 진행되었으나 민간요법 등에서 피부질환이나 열병에 사용되었던 綠豆의 피부에 관한 생리활성 연구가 미흡하여 본 실험의 시료로 선택하게 되었다.
綠豆는 콩과에 속하는 一年生 草本 Phaseolus radiatus L.의 種子로 성질이 차고 無毒하여 丹毒, 煩熱, 風疹 등의 熱氣와 奔豚을 消腫 下氣하는 작용이 있으며7) 綠豆의 Vitexin8), 이소플라빈9)의 활성, 항염증 및 항암효과10), 화장품 약리활성11), 항자극 효과12) 등이 보고되어 식품이나 화장품 등의 원료로 활용되고 있다.
본 실험에서는 綠豆의 미백, 항염증 효과를 세분화시켜 확인하기 위해 綠豆의 에탄올 추출물 및 chloroform, ethyl acetate, aqueos 분획물을 이용하여 자외선 차단 활성, Tyrosinase, melanin 저해활성을 측정하여 미백효과를 확인하고 NO, Cytokine 억제 활성, 세포생존율을 측정하여 항염증 효과를 확인하였으며 실험에서 유의성을 얻어 보고하는 바이다.
Ⅱ. 재료 및 방법
본 실험에 사용한 綠豆(Phaseolus radiatus L.)는 콩과에 속하는 一年生 草本인 綠豆의 種子를 曬乾한 것으로 전남 무안산을 동신대광주한방병원에서 구입하여 사용하였다.
인간 유래 악성 흑색종(melanoma) 세포주인 B16F10 세포와 NO 생성 억제 시험에 사용된 동물세포주인 Raw264.7은 한국생명공학연구원 생물자원센터 (BRC)에서 분양 받은 것을 사용하였으며, phenol- red가 포함되지 않은 Dulbecco's Modified Eagle Medium(DMEM, WelGENE, Korea)배지에 10% FBS(WelGENE, Korea)와 1% penicillin- strep- tomycin(penicillin G sodium 10,000uints/㎖ streptomycin sulfate 10,000㎍/㎖, Gibco, USA)을 혼합한 배지를 사용하여 37℃, 5% CO2조건에서 배양하였다.
본 연구는 Folin-Denis reagent(Sigma, Switzerland), aluminium nitrate(Sigma, Germany), potassium acetate(Sigma, USA), 2,2-diphenyl-1-picrylhydrazyl (DPPH, Sigma, USA), sodium nitroferricyanide (III) dihydrate (Sigma, USA), sulfanilamide (Sigma, China), N-(naphtyl)ethylenediamine dihydrochloride (Sigma, USA), tyrosinase (Sigma, USA), arbutin (Sigma, USA), α-melanocyte stimulating hormone (α-MSH, Sigma, USA), lipopolysaccharide (LPS, Sigma, USA), mouse TNF-α ELISA kit(Abnova, China), mouse IL-6 ELISA kit(Abnova, China), mouse IL-1β ELISA kit(Abnova, China), MTT (Invitrogen, USA), gentamycin(Sigma, USA), tannic acid(Sigma, USA), rutin(Sigma, USA), ascorbic acid(Sigma, USA) 등의 특급시약을 사용하였고, 추출기(제조사, 대한민국), 감압농축기(EYELA, Japan), Microplate reader(BIO-TEK, USA), 동결건조기(삼원, 대한민국), 액체크로마토그래피 LC-20A(Shimadzu, Japan) 등의 기기를 이용하여 진행하였다.
綠豆는 건조된 것을 껍질이 있는 상태로 분쇄한 후 400g의 綠豆에 94%의 ethanol 4L를 혼합하여 80℃에서 3시간동안 2회 반복하여 추출 후 감압 농축하였다. 농축된 추출물 중 일부를 증류수에 분산시킨 후 chloroform, ethyl acetate를 순차적으로 사용하여 분획을 실시하였다. 綠豆 분획물은 여과 후에 감압농축, 동결 건조시켜 추출물과 함께 4℃ 이하 냉장보관하면서 실험에 사용하였다.
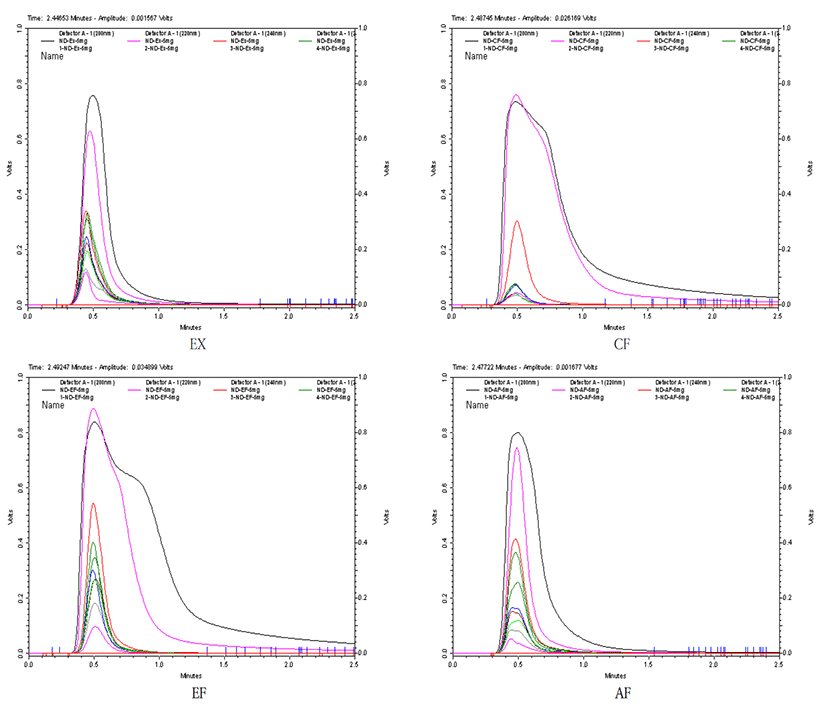
綠豆 추출물 및 분획물을 methanol에 5㎎/㎖ 농도로 희석한 후 200~390㎚의 자외선 파장 범위에서의 흡광도를 측정하였다. 정밀한 흡광도 측정을 위해 LC-20A의 액체크로마토그래피용 펌프와 검출기를 활용하였으며, 검출기의 파장을 변화시켜 가면서 각 시료액 10㎕를 연속적으로 주입하여 얻은 결과를 비교하였다.
Tyrosinase의 작용 결과로 생성되는 DOPA chrome을 비색법으로 측정하여 綠豆 추출물 및 분획물의 Tyrosinase 저해 활성을 확인하였다13). 0.1M phosphate buffer 100㎕와 농도별 시료액 20㎕를 혼합한 후 5분간 실온에서 반응시키는 방법을 사용하였다. 반응액에 0.1M phosphate buffer에 용해시킨 tyrosinase (1K unit/㎖) 30㎕와 1.5mM tyrosine 30㎕를 혼합한 후 37℃에서 10분간 추가로 반응시켜 반응이 완료되면 490㎚에서 흡광도를 측정하였다. Positive control로는 arbutin를 사용하였고, Tyrosinase 저해 활성은 아래 식을 사용하여 계산하였다.
Tyrosinase inhibitory activity(%) = [(Ab - As)/Ab] × 100
Ab : blank의 흡광도, As : 시료 첨가구의 흡광도
B16F10 세포를 48-well plate에 1×104 cells/well의 농도로 분주한 후 24시간동안 배양하여 부착 및 안정화시킨 다음, 농도별로 희석한 시료와 α-melanocyte stimulating hormone (α-MSH)를 처리한 다음 72시간 배양 후 생성된 melanin양을 405㎚에서 흡광도를 측정하여 비교하였다14). 시료액 대신 PBS를 사용한 blank의 흡광도를 기준으로 melanin 생성 억제율을 산출하였고, positive control로 arbutin을 사용하였다.
Raw 264.7 세포를 96well plate에 1×105 cells/well이 되도록 분주하고 24시간 동안 배양하여, 농도별 시료액과 lipopolysaccharide (LPS)를 혼합한 후 24시간 동안 배양하였다. 이때 LPS는 최종 농도가 2μg/㎖가 되도록 한다. 세포 배양액을 각 well에서 50㎕씩 회수한 다음 새로운 96well plate에 옮기고 50㎕의 1% sulfanilamide (in 5% H3PO4)를 첨가한 후 10분간 혼합한 뒤, 50㎕의 0.1% naphtyl- ethylendiamine dihydrochloride (in H2O)를 첨가하여 상온에서 10분간 반응시켜 540㎚에서 micro-plate reader를 이용하여 흡광도를 측정하였다15).
LPS 자극으로 염증 반응이 일어난 세포는 TNF-α, IL-1β, IL-6와 같이 전염증성 cytokine과 PGE2등을 생산한다. 특히 IL-6는 B cell이 plasma cell로 분화되는 단계를 활성화시키는 작용을 하며 염증성 질환 부위에서 증가하게 된다. Nitric oxide 생성 억제 시험과 동일한 조건으로 LPS와 각 시료를 농도별로 처리하여 2시간 배양 후 total RNA를 추출한 다음 해당 cytokine을 Abnova사에서 공급하는 TNF-α, IL-6, IL-1β 전용 ELISA kit를 이용하여 측정하였으며, 측정 kit 제조사에서 제공하는 최적 protocol에 따라 각각의 cytokine 수준을 측정하였다.
세포독성은 MTT assay 방법에 의해 측정하였다16). Nitric oxide 생성 억제 시험과 동일한 조건으로 LPS와 시료를 처리하여 배양을 진행한 후 PBS에 5㎎/㎖의 농도로 용해시켜 제조한 MTT용액을 각 well에 10㎕씩 가한 후, 37℃, 5% CO2에서 4시간 동안 반응시킴으로써 MTT가 환원되도록 하였다. 배지를 제거한 후, 각 well에 100㎕의 DMSO를 첨가하여 생성된 formazan 결정을 용해시켜 540㎚에서 흡광도를 측정하였으며, 시료액 대신 PBS를 사용한 blank의 흡광도를 기준으로 세포 생존율 산출하였다.
Ⅲ. 성 적
綠豆 추출물의 발효주정(ethanol) 수율은 1.26%로 나타났으며, 추출물을 증류수에 재분산시킨 후 실시한 용매별 분획에서 분획물의 수율은 chloroform 분획, ethyl acetate 분획, 물(aqueous) 분획이 각각 3.76%, 5.20%, 91.04% 로 나타남으로써 친수성이 높은 성분들이 추출물의 대부분을 차지하는 것으로 확인되었다(Table 1).
| Samples | Yield (%) | |
|---|---|---|
| EX | 1.26 | |
| Fractions | CF | 3.76 |
| EF | 5.20 | |
| AF | 91.04 | |
200 ~ 390㎚ 범위의 자외선 영역에서 실시한 綠豆 추출물 및 분획물의 흡광도 분석에서 EF분획물과 CF분획물의 흡광력이 다른 시료에 비해 높은 것으로 나타났다(Fig. 4).
綠豆의 추출물과 분획물 중 EF 분획에서 가장 높은 수치를 나타었으며 50μg/㎖, 200μg/㎖의 농도에서 각각 7.26±2.01%, 17.25±1.85%의 활성을 나타내었다. Positive control인 Arbutin은 50μg/㎖, 200μg/㎖의 농도에서 각각 26.03±3.29%, 62.27± 3.72%의 활성을 나타내었다(Fig. 5).
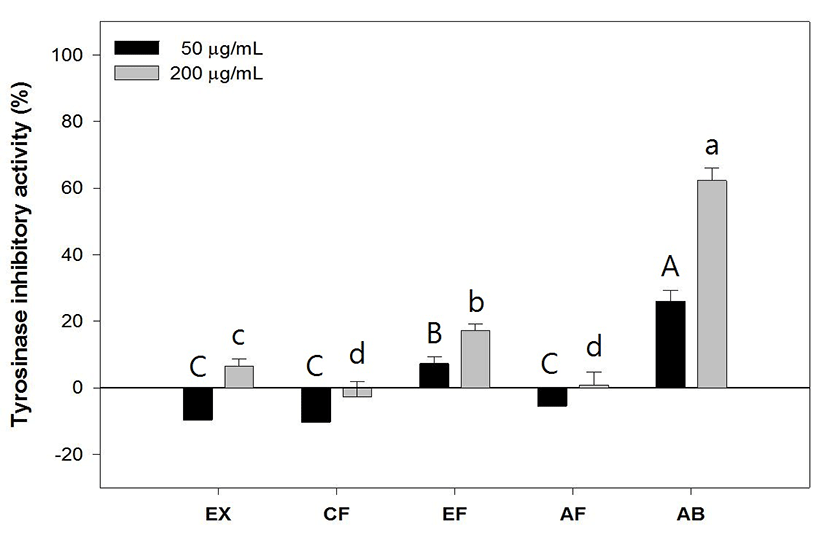
배양된 B16F10 melanoma cell을 α-melanocyte stimulating hormone으로 자극시켜 melanin을 생성하는 과정을 시료가 억제하는 활성을 확인하였다. 綠豆의 EX, CF 분획, AF 분획은 50μg/㎖, 100μg/㎖농도 모두에서 10% 미만의 활성을 나타내었고 EF 분획물은 50μg/㎖, 100μg/㎖에서 각각 12.95±2.94, 32.19±2.79%의 melanin 생성 억제 활성을 나타내었다. Positive control인 Arbutin은 50μg/㎖, 100μg/㎖에서 55.21±1.67%, 80.27± 2.07%를 나타내었다(Fig. 6).
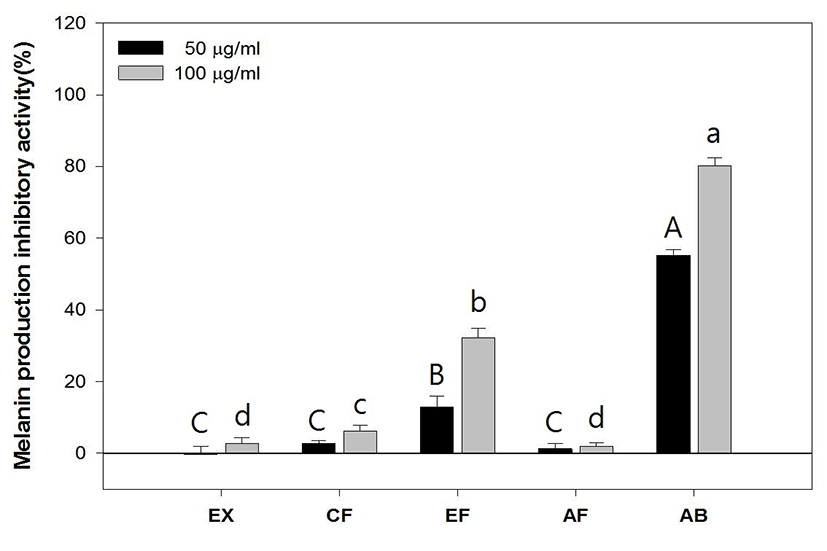
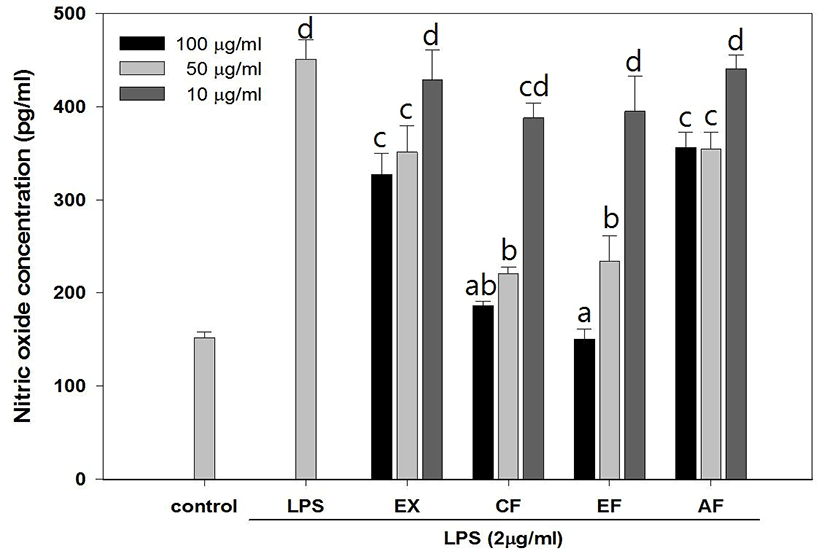
Lipopolysaccharide(LPS)로 염증반응이 유도된 RAW 264.7 cell에서 綠豆 추출물과 분획물의 NO 생성 저해 활성을 측정한 결과는 Fig. 6과 같다. LPS가 미처리된 control에서 151.9±6.41pg/㎖의 NO가 생성된 것에 비해 LPS만 처리된 실험군에서는 450.78±20.76pg/㎖의 NO가 생성되었다. 농도에 따른 NO 생성 억제효과를 확인할 수 있었으며 특히 CF분획과 EF분획물 시료가 처리된 실험군은 시행된 실험의 최고 농도인 100μg/㎖에서 각각 186.29± 45.3pg/㎖, 150.06±11.4pg/㎖의 NO가 생성되었다(Fig. 7).
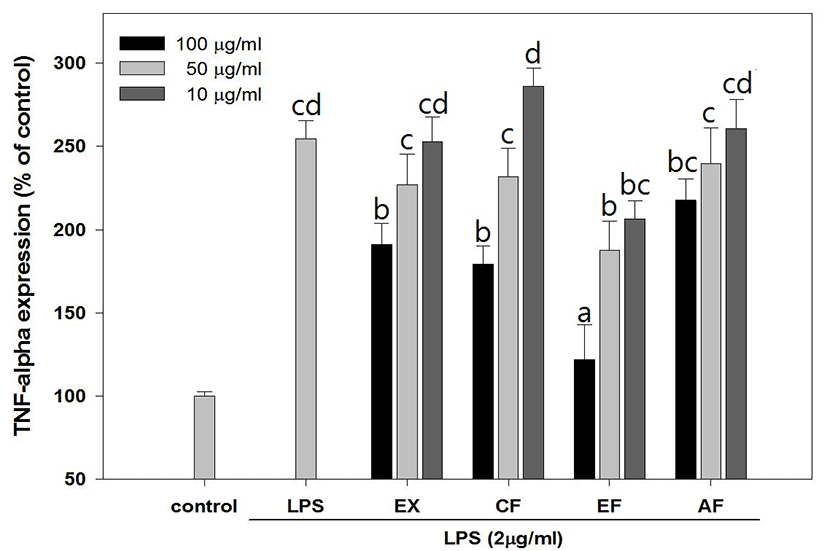
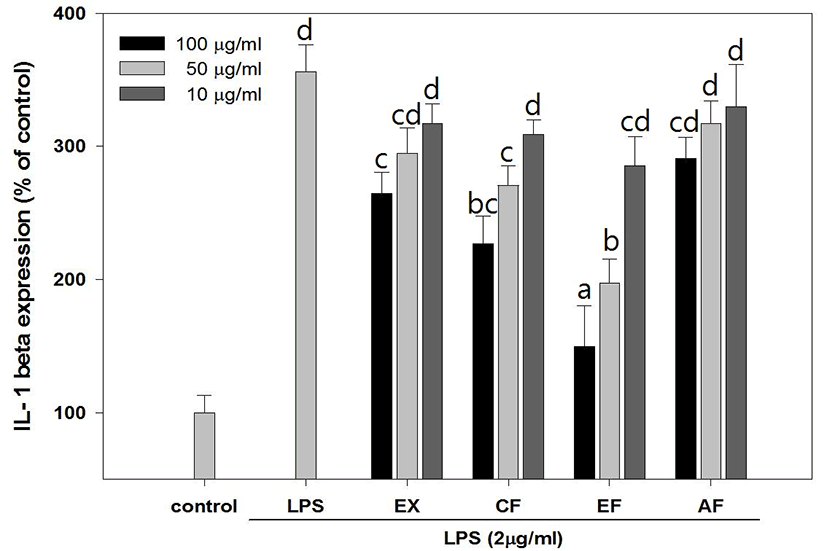
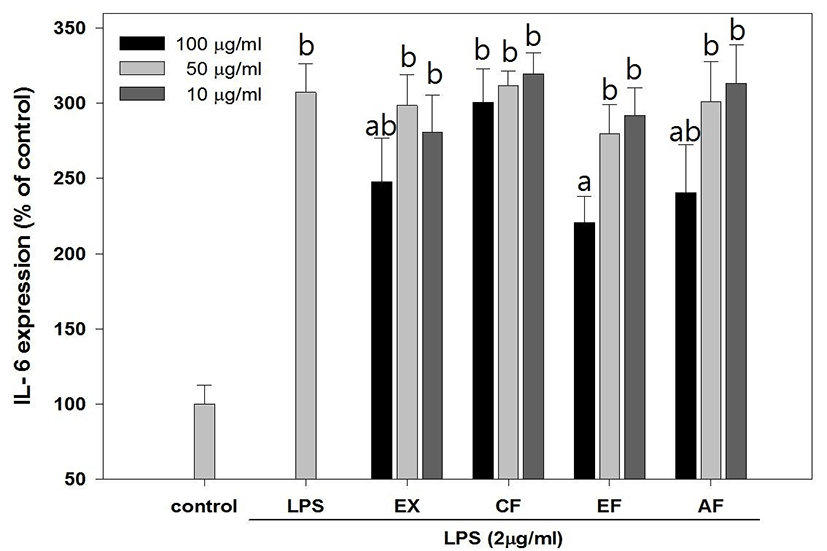
綠豆 추출물 및 분획물은 농도 의존적인 cytokine 생성 억제 효과를 보여주었으며, EF 분획물은 최고농도인 100μg/㎖에서 TNF-α(Fig. 8), IL-1β(Fig. 9), IL-6(Fig. 10)가 각각 121.82 ±21.17%, 149.88± 30.27%, 220.78±17.53% 발현되어 다른 시료 조건에 비해 상대적으로 높은 억제활성을 나타내었다.
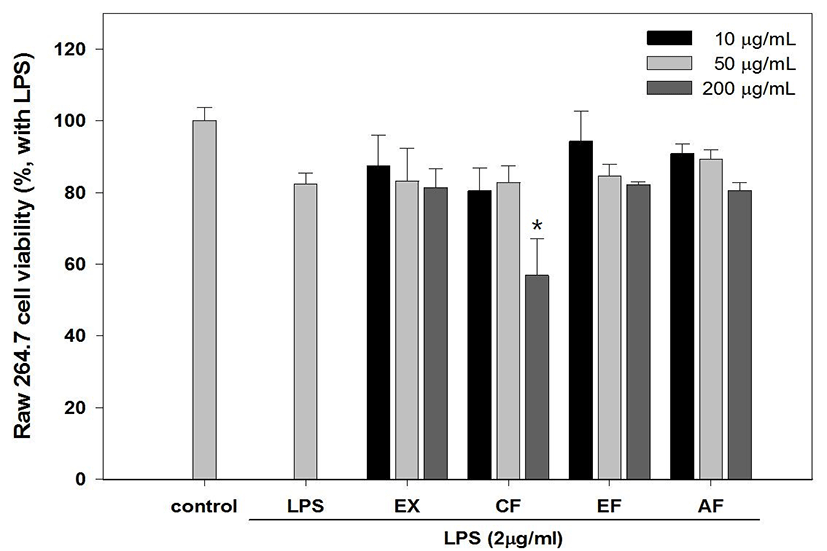
LPS로 염증반응을 유발시킨 상태에서 綠豆 추출물 및 분획물의 Raw 264.7 세포에 대한 세포독성을 MTT assay 방법으로 측정한 결과 Fig. 10과 같은 세포생존율을 나타내었다. 실험이 진행된 10~200μg/㎖ 농도에서 모든 추출물은 80% 이상의 전반적으로 양호한 세포생존율을 가지는 것으로 나타났으며, CF 200μg/㎖ 농도에서만 56.89±10.12%의 생존율을 나타냄으로써 실제 항염증 관련 실험은 100㎍/㎖ 수준을 최고 농도로 설정하였다(Fig. 11).
Ⅳ. 고 찰
피부는 우리 몸의 가장 바깥쪽에 위치하여 외부자극에 대한 1차적인 방어기능을 한다. 그러므로 대기 중의 오염물질과 직접적으로 접촉하게 되어 오존층의 파괴로 증가한 자외선과 중금속, 황산염 등으로 구성된 유해물질인 미세먼지 등에 의해 자극을 받아 피부가 손상되기 쉽고 이에 따라 피부건강에 대한 관심이 높아지고 있다1,2). 이에 따라 피부를 보호하고 피부에 달라붙은 오염물질을 씻어내는 피부 외용제에 대한 관심도가 증가하고 있으며, 웰빙 트렌드에 따라 원료에 대한 관심 또한 높아져 천연물을 소재로 한 제품들의 소비가 늘어나게 되었다17).
본 실험의 시료로 사용된 綠豆는 콩과에 속하는 1년생 초본 Phaseolus radiatus L. 의 種子13)로 대표적인 피부미용의 외용처방인 西施玉容散의 군약이다. 西施玉容散은 tyrosinase, melanin을 억제하여 미백효과를 낸다는 연구결과가 보고되었으며4,5) 최근 한방화장품의 기초로 사용되고 있다. 또한 『東醫寶鑑』에 “面生一切風刺,粉刺,雀卵,斑䵟,䵳黶子宜玉容西施散”6)에서 피부미용 뿐 아니라 일절의 피부질환에 사용됨을 알 수 있다.
西施玉容散의 군약인 백지, 백급 등의 피부 생리활성에 대한 연구는 활발하게 진행되었으나 성질이 차고 무독하며 解毒, 解熱, 利尿작용을 하여 예로부터 丹毒, 暑熱煩渴, 水腫, 癰腫 등의 치료에 사용되어 왔던 綠豆가 피부에 미치는 영향에 대한 실험 및 연구가 미흡하여 본 실험의 시료로 택하였다. 綠豆를 소재로 한 연구를 살펴보면 Vitexin8), Isoflavone9) 등 綠豆의 성분에 대한 연구와 두유나 유제품 등 식품소재로서의 기능에 대한 평가18), 발아綠豆의 항자극 효과12), 화장품 약리활성11) 등에 대한 연구가 진행되어있으며 외용제 등 제품의 소재로 사용될 수 있는 근거가 될만한 유의성을 가진 연구는 미흡한 실정이다.
이에 저자는 綠豆(綠豆, Phaseolus radiatus L.)의 에탄올 추출물 및 chloroform(CF), Ethyl acetate (EF), Aqueous(AF) 분획물을 이용하여 綠豆의 미백, 항염증 효과에 대해 확인하고 기존 연구에서 유의성을 나타내지 못했던 미백효과에 대해 단순히 tyrosinase 저해 활성만을 측정하는데 그치지 않고 자외선 차단 활성 및 melanin 생성 억제를 측정하였으며 항염증 효과실험에서 Cytokine 유전자 발현 억제 등을 측정함으로써 다양한 기전에서 추출물 및 분획물의 효과를 평가하였다.
자외선은 태양에서 나오는 파장이 400㎜ 이하인 광선으로 자외선을 받으면 melanocyte 내에 존재하는 Tyrosinase가 활성화되어19) Melanin이 합성되고 이렇게 생산된 Melanin의 양은 피부색을 결정한다20). Melanin은 인체의 피부를 보호하는 역할을 하지만 과하게 생성되면 기미, 주근깨 등을 형성하거나 심한 경우엔 피부암을 유발하기도 한다21).
Melanin은 L-tyrosine에서 DOPA - DOPA quinone - DOPA chrome - DHI 단계로 합성되므로 tyrosinase 저해 활성 측정은 미백효과 실험의 기본적인 검토사항이다6). 본 실험에서 PR 추출물 및 분획물의 Tyrosinase 저해 활성을 확인한 결과 EF 분획의 수치가 가장 높았으며 50μg/㎖, 200μg/㎖의 농도에서 각각 7.26±2.01%, 17.25±1.85%의 활성을 나타내었다. 이는 positive control인 arbutin이 26.03±3.29%, 62.27±3.72%를 나타낸 것에 비해 현저히 낮은 수치로 서11)의 연구에서 보고되었듯이 PR의 추출물 및 분획물은 melanin 생성을 억제하는 기전 중 tyrosinase의 활성을 저해하는 측면에서 활성이 높지 못함을 알 수 있다.
비록 Tyrosinase 저해활성에서 유의성을 나타내지 못하였으나 Melanin 합성과정 중 tyrosinase 외에 TRP-1,2 등이 주요하게 작용함이 밝혀져22) B16F40 melanoma cell을 α-melanocyte stimulating hormone으로 자극시켜 melanin을 생성하는 과정을 시료가 억제하는 활성을 확인하였다. 그 결과 EF 분획물이 100㎍/㎖ 농도에서 32.19±2.79로 측정되어 tyrosinase 저해활성 결과보다 높은 수준을 나타내었으며 추후 TRP-1,2 등이 작용하는 복합적인 기전의 Melanin 생성 억제 실험이 필요할 것이라 생각된다.
200 ~ 390 ㎚ 범위의 자외선 영역에서 실시한 PR 추출물 및 분획물의 흡광도 분석에서 EF 분획물과 CF 분획물의 흡광력이 다른 시료에 비해 높은 것으로 나타났다. 미세먼지로 인한 자외선량 증가와 자외선에 의한 광노화에 대한 인식이 생겨나면서 자외선 차단제의 중요성이 부각되고 있으며 PR의 미백효과 실험 중 자외선 차단효과가 가장 우수하여 자외선 차단제의 첨가제 및 소재로서의 활용을 기대해볼 수 있다. 또한 자극감을 느끼게 하는 TRPV1, TRPV3의 발현 억제 효과를 보인다는 연구결과가 있어12) 민감성 피부 등에 사용할 수 있는 자외선 차단제의 개발에도 응용될 수 있을 것으로 사료된다.
綠豆의 화장품 소재로서의 평가와 항산화, 미백에 대한 연구는 몇 차례 이루어졌으며 임10), 서18) 등의 연구에서 LPS로 유도된 Raw 264.7 cell, J774 cell23)의 NO 생성억제, Cytokine 발현 저해활성 등을 측정하여 항염증 효과를 실험하였으나 대부분 綠豆의 식품 자원 활용을 위한 연구로 피부에 미치는 항염증 효과에 대한 연구는 미미한 상태이다. 이에 본 실험에서는 LPS로 염증이 유발된 Raw 264.7 cell에서 PR의 에탄올 추출물 및 분획물이 NO의 생성 억제, Cytokine 유전자 발현, 세포생존율에 어떠한 영향을 미치는지에 대해 관찰하였다.
염증반응은 외상이나 기타 자극에 의해 조직이 손상되었을 때 손상부위를 재생시키기 위한 기전이므로 염증이 일어나면 손상회복 등의 중요한 역할을 하는 Cytokine과 free radical로 염증반응의 주요 매개체가 되는 NO의 생성이 증가하여 조직 파괴와 비정상적인 면역체계를 나타낸다10,24).
NO 생성 억제 활성을 측정 결과 LPS만 처리된 실험군에서 450.78±20.76pg/㎖ 농도의 NO가 생성되었으며 PR의 추출물 및 분획물 중 CF와 EF 분획물에서 실험 최고 농도인 100㎍/㎖에서 각각 186.29± 45.3pg/㎖, 150.06±11.4pg/㎖의 NO가 측정됨으로써 NO 생성 억제효과를 확인할 수 있었다. Cytokine 생성 억제는 농도의존적인 결과를 나타냈으며 상대적으로 다른 시료에 비해 높은 활성을 나타낸 EF 분획물은 100㎍/㎖에서 TNF-α, IL-1β, IL-6를 각각 121.82±21.17%, 149.88±30.27%, 220.78± 17.53% 발현시켜 LPS만 처리한 254.7±10.82%에 비해 현저하게 Cytokine 발현을 억제하였으며 특히 IL-6와 같이 B-cell 분화의 마지막 단계를 활성시키는 Cytokine 보다 이전 단계의 생성 억제 활성이 더 우수하게 나타남을 확인할 수 있는데 이는 권25)의 연구에서 綠豆 및 숙주나물의 에탄올 추출물이 LOX 및 COX 기질인 Arachidonic acid의 생성을 억제하여 초기 염증반응 단계에서 항염증 작용을 시작한다는 보고와 상당부분 일치하는 것으로 생각된다.
추가로 시행한 MTT assay를 이용한 세포독성실험은 세포생존율을 측정함으로써 시료가 세포의 증식 자체를 억제하여 NO 생성이 감소되는 것인지, LPS로 유도된 NO의 생성을 억제하거나 또는 생성된 NO를 소거하여 NO의 생성량을 감소시키는 것인지를 판단하는 중요한 근거가 되는데 200㎍/㎖ 농도에서 CF분획이 56.89±10.12%의 생존율을 나타낸 것을 제외하고 모든 시료에서 80%이상의 세포생존율을 가지는 것으로 나타나 PR 추출물 및 분획물의 안정성을 확인하였다.
PR의 에탄올 추출물 및 CF, EF, AF 분획물로 피부의 미백, 항염증 효과를 실험한 결과 전반적으로 EF 분획물에서 가장 뛰어난 활성을 나타내었다. 자외선 차단함으로써 미백효과 및 광노화방지효과를 나타내고, LPS로 염증을 유발한 Raw 264.7 cell에 대해 NO 생성, Cytokine 유전자 발현을 억제하여 항염증 효과를 나타내는 약물이라 생각된다. 모든 농도의 세포 독성 실험에서 80 % 이상의 양호한 세포생존율을 나타내어 안정성을 확보하였으며 본 실험결과를 토대로 綠豆의 효능을 극대화할 수 있는 첨가제 개발이 요구되며 복합제제로서의 다양한 활용을 위해 기타 한약재 및 천연물과의 상호작용 또한 연구되어야 할 것이라 사료된다.
Ⅴ. 결 론
綠豆의 EX(Ethanolic extract) 및 CF (Choloform), EF(Ethyl acetate), AF(Aqueous) 분획물을 이용하여 항염증, 미백효과를 실험하였다.
1. 미백효과 실험 중 자외선 차단 활성을 알아보기 위한 흡광도 실험에서 EF와 CF분획물의 흡광력이 높은 것으로 나타났으며 Tyrosinase 저해 활성 실험에서 Positve control인 Arbutin에 비해 유의미한 활성을 나타내지 못하였으나 시료가 Melanin 생성 자체를 억제함이 관찰되었다.
2. LPS로 염증반응을 유도한 RAW 264.7 cell을 이용한 항염증효과 실험에서 농도의존적으로 NO 생성을 억제하고 EF분획이 다른 분획물에 비해 TNF-α, IL-1β, IL-6의 발현을 유의미하게 억제함이 관찰되었다.
※ 본 논문은 2018년도 동신대학교 석사학위논문으로 작성되었습니다.