Ⅰ. 서 론
창상은 피부와 연부조직의 손상으로 정상적인 생체조직의 기능적 해부적 연속성이 손실된 것으로 창상 조직의 치유과정은 진피와 상피 조직의 재생을 통해 일어나는데, 염증기(inflammation phase), 증식기(proliferation phase), 성숙기(remodeling phase)의 과정을 거쳐 일어난다. 염증기는 지혈반응과 염증반응이 일어나고,증식기는 육아형성(granulation), 수축(contraction), 상피화(epithelialization) 과정을 거치고 성숙기는 반흔 형성이 일어난다1).
한의학적인 창상의 치료법은 初期, 成膿, 潰後의 세단계로 나누며, 치료법도 이에 따라 消, 托, 補의 세가지의 기본법칙으로 분류된다2).
황기(Astragali Radix)는 콩과에 속한 단너삼(Astragalus membranaceus Bunge) 및 동속 근련식물의 근으로 성미가 甘,微溫,無毒하며 補氣升陽, 固表止汗, 托毒排膿, 利水退腫, 生氣斂瘡의 효능이 있어 정기가 부족하여 久不潰破 혹은 潰久不斂한 증상에 활용되어 왔다3).황기에 대한 실험적 연구로는 외과적창상에 미치는 영향4), 혈관 형성에 미치는 영향5), 섬유아세포에서 Collagen 생성과 Tyrosinage 활성 억제효능6), elastase 활성억제와 DPPH, NO 소거능7), HaCaT 세포에서 Hyaluronic acid 생성 증가효과8)에 대한 보고가 있었다. 그러나 황기약침이 창상치유에 미치는 효과에 대한 연구는 미비한 실정이었다. 따라서 본 연구에서는 황기약침이 창상 치유에 대한 효과를 실험적으로 규명하고자 창상 동물모델을 사용하여 전층피부손상을 유도하고 창상주위조직에 황기약침을 처치하여 창상치유의 효과와 기전을 확인하고자 하였다.
Ⅱ. 재료 및 방법
황기약침액은 대한약침학회에서 제공받아 사용하였다. 조제방법을 간략히 서술하면,농림생약(Seoul, Korea)에서 구입한 황기(Astragali Radix) 250g에 2ℓ의 증류수를 첨가하여 105℃에서 120분 동안 전탕하고 진공냉각관을 통해 수증기 증류냉각식으로 추출하였다. 추출된 약침용액은 pH 7.25-7.35, 0.9% 등장액이 되도록 조제하였다. 이후 200㎖ 고압멸균 (high pressure sterilizer, Fine FA, KOREA)한 후 -4℃에 보관하였다가 실험에 사용하였다.
실험동물은 6주령 ICR mouse를 샘타코(Osan, Korea)에서 구입하여 일주일동안 실험실 환경에 적응시킨 후 사용하였다. 사육실의 온도는 23±1℃, 습도 55±10%를 유지하였으며, 명암은 12시간 주기로 하여 고형사료와 물을 자유롭게 섭취하도록 하였다. 실험군은 창상유발 후 생리식염수 처치군(CON)과 창상유발 후 황기약침처치군(ARP)로 각 군당 25마리씩 나누어 창상유발 후 15일까지 분석에 사용하였다. 모든 실험계획은 동의대학교 동물실험윤리위원회의 승인을 얻어 동물실험과 관리가 규정에 맞게 적절하게 실시하였다(R2014-014).
7 week-old ICR mouse는 전신마취를 위해 (0.1㎎/㎏) 농도의 Zoletil 50 (Virvac, Seoul, Korea)을 0.2㎖ 대퇴부에 근육 주사하여 마취하였다. 마우스의 등 부분의 제모를 위해 전기제모기를 사용하여 피모를 제거하고, 비키로 크림(태극제약, Buyeo, Korea)을 발라 완전하게 제모한 후 70% ethanol로 소독하였다. 등쪽 중앙 부위에 8㎜ punch(KEYES, Pakistan)을 사용하여 피하층까지 분리하여 전층 피부 결손 창상을 유발하였다. 창상 유발 후 상처부위 감염 방지를 위해 창상 주위를 소독하고, PBS로 창상부의 혈흔과 기타 삼출물을 정리하였다. 전층 피부결손 창상을 유발시킨 실험동물은 무작위로 배분하여 두 군으로 나누었다. 황기약침처치군(ARP)은 insulin syringe(BD, Franlkin Lakes, USA)를 이용하여 창상 주변 정상피부 8군데에 ARP(stock 100㎎/㎖ in saline)를 0.2㎖씩 창상 유발 당일부터 3일 간격으로 총 4회 주입하였고, 대조군(CON)은 saline을 0.2㎖씩 창상 유발 당일부터 3일 간격으로 총 4회 주입 하였다.
창상 유발 당일부터 3-4일 간격으로 13일간 같은 시간에 디지털카메라(SONY, Japan)를 이용해 각 군의 동물들의 창상부위를 촬영하였다. Image J Software (US National Institute of Health Program, USA)을 통해 면적을 측정하여, 창상 수축률(A), 창상 치유율(B)과, 창상 상피화율(C)을 아래 식에 따라 구하였다.
W0 : 창상 유발 직후 창상부 면적
Wi : 측정일 수축된 창상부 면적
Ui : 측정일 미상피 육아조직
창상 유발 후 3, 6, 9일째 CON군과 ARP군에서 각 5마리씩 실험동물을 희생하여 창상 피부조직을 채취하였다. 조직을 4% 중성 formalin 용액에 24시간 고정한 후 창상 중앙부위를 통과하는 절편을 취하여 탈수시킨 후 파라핀 블록에 포매하였다. 조직을 4㎛ 두께로 절편을 잘라 표본 제작하여, Hematoxylin-Eosin (H&E) stain 방법으로 조직을 염색하였다.
창상 유발 후 3일째 H&E 염색된 피부조직을 광학현미경 (Leica, Wetzlar, Germany)으로 관찰하였으며, 400배 고배율에서 조직 사진을 촬영하여 Image J Software (US National Institute of Health Program, USA)을 이용하여 염증세포 수를 측정하였다.
창상유발 후 3일째와 13일째 피부조직을 0.1g 채취하여 잘게 자른 후 TRizol을 사용하여 RNA를 추출하였다. TRizol 처리된 조직절편에 chloroform을 넣고 vortexing하고 12,000 rpm에서 15분 동안 원심분리한 후, 상층액을 취하여 동량의 isopropanol을 혼합하였다. 12,000 rpm에서 10분 동안 원심분리하여 상층액을 제거하고 pellet은 DEPC (diethyl pyrocarbonate)-DW에 녹여 정량 후 RT-PCR kit (Bioneer, Daejeon, Korea)를 사용하였다. 100ng의 RNA는 PCR machine (GeneAmp, PCR system 9700, USA)을 이용하여 45℃에서 30분, 94℃에서 5분 동안 반응시킨 후 94℃에서 30초 동안 denaturation시키고, 53~58℃에서 30초 동안 annealing시킨 다음, 72℃에서 1분 동안 extension시키는 cycle을 30회 반복한 뒤, 마지막 extension은 72℃에서 5분 동안에서 수행되었다. 각 PCR products는 2% agarose gel에 loading하여 100V 조건에서 30분 동안 전기영동을 통하여 분석하였다. mRNA 발현 밴드는 Image J software (National Institute of Health, USA)를 사용하여 정량하였다. 각 밴드영역에서 측정된 pixels의 수를 정량하여 CON군에 대한 비율로 나타내었다. 각 primer의 염기서열은 다음과 같다(Table 1).
창상유발 후 3일째와 13일째 피부조직 0.1g을 채취하여 homogenize 후 ice-cold lysis buffer (20 mmol/ℓ Tris-HCl [pH 8.0], 150 mmol/ℓ NaCl, 2 mmol/ℓ ethylene diamine tetra acetic acid (EDTA), 1 mmol/ℓ NaF, 1% Igepal CA-630, 1 mmol/ℓ PMSF, 1 mmol/ℓ Na3VO4, proteasein- hibitorcocktail)를 첨가하여 protein을 추출하였다. Protein content를 Bradford법으로 정량하여 25μg의 단백질을 l0% sodium dodecyl sulfate- polyacrylamide gel electrophoresis (SDS-PAGE)로 분리하고, Hypond-PVDF membrane (Amersham, Little Chalfont, UK) 으로 transfer하였다. Transfer된 membrane은 Tris-buffered saline Tween-20 (TBST) (20 mM Tris, pH 7.6, 136 mM NaCl, 0.1% Tween 20)에 용해된 5% skim milk에 1시간동안 실온에서 blocking한 후 PECAM-1(CD31)와 β-actin primary antibody (1: 1,000 dilution)로 4℃에서 overnight한 후 TBST로 3회 washing하고, HRP-conjugated secondary antibody(1: 5,000 dilution)로 1 시간 동안 실온에서 반응시켰다. TBST로 3회 세척한 후 면역반응성 단백질 밴드는 X-ray films에서 enhanced chemiuminescence regents (ECL) (SuperSignal west Pico Trial kit, Thermo scientific, USA)을 이용하여 검출하였다. 면역반응성 단백질 밴드는 Image J software (NIH-Scion, USA)를 사용하여 정량하였다. 각 밴드영역에서 측정된 pixels의 수를 정량하여 CON군에 대한 비율로 나타내었다.
창상이 치유된 15일째 H&E 염색된 피부조직을 광학현미경(Leica, Wetzlar, Germany)으로 관찰하였으며, 50배율에서 조직 사진을 촬영하여 Image J Software (US National Institute of Health Program, USA)을 이용하여 millimeter 단위로 측정하였다. 반흔의 최대 폭은 정상적인 교원질 배열이 아닌 섬유화로 인한 교원질 다발이 있는 구역인 반흔의 최대 폭을 측정하였다. 최대 반흔 단면적은 표피 하방, 피부 밑 근육층 상방의 상대적인 면적을 측정하였다. CON군과 ARP군의 상대적인 값을 통계적으로 검증하였다.
Ⅲ. 결 과
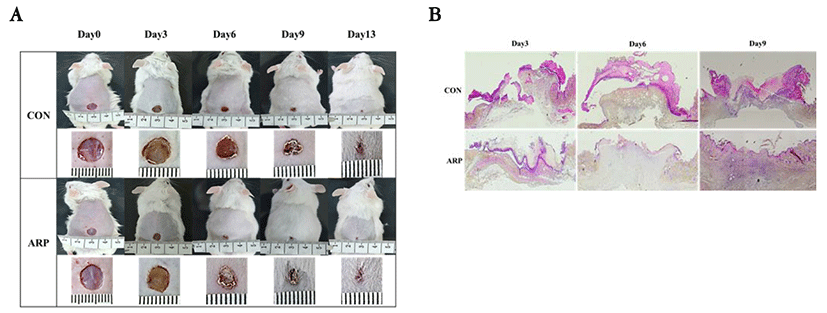
창상유발 후 3일 간격으로 13일까지 상처면적의 변화를 육안으로 관찰하였다. 창상 유발 당일에는 모든 실험동물의 창상조직에서 혈액과 삼출물이 분비되었고, 염증성 변화가 나타났으나, 시간이 경과함에 따라 창상주위 조직의 수축과 상피화가 진행되면서 미상피 육아 조직이 점차 감소되면서 창상이 치유되는 것을 관찰하였다(Fig. 1).
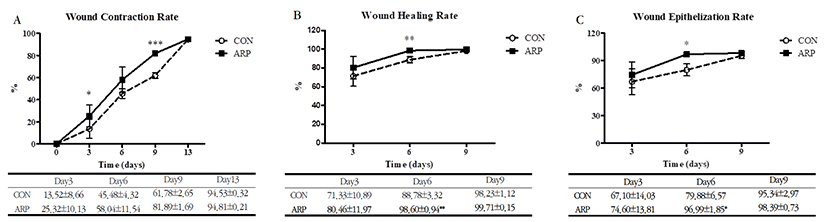
창상의 수축률은 시간 경과에 따른 창상 치유과정 동안 ARP군에서 CON군에 비해 높게 나타났으며, 3일과 9일째에 통계적으로도 유의한 결과를 보였다(Fig. 2A).
창상 치유율과 창상 상피화율은 창상 치유과정 동안 ARP군에서 CON군에 비해 높게 나타났으며, 6일째에 통계적으로도 유의한 결과를 보였다(Fig. 2B, C).
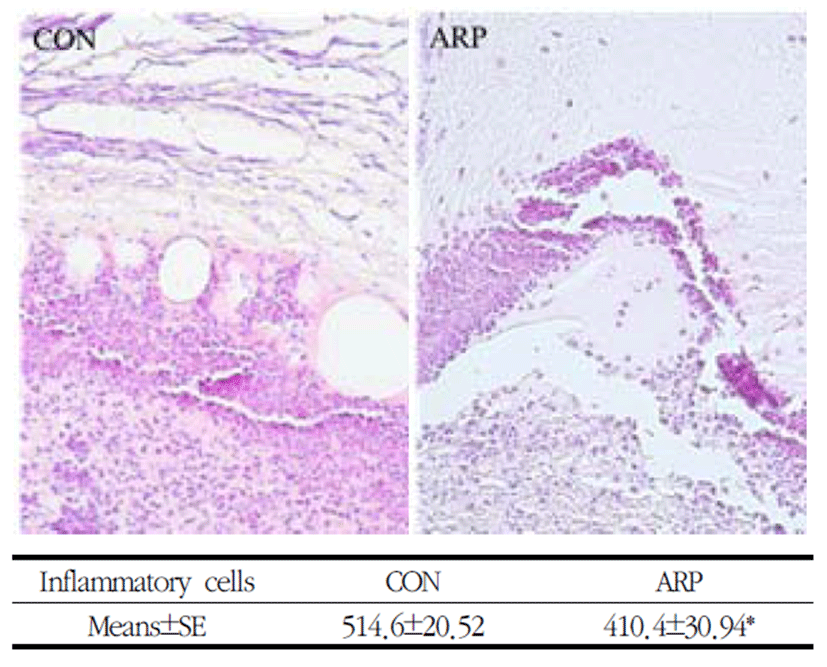
창상 치유 첫 단계인 염증 반응은 창상 유발 후 2-3일에 가장 활발한 것으로 알려져 있다. 따라서 본 실험에서는 창상 유발 3일째 창상 조직을 H&E 염색하여 관찰한 결과 염증세포수가 ARP군에서 514.6± 20.52개였고, CON군에서 410.4±30.94개로 ARP군이 CON군에 비해 염증세포수가 유의하게 감소한 것을 관찰하였다(Fig. 3).
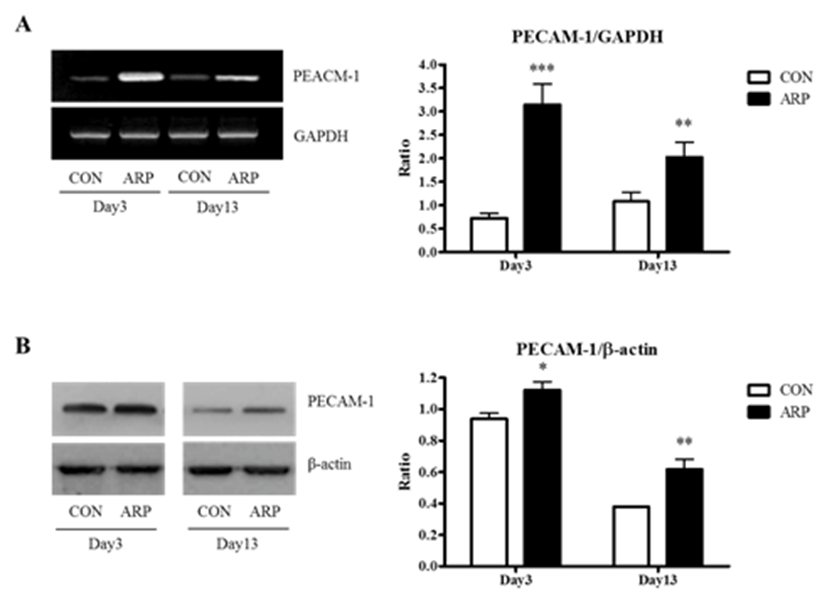
창상이 치유됨에 따라 신생혈관의 생성 정도를 알아보기 위하여 창상 유발 후 3일, 13일째에 창상 조직 내 PECAM-1 유전자 발현 및 단백질 발현 정도를 조사하였다. 실험결과 창상 유발 후 3일과 13일째에서 모두 PECAM-1 유전자 및 단백질 발현이 유의하게 증가하였다(Fig. 4).
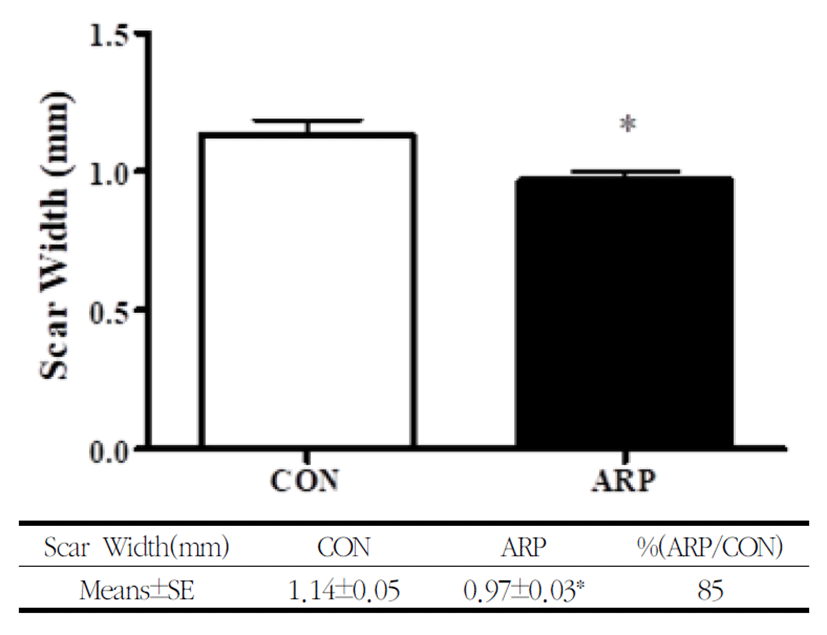
창상 치유 후 정상부위를 포함한 반흔의 최대직경부위의 단면을 H&E 염색을 통해 관찰한 반흔의 폭은 ARP군에서 1.14±0.05㎜였고, CON군에서 0.97±0.03㎜로 ARP군이 CON군에 비하여 평균 85%의 폭으로 CON군에 대해서 15%의 반흔 폭을 줄이는 효과를 나타내었으며, 이는 통계적으로 유의하게 나타났다(Fig. 5).
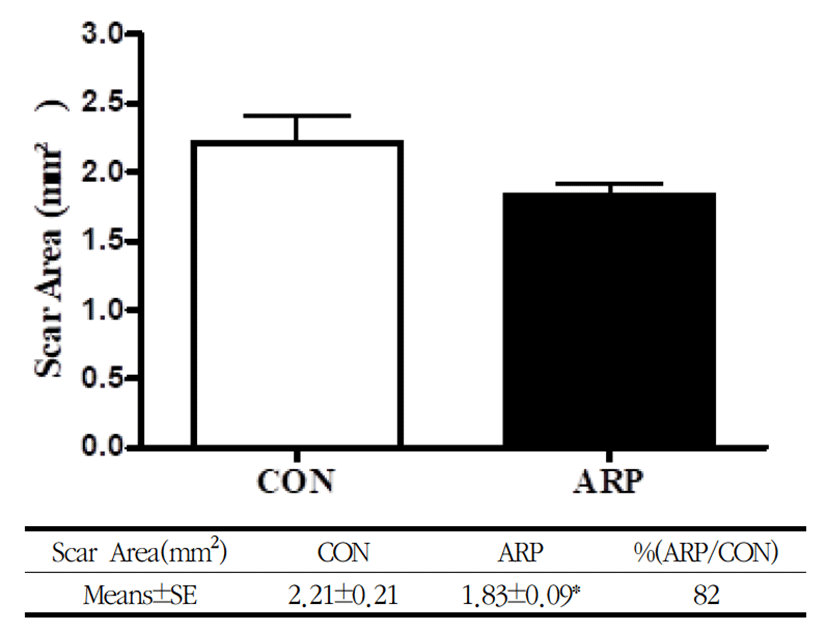
반흔의 최대 면적은 ARP군에서 2.21±0.21㎟이고, CON군에서 1.83±0.09㎟로 ARP군이 CON군에 비하여 평균 82%의 면적으로 CON군에 대해서 18%의 반흔 면적을 줄이는 효과를 나타내었으며, 통계적으로 유의하지는 않았다(Fig. 6).
IV. 고 찰
정상적인 창상의 치유는 시기별로 염증기(inflammation phase), 증식기(proliferation phase), 성숙기(remodeling phase)의 과정을 거쳐 일어나는데, 염증기는 창상 1일 이후 조직손상 부위에 염증세포의 유입과 함께 염증반응이 일어나고 상처치유과정으로 지혈반응이 일어난다1). 증식기는 창상 4일 이후 조직 손상의 가장자리로부터 새로운 혈관형성이 시작되고 섬유아세포에 의한 콜라겐의 합성이 일어나 새로운 결체조직으로 결손이 있는 부분을 채워 육아조직을 형성하고 창상 7일 이후 창상수축이 시작되어 상처의 가장자리로부터 상피세포의 이주가 일어나 손상된 부분을 덮는다. 그 이후 진행되는 성숙기에는 섬유모세포를 가진 육아조직이 교원질 섬유로 가득 찬 반흔조직으로 바뀌면서 반흔을 형성한다1,9). 이러한 정상적인 창상 치유 과정에서 새로운 혈관의 생성이 중요한 역할을 하고, 창상치유가 진행되면서 증가한다.
한의학에서 창상의 치료는 初期, 成膿, 潰後의 세단계로 나누어 消, 托, 補의 세가지의 치료법을 사용한다. 그 중 消法은 병변의 손상을 초기에 消散시키고, 托法은 화농되어 있지 않거나 부패한 조직을 조속히 화농시켜 消退하며, 補法은 창상 후기에 국한적으로 파궤된 후 장기간에 걸쳐 유합되지 않는 경우에 사용한다2).
황기의 성미는 微溫無毒 味甘하며, 肺脾 귀경으로 補氣升陽, 益衛固表, 托瘡生肌, 利水消腫의 효능으로 임상에서 창상 치유과정의 있어 초기에서 후기까지 활용되며, 특히 정기허약으로 인한 상처의 회복을 목표로 다양하게 활용하고 있다3).
본 연구에서 마우스의 전층 피부손상을 유발한 후에 시간적 경과에 따른 창상의 치유과정을 육안적으로 관찰한 결과, 황기 약침 처치군이 대조군에 비해 창상의 면적을 빠르게 감소시키는 효과를 관찰할 수 있었고, 조직학적 관찰을 통해서도 동일한 결과를 관찰하였으며(Fig. 1), 창상의 수축률, 치유율, 상피화율의 변화에서도 황기 약침 처치군이 대조군에 비해 유의한 결과를 보였다(Fig. 2).
창상 치유 과정에서 염증 반응이 과도하게 일어날 경우 미성숙 교원질로 인한 섬유화가 많이 발생해 반흔 생성이 많아지게 된다. 본 연구에서는 황기 약침이 염증반응에 미치는 영향을 평가하기 위해서, 염증 반응이 가장 활발하게 일어나는 시기인 3일째에 창상 변연부의 조직을 얻어 염증세포의 분포와 수를 측정하여 대조군과 비교하였다. 이러한 초기 염증 반응기의 염증세포의 수는 황기 약침 처치군이 대조군에 비해 감소했음을 알 수 있었다(Fig. 3).
이러한 결과를 통해 볼 때 황기 약침 처치가 창상 치유 초기부터 상처조직의 조기 수축, 치료, 육아조직 조기 형성과 염증반응 억제 등을 통해 빠른 회복효과를 나타내는 것으로 보인다.
한편, 혈관의 생성은 정상적인 창상 치유 과정에서 중요한 부분으로 신생혈관은 창상 치유가 진행되면서 점점 증가하게 된다. 본 연구에서도 혈관의 생성에 중요한 영향을 주고 조혈세포와 혈관내피세포에서 특이하게 발현되는 것으로 알려져 있는 PECAM-1의 발현을 조사하였다. PECAM-1은 또한 전구염증기능과 항염증 기능을 통해 염증반응의 조절에 필수적인 인자이다. PECAM-1은 상처 및 염증 부위에 혈관투과성과 백혈구 이주를 촉진시키는 기능을 통해 전구 염증 반응을 촉진하는 역할을 한다10,11). 그러나 PECAM-1의 주요 작용은 상처 및 염증 부위에서 백혈구 활성을 약화시키고12), 전구염증 사이토카인의 생산을 억제하고13), 혈관장벽을 온전히 유지시킴으로써14), 항염증 작용을 하고, 창상의 치유과정에서 발현이 증가하는 것으로 알려져 있다11,15).
본 연구에서 창상 유발 3일째와 13일째 조직을 채취하여 조직 내 PECAM-1의 유전자 및 단백질의 발현을 조사한 결과 황기 약침 처치군에서 대조군에 비해 유전자의 발현과 단백질의 발현을 모두 증가시키는 결과를 보였다(Fig. 4). 이러한 결과는 황기 약침 처치가 창상 주위 조직 내 PECAM-1의 발현을 조절함으로써 혈관 신생과 치유과정에 관여함을 알 수 있었다.
창상의 회복에서 반흔의 생성에 미치는 효과를 살펴보기 위하여 창상 유발 후 15일째 피부조직을 채취하여 H&E염색을 통해 반흔의 폭과 단면적의 변화를 살펴본 결과 황기 약침 처치가 반흔의 폭을 유의하게 감소하였으며, 반흔의 단면적을 감소시키는 경향을 보였다(Fig. 5,6).
이와 같은 결과를 바탕으로 종합적으로 판단해볼 때 황기 약침 처치는 전층 피부 결손 창상의 초기부터 창상 회복의 전 단계에 걸쳐 빠른 상피화와 창상 수축, 염증 반응 억제, PECAM-1 발현 증가에 의해 창상회복을 촉진시키고 반흔조직을 감소시키는 효능을 나타내는 것을 확인할 수 있었다. 따라서 황기약침이 임상에서 창상치료에 효과가 있을 것으로 판단되며 추후 창상주위에 약침 주입이 아닌 원위취혈로서 창상회복과 관련된 유관된 혈위 주입, 적절한 농도 및 용량에 관련된 연구도 필요할 것으로 사료된다.
Ⅴ. 결 론
본 연구에서 황기 약침 요법을 활용하여 마우스의 전층 피부손상에 미치는 영향에 대해 조사하고 유의한 결과를 얻었다.
1. 창상의 면적은 ARP군에서 CON군에 비해 염증 초기인 3일째와 6일째에 급격한 감소를 보였다.
2. 창상의 수축률, 치료율, 상피화율은 ARP군에서 CON군에 비해 증가를 나타내었다.
3. 염증세포의 수는 ARP군에서 CON군에 비해 감소를 나타내었다.
4. 창상조직내의 혈관신생, 염증조절 및 창상치유를 나타내는 지표인 PECAM-1의 유전자 및 단백질 발현이 ARP군에서 CON군에 비해 증가를 나타내었다.
5. 반흔의 폭과 단면적이 ARP군에서 CON군에 비해 감소를 나타내었다.
이상의 결과를 종합하여 볼 때 ARP가 창상치유를 촉진시키는 유의한 효과가 있는 것으로 나타났다.






