Ⅰ. 서 론
염증(Inflammation)은 상처를 줄 수 있는 자극에 대한 생체의 방어반응으로, 임상적으로는 발적, 발열, 종창, 동통, 기능장애의 5가지 증상이 나타난다1). 대식세포는 nitric oxide (NO)와 prostaglandins (PGs)을 생산하며2), 이로 인해 숙주방어기전에 중요한 역할을 하는 동시에3) 염증반응과 밀접한 상관관계를 가진다.
NO는 높은 반응성을 가진 생체 생성분자로서 NO synthase (NOS)에 의해 L-arginine으로부터 생성된다. 대식세포가 lipopolysaccharide (LPS)로 자극 될 때 inducible NOS (iNOS)가 발현되어 많은 양의 NO를 생성하게 된다. 이렇게 생성된 NO는 염증반응 매개물질의 역할을 하게 된다1,4).
PGs, 특히 prostaglandin E2 (PGE2)는 세포막에 있는 지방산인 arachidonic acid에 cyclooxygenase-2 (COX-2)의 자극이 가해질 때 발생하며4), NO와 마찬가지로 염증반응 매개물질의 역할을 하게 된다5).
Mitogen-activated protein kinase (MAPK)는 extracellular signal-regulated kinase (ERK), c-Jun NH2-terminal kinase (JNK), serine/threonine protein kinase 인 p38 MAPK 등이 있으며6,7), 이들 MAPK는 iNOS와 COX-2의 유전자 발현에 있어 주요 신호전달 분자로 알려져 있어8), 염증반응에 있어 중요한 역할을 하게 된다.
이와 같은 염증 반응은 한의학적으로 正邪抗爭의 관점에서 관찰할 수 있다. 正은 正氣로 邪氣에 대응하는 인체의 항병력 및 정상적인 생리기능을 총칭하고, 邪는 邪氣로 발병인자를 총칭한다9). 이러한 正邪抗爭을 한의학적 치료강령에 적용할 경우 扶正祛邪와 같은 의의를 지닌다고 볼 수 있다.
內托千金散은 明代 陳實功의 <外科正宗>10)에 최초로 기재되어 있으며, 朝鮮代 許浚의 <東醫寶鑑>11)에서는 “治一切癰疽惡瘡 能內托”이라 하였다. 內托法은 한의학 외과치료법 중 內治法의 한 방식으로 實證의 치료법인 透托과 虛症의 치료법인 補托을 병행하여 藥物로 扶正達邪12), 즉 扶正祛邪를 하는 것이다. 이에 內托千金散은 염증반응의 억제에 적용할 수 있는 한의학 처방으로 생각하여 볼 수 있다.
지금까지 內托千金散에 관한 연구 보고는 김 등13-16)의 연구가 있는데 이러한 연구들은 주로 면역조절작용13,14), 항종양효과 기전15), 알레르기성 접촉성피부염16) 에 대한 실험 연구였다.
이에 저자는 內托千金散이 RAW 264.7 대식세포주에서 세포독성, NO 생성, PGE2 생성, iNOS 및 COX-2 발현, ERK1/2 인산화 억제에 미치는 영향에 대하여 유의한 결과를 얻었기에 보고하는 바이다.
Ⅱ. 연구 내용 및 방법
본 실험에 사용한 內托千金散은 東醫寶鑑에 근거하여 구성 약물을 ㈜HMAX에서 구입하여 사용하였다(Table 1).
조제방법은 다음과 같다. 內托千金散 96g을 3차 증류수 2L와 혼합하여 100℃로 4시간 동안 열수 추출하였으며, 여과지로 여과한 추출액을 rotary evaporator를 이용하여 100㎖까지 농축하고 -80℃로 동결하였다. 농축한 동결액을 freezing dryer system (Labconco, USA)을 이용하여 7일간 동결건조 하였다 (15.36g, 수율 약 16%).
실험에 사용된 mouse 대식세포는 RAW 264.7 cell line (ATCC, USA)을 분양받아 사용하였다. RAW 264.7 cells은 37℃, 5% CO2 조건에서 10% fetal bovine serum (FBS), penicillin (100U/㎖) 및 streptomycin (100㎍/㎖) 등이 포함된 DMEM 배지로 배양되었다. 배양세포들은 75㎠ flask (Falcon, USA)에서 충분히 증식된 후 배양 3일 간격으로 배양세포 표면을 PBS 용액으로 씻어준 뒤 50㎖ flask 당 1㎖의 0.25% trypsin-EDTA 용액을 넣고 실온에서 1분간 처리한 다음 trypsin을 버리고 37℃에서 5분간 보관하여 세포를 탈착하여 계대 배양하였다. 탈착된 세포는 10% FBS가 첨가된 DMEM 배양액 10㎖에 부유시킨 다음 새로운 배양용기 (50㎖ culture flask)에 옮겨 1:2 split ratio로 CO2 배양기에서 배양하였다.
세포독성 유발 효과를 알아보기 위하여 3-(4,5- dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) assay 방법을 사용하여 측정하였다. 96 well plate에 1 x 105 cells/well의 cell을 100㎕씩 넣고 37℃, 5% CO2가 공급되는 배양기에서 24시간 동안 배양한 후 배지를 버리고 배양세포 표면을 1x PBS 용액으로 씻어주었다. 같은 양의 배지와 PBS에 녹인 시료를 농도별로 각 well에 처리하고 24시간 배양하였다. 배양이 끝난 후 PBS에 녹인 1㎍/㎖ MTT (Sigma, USA)를 100㎕씩 각 well에 처리하여 알루미늄 호일로 차광시킨 뒤 2시간 동안 같은 조건에서 배양하였다. 배양액을 모두 제거한 후 DMSO를 100㎕ 처리하고 37℃에서 2시간 방치한 다음 microplate reader를 이용하여 490㎚에서 흡광도를 측정하였다. 세포생존율은 다음과 같은 공식으로 계산되었다.
Viability(%) = 100 × AT/AC
AT : absorbance of tested extract solution
AC : absorbance of control
96 well plate에 1 x 105 cells/well의 cell을 100㎕씩 넣고 37℃, 5% CO2가 공급되는 배양기에서 24시간 동안 배양하여 세포를 안정화 시켰다. 안정화 시킨 세포에 lipopolysaccharide (LPS) 10㎍/㎖와 內托千金散 열수 추출물을 농도별로 처리하고 24시간 동안 37℃, 5% CO2가 공급되는 배양기에서 배양한 후 세포배양 상등액 60㎕을 채취하여 여기에 Griess 시약 100㎕을 혼합하여 15분 동안 반응시킨 뒤 microplate reader를 이용하여 540㎚에서 흡광도를 측정하였다.
PGE2의 측정은 commercial competitive enzyme immunoassay kit를 R&D systems (Minneapolis, USA)에서 구입하여 실험하였다. RAW 264.7 세포에 內托千金散 열수 추출물을 1시간 전 처치하고 10㎍/㎖의 LPS를 처리하여 24시간 배양한 후 세포 배양상층액을 수거하여 PGE2 측정에 사용한다. 배양액을 goat anti-mouse로 coating된 96 well plate에 각각의 배양액을 100㎕씩 loading한다. 여기에 primary antibody solution 50㎕와 PGE2 conjugate 50㎕씩 첨가하여 4℃에서 overnight시킨다. 기질용액을 200㎕씩 처리하여 5-20분간 반응시킨 후, 50㎕의 stop solution을 처리하고 450㎚에서 흡광도를 측정한다.
배양한 RAW 264.7 macrophage에 內托千金散 열수 추출물과 10㎍/㎖의 LPS를 처리하여 18시간 동안 배양한 후 세포 배양상층액을 제거하고 PBS 1㎖로 3회 세척하였다. Lysis buffer (25mM Tris-HCl, 1% NP 40, 150mM sodium chloride, 0.25% sodium deoxycholate, 1mM NaF, protease inhibitors) 200㎖를 이용하여 세포를 용해하였다. 용해한 시료는 동결, 해동 과정을 3회 반복하고 1800 rpm으로 20분간 원심분리하여 상층액만 사용하였다. 단백질 농도는 Bradford assay법을 이용하여 정량하였다. 각 시료는 SDS sample buffer를 첨가하여 5분간 열처리하였다. 준비된 시료는 10% SDS polyacrylamide gel을 이용하여 전기영동 한 후 nitrocellulose membrane으로 이동시켰다. Nitrocellulose membrane은 5% BSA로 1시간 동안 block하고, TBST (TBS + 0.1% Tween-20)로 세척 후 항체 COX-2 (Santacruz, USA), iNOS (Santacruz, USA), β-actin (Abcan, USA), ERK (Cell signaling, USA)와 pERK (Cell signaling, USA)를 처리하였다. 항체처리 후 TBST로 3회 세척하였다. Band의 시각화는 Odyssey system (LI-COR, USA)을 사용하여 측정하였다.
Ⅲ. 결 과
內托千金散 열수 추출액의 농도가 세포 내에서 독성을 일으키는지 확인하기 위해 MTT assay를 이용하여 측정하였다. 內托千金散 열수 추출액의 대조군 생존율을 100 ± 8.53%로 계산하였을 때 400㎍/㎖을 제외한 모든 농도에서 세포독성이 없음을 확인하였다(Table 2).
| NTCKS Concentration ㎍/㎖) | Cell Viability (% of control) |
|---|---|
| Control | 100 ± 8.53 |
| 50 | 99.83 ± 8.28 |
| 100 | 97.47 ± 8.79 |
| 150 | 95.59 ± 12.13 |
| 200 | 90.50 ± 12.45 |
| 400 | 81.48 ± 7.89* |
內托千金散 열수 추출액이 마우스 대식세포의 NO 생성에 미치는 영향을 관찰하였다. 內托千金散 처리하지 않은 대조군에서는 NO 생성율이 85.3 ± 6.3㎛로 나타난 반면에, 內托千金散 50, 100, 150 및 200㎍/㎖로 처리한 실험군에서는 NO 생성율이 83.8 ± 3.8, 79.2 ± 4.0, 73.3 ± 6.0, 67.8 ± 5.9㎛로 나타났다. 內托千金散 150 및 200㎍/㎖ 처치군은 LPS 단독처리한 대조군에 비해서 통계학적으로 유의한 감소가 나타났다(Table 3).
| Concentration ㎍/㎖) | NO production (㎛) |
|---|---|
| Control | 85.3 ± 6.3 |
| LPS + 50 | 83.8 ± 3.8 |
| LPS + 100 | 79.2 ± 4.0 |
| LPS + 150 | 73.3 ± 6.0* |
| LPS + 200 | 67.8 ± 5.9* |
內托千金散이 마우스 대식세포의 PGE2 생성에 미치는 영향을 관찰하였다. 內托千金散을 처치하지 않은 대조군의 PGE2 생성은 821.24 ± 1.63pg/well로 나타난 반면 內托千金散을 50, 100, 150 및 200㎍/㎖로 처리한 실험군에서는 각각 827.86 ± 24.78, 830.27 ± 18.24, 767.63 ± 12.53, 746.35 ± 11.05 pg/well로 나타났다. 內托千金散 150 및 200㎍/㎖ 농도로 처리한 군에서 LPS 단독처리한 군에 비하여 통계학적으로 유의한 감소가 나타났다(Table 4).
| Concentration (㎍/㎖) | PGE2 production (pg/well) |
|---|---|
| Control | 821.24 ± 1.63 |
| LPS + 50 | 827.86 ± 24.78 |
| LPS + 100 | 830.27 ± 18.24 |
| LPS + 150 | 767.63 ± 12.53* |
| LPS + 200 | 746.35 ± 11.05* |
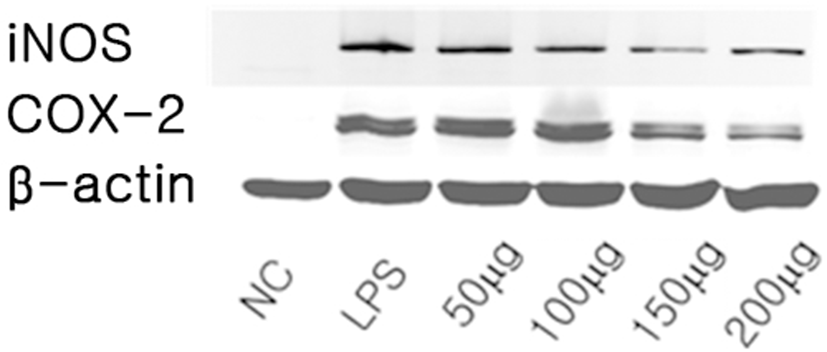
內托千金散이 iNOS 및 COX-2 발현에 미치는 영향을 관찰하였다. LPS 처리에 의하여 증가된 iNOS 및 COX-2의 발현은 內托千金散 처리한 실험군에서 농도 의존적으로 발현이 감소하였다(Fig. 1).
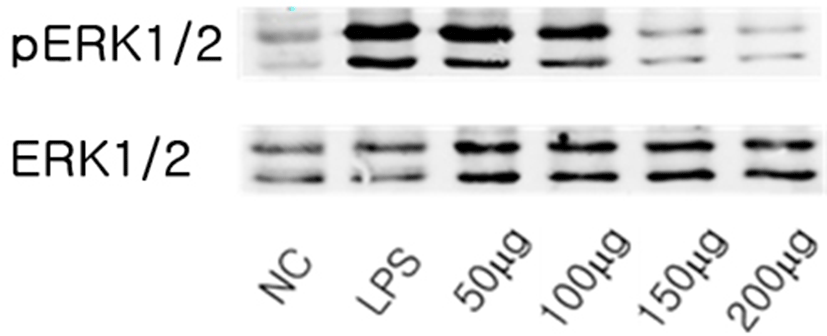
內托千金散이 ERK1/2 인산화 억제에 미치는 영향을 관찰하였다. LPS 처리에 의하여 증가된 ERK1/2의 발현은 內托千金散 처리한 실험군에서 농도 의존적으로 인산화가 억제되었다(Fig. 2).
Ⅳ. 고 찰
염증은 조직 손상에 대한 자가 방어능력 중의 하나이며, 이는 임상적으로 통증, 열감, 발적, 기능저하의 증상을 보이는 것이다17). 염증은 양날의 칼과 같아서 적절한 염증반응은 내재면역 반응을 바탕으로 적응면역 반응을 매개하여 외인적/내인적 인자로부터 생체를 보호하는 필수 불가결한 반응이나, 과도하고 부적절한 염증반응은 세포 및 조직의 괴사 및 패혈증에 의한 사망과 더불어 각종 만성질환의 원인이 된다18).
이와 같은 염증반응은 한의학에서는 <黃帝內徑 素問 刺法論>19)에 “正氣存內 邪不可干”이라 하여 정상적인 장부기능을 바탕으로 하는 正氣와 각종 발병인자를 지칭하는 邪氣와의 싸움인 正邪相爭, 즉 正邪抗爭으로 보아 正氣가 약할 때는 補益을 위주로 하는 扶正法을 사용하고, 邪氣가 강할 때는 淸熱, 解毒 등의 祛邪法을 사용하여 왔다20).
한의학 피부외과치료법 중에는 가볍고 얕은 부위에 발생한 적은 瘡에 사용하는 外治法과 국부와 전체가 같이 重한 瘡에 주로 사용하는 內治法이 있다. 이 內治法의 한 방식으로 實證에 사용하는 透托法과 正氣가 虛할 때 사용하는 補托을 병행하여 扶正達邪12), 즉 扶正祛邪를 하는 것이 內托法이다. 이와 같은 內托法은 正邪抗爭 상황인 염증반응에서 扶正祛邪의 治法으로서 응용하여 볼 수 있다.
內托千金散은 <東醫寶鑑>11)에서 “治一切癰疽惡瘡 能內托”이라 하여 內托法을 따르는 처방으로 염증반응 억제에 유의미성이 있을 것으로 생각되나, 지금까지는 주로 면역조절작용13,14), 항종양효과 기전15), 알레르기성 접촉성피부염16) 등에 대한 연구가 진행되었다. 이에 본 연구에서는 內托千金散의 염증반응에 있어 주요한 역할을 하는 NO, PGE2, iNOS, COX-2, ERK1/2 인산화에 대한 억제 효과를 살펴보았다.
MTT assay는 세포연구에서 광범위하게 사용되며, 이는 생체외 세포증식과 생존능력 분석에 유용성이 있다4). 內托千金散 열수 추출액의 농도가 세포내에서 독성을 일으키는지 확인하기 위해 MTT assay를 이용하여 측정하였다. 內托千金散 열수 추출액은 400㎍/㎖을 제외한 모든 농도에서 90% 이상의 세포생존율을 확인할 수 있었다(Table 2).
NO는 NOS에 의해 L-arginine으로부터 생성되는 자유라디칼이다. 체내에서 소량 생성되는 NO는 혈관확장, 신경전달, 병원체에 대한 세포파괴 등과 같은 정상적인 생리기능을 담당하지만, 대식세포에서 iNOS에 의해 과다 생성된 NO는 염증반응과 관련되어 있으며1), 과다 생성된 NO의 파생물인 peroxy- nitrite와 nitrogen dioxide 또한 염증반응에 주요한 역할을 한다21). 內托千金散 열수 추출액이 마우스 대식세포의 NO 생성에 미치는 영향을 관찰하기 위하여 LPS만 처리한 대조군과 內托千金散을 농도별로 처리한 실험군을 비교한 결과, 內托千金散 150 및 200㎍/㎖ 농도로 처리한 실험군에서 대조군에 비해 NO 생성이 통계적으로 유의하게 감소하였다(Table 3).
Prostaglandin은 탄소수 20개의 불포화 지방산 조직인 eicosanoid의 한 종류로 탄소수 20개의 불포화 지방산인 arachidonic acid로부터 생합성 된다22). 이는 그 구조상의 불포화성 또는 측쇄에 따라 prostaglandin E, F, A, B 등의 여러 유도체들이 알려져 있다23). 이 중 COX-2에 의해 생성되는 PGE2는 NO와 마찬가지로 손상된 부위나 조직에서 통증과 발열의 전달에 주로 관여하는 중요한 염증매개물질이다5). 內托千金散 열수 추출액이 마우스 대식세포의 PGE2 생성에 미치는 영향을 관찰하기 위하여 LPS만 처리한 대조군과 內托千金散을 농도별로 처리한 실험군을 비교한 결과, 內托千金散 150 및 200㎍/㎖ 농도로 처리한 실험군에서 대조군에 비해 PGE2 생성이 통계적으로 유의하게 감소하였다(Table 4).
NO synthase (NOS)는 endothelial NOS (eNOS), neuronal NOS (nNOS), inducible NOS (iNOS)의 세 가지 주요한 isoform이 있다24). 이중 iNOS는 murine macrophage, 내피세포, 평활근세포 및 심근 세포 등 많은 세포에서8) interferon-γ (IFN-γ), interleukin-1β (IL-1β), tumour necrosis factor-α (TNF-α), LPS로 자극될 때 발현되며25), Ca2+ 비의존성 경로를 통해서 장시간에 걸쳐 증가하여 다량의 NO를 형성한다8). Arachidonic acid를 prostaglandin으로 변화시키는 효소에는 세포 구성요소로서의 COX-1과 유도성인 COX-2가 있다23). COX-1은 대부분의 조직에 있는 관리단백질로 일반적인 생리 기능을 가진 PGs들을 생산하며, 이에 비해 COX-2는 염증매개체인 PGE2를 생산하며 염증반응을 매개 한다26). 內托千金散 열수 추출액이 iNOS 및 COX-2 발현에 미치는 영향을 관찰하기 위하여 LPS 처리에 의하여 증가된 iNOS 및 COX-2의 발현이 內托千金散 처리한 실험군에서 농도별로 어떠한 양상인지 관찰한 결과 iNOS 및 COX-2의 발현은 內托千金散 농도 의존적으로 감소하였다(Fig. 1).
ERK는 JNK, serine/threonine protein kinase 인 p38 MAPK와 함께 MAPK superfamily를 형성한다6). MAPK는 인산화를 통하여 nuclear factor-κB(NF-κB), activator protein-1(AP-1), activating transcription factor-2, cAMP-responsive element binding protein을 포함한 다양한 전사인자들을 활성화시키는 핵심 신호전달 분자로 보고되고 있다27,28). 또한 대식세포를 매개한 염증반응에 있어 NO 생성 효소인 iNOS, prostaglandin 생합성의 속도조절 단계 효소인 COX-2의 유전자의 발현에 있어서도 MAPK는 주요 신호전달 분자의 역할을 하기에7염증 반응에서 중요한 의미를 지닌다. 內托千金散 열수 추출액이 ERK1/2 인산화 억제에 미치는 영향을 관찰하기 위하여 LPS 처리에 의하여 증가된 ERK1/2의 발현이 內托千金散 처리한 실험군에서 농도별로 어떠한 양상인지 관찰한 결과 ERK1/2의 발현은 內托千金散 농도 의존적으로 인산화가 억제되었다(Fig. 2).
이상으로 본 연구에서는 內托千金散이 RAW 264.7 대식세포주에서 LPS 처리에서 생성된 NO, PGE2, iNOS 및 COX-2에 대한 억제효과와 ERK1/2의 인산화 억제효과가 있다는 결과를 얻을 수 있었다.
염증은 그 발생과정에 있어 일반적인 매개체들을 이용한다. 이 매개체들은 서로 발생의 선후가 있기는 하지만, 그 매개체들을 각각 논의하기는 어렵다29). 이런 측면에서 염증반응의 주요한 매개체들에 대해 억제 효과를 보인 內托千金散은 향후 아토피 피부염, 류마티스 관절염, 염증성 장질환30) 등의 각종 염증성 질환에 있어 효과적인 치료 처방으로 활용될 수 있을 것으로 사료된다.
Ⅴ. 결 론
內托千金散이 RAW 264.7 대식세포주에서 세포독성, NO 생성, PGE2생성, iNOS, COX-2 발현, 및 ERK1/2 인산화 억제에 미치는 영향에 대하여 다음과 같은 결과를 얻었다.
1. 內托千金散 추출물은 400㎍/㎖을 제외한 모든 농도에서 세포독성이 없었다.
2. 內托千金散 추출물은 150 및 200㎍/㎖ 농도에서 NO 생성을 통계적으로 유의하게 감소시켰다.
3. 內托千金散 추출물은 150 및 200㎍/㎖ 농도에서 PGE2 생성을 통계적으로 유의하게 감소시켰다.
4. 內托千金散 추출물은 LPS에 의하여 증가된 iNOS 및 COX-2의 발현을 농도 의존적으로 감소시켰다.
5.內托千金散 추출물은 LPS에 의하여 증가된 ERK1/2의 발현을 농도 의존적으로 인산화를 억제시켰다.






