Ⅰ. 서 론
최근 인체의 건강이나 피부미용에 대한 관심이 크게 높아지면서 내적요인뿐 아니라 자외선 등 외적요인에 의한 피부노화 억제 또는 노화 개선을 위한 목적으로 화장품, 식품 및 의약품을 비롯한 다양한 분야에서 항노화 연구가 활발하게 이루어지고 있다1).
피부 노화는 나이가 증가하면서 개인의 유전적인 요인에 의하여 발생하는 내재적인 노화와 자외선이나 외부 물질의 자극 등에 의한 산화적 스트레스에 의하여 발생하는 광노화로 나눌 수 있다2).
광노화 피부는 태양광선 중의 자외선에 의한 만성적인 노출로 피부의 구조와 기능에 부작용을 초래하며, 자외선의 종류와 조사량에 따라 피부에 화상, 면역억제, 암 및 조기노화와 같은 손상을 입히고 있다. 또한 반복적으로 노출되면 지속적인 손상에 의하여 피부암을 초래한다. 광노화 된 피부의 특징적인 증상은 주름형성, 피부늘어짐, 색소침착, 갈색반점 및 피부가 가죽같이 두꺼워진다3).
자외선(Ultraviolet, UV)은 피부를 손상시키는 주요한 환경 요인으로 크게 UVA(315∼400㎚), UVB(280∼315㎚), UVC(< 280㎚)로 나눌 수 있다. 지구 표면에 도달하게 되는 UVA와 UVB 중에서 UVB는 지구에 도달하는 양이 1∼10% 정도로 작은 부분을 나타내지만4), 최근 성층권의 오존층 감소로 인해 지구에 도달하는 양이 증가되고 있다5,6). UVB에 급성으로 노출되면 홍반, 부종, 일광화상, 세포의 이상증식, 염증 및 면역력 저하 등을 포함한 다양한 피부 부작용이 야기되며, 만성적으로 노출되면 피부암 및 피부노화로 이어진다7,8). 또한, 수포, 세포골격 분자 변화, 세포자살(apoptosis)의 증가로 각질형성세포의 생존력을 감소시키므로 UVB는 인체 피부에 유해한 영향을 주는 주요 자극원 중 하나라 할 수 있다9-12).
神授衛生湯은 明代 陳의 「外科正宗」에 “治癰疽․發背․腦疽․對口․丹瘤․癭瘤․惡毒疔瘡․濕痰流注及外科一切瘡症.…”이라고 처음 수록되어 있다13).
癰疽의 原因에 대해 「黃帝內經」에서는 ‘膏粱厚味 營氣不從 五臟不和 九竅不通等’에 의해 발생된다고 하였다. 癰疽의 症狀은 인체 각 부위에 국부적으로는 發熱, 發赤 堅硬 腫痛 患部의 陷沒 突起 化膿 皮膚老化 等의 樣相으로 나타난다14).
최근에는 피부노화의 기전에 대한 연구가 활발히 진행되어 대부분 유기합성된 비타민 유도체가 많이 사용되고 있으며, 이러한 유도체들은 분자 자체가 매우 불안정하여 많은 양이 피부에 유입되면 강한 피부자극을 일으키고 적은 양이라도 사람의 체질에 따라 과민반응을 일으킬 수 있으므로 주름개선과 예방을 위하여 부작용이 적인 기능성 소재를 천연물에서 찾으려고 하고 있다15-17).
본 연구에서는 神授衛生湯이 자외선으로 유발된 피부 조직손상에 유의한 효과가 있는지 조사하기 위하여 세포독성, 광독성 억제, 항염증 및 항산화 효과에 대한 실험을 수행하여 유의한 결과를 얻었기에 보고하는 바이다.
Ⅱ. 재료 및 방법
실험에 사용한 한약재들은 ㈜휴맥스(HMAX, Korea)에서 구입하였다. 神授衛生湯 900g을 분쇄하여 메탄올 5L에 넣고 상온에서 overhead stirrer를 이용하여 3일동안 추출하였다. 이 과정을 3회 반복하여 얻은 추출물을 whatman No.1 여과지에(11㎛)로 여과하고 감압농축기를 이용하여 농축한 뒤 vacuum oven에서 2일간 용매를 완전히 제거하여 神授衛生湯 메탄올 추출물 85.5g (회수율 8.55%)을 얻었다. 이 추출물은 사용하기 전까지 4℃에서 냉장 보관하였다(Table 1).
실험에 사용된 세포는 Hs68 (Human Foreskin fibroblast line, ATCC, CRL-1635)을 분양받아 사용하였다.Hs68 cells은 37℃, 5% CO2 조건에서 10% fetal bovine serum (FBS), penicillin (100U/ml) 및 streptomycin (100㎍/㎖) 등이 포함된 DMEM 배지로 배양되었다. 배양세포들은 75㎠ flask (Falcon, USA)에서 충분히 증식된 후 배양 3일 간격으로 배양 세포 표면을 PBS 용액으로 씻어준 뒤 50㎖ flask 당 1㎖의 0.25% trypsin-EDTA 용액을 넣고 실온에서 1분간 처리한 다음 trypsin을 버리고 37℃에서 5분간 보관하여 세포를 탈착하여 계대 배양하였다. 탈착된 세포는 10% FBS가 첨가된 DMEM 배양액 10㎖에 부유시킨 다음 새로운 배양용기 (50㎖ culture flask)에 옮겨 1:2 split ratio로 CO2 배양기에서 배양하였다.
세포독성 유발 효과를 알아보기 위하여 3-(4,5-dimr- thylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) assay 방법을 사용하여 측정하였다. 96 well plate에 1 x 105 cells/well의 cell을 100㎖씩 넣고 37℃, 5% CO2가 공급되는 배양기에서 24시간동안 배양한 후 배지를 버리고 배양세포 표면을 1x PBS 용액으로 씻어주었다. 같은 양의 배지와 PBS에 녹인 시료를 농도별로 각 well에 처리하고 24시간 배양하였다. 배양이 끝난 후 PBS에 녹인 1㎍/㎖ MTT (Sigma, USA)를 100㎕씩 각 well에 처리하여 알루미늄 호일로 차광시킨 뒤 2시간동안 같은 조건에서 배양하였다. 배양액을 모두 제거한 후 DMSO를 100㎕ 처리하고 37℃에서 2시간 방치한 다음 microplate reader를 이용하여 490㎚에서 흡광도를 측정하였다. 세포생존율은 다음과 같은 공식으로 계산되었다.
Viability(%) = 100 x AT/AC
AT : absorbance of tested extract solution
AC : absorbance of control
Ultraviolet B(UVB) 램프 (312㎚ : Viber Lourmat, France)를 광원으로 사용하였다. 6 well plate에 Hs68 세포주를 1 x 105 cells/well의 조건으로 배양하였으며 24시간 뒤 16시간동안 serum starvation 시켰다. 1㎖의 phosphate buffered saline(PBS)으로 2번 washing 한 뒤 1㎖의 PBS에서 80mJ/cm2의 강도로 UVB를 조사하였다. 조사 뒤 즉
시 배지를 갈아주고 24시간동안 각각의 神授衛生湯 추출물의 농도 6.25, 12.5, 25, 50 및 100㎍/㎖에서 배양하였다. 대조군은 神授衛生湯 추출물 처치 없이 같은 방법으로 PBS washing과 배지 교환을 해주었다. 24시간 뒤 MTT 용액을 200㎕ 첨가하고 4시간 동안 배양하였다. 배지를 제거하고 1㎖의 DMSO를 넣고 이를 ELISA reader를 이용하여 wave length 570㎚에서 흡광도를 측정하였다.
NO의 농도는 배양액 내의 nitrite 농도를 Griess reagent system을 이용하여 측정하였다. 세포에 다양한 농도의 神授衛生湯을 전처리 하고 1시간 후 100ng/㎖의 LPS를 처리하여 18시간 배양하였다. 배양액 일정량과 같은 양의 Griess Reagent 혼합하여 10분간 상온에서 반응 시킨 후 ELISA reader로 540nm에서 흡광도를 측정하였다. Sodium nitrite의 농도별 표준곡선을 이용하여 배양액 내의 NO 농도를 결정하였다.
항산화 활성을 측정하기 위하여 2,2-diphenyl-1- picrylhydrazyl (DPPH; Sigma Aldrich, USA) free radical 소거능을 측정하였다. 96 well plate에 神授衛生湯을 각각 5, 10, 50 및 100㎍/㎖ 농도로 80㎕씩 준비시키고 0.15mM DPPH/MeOH를 80㎕에 첨가한 뒤 실온에서 10분간 반응시켰다. 이를 ELISA reader를 이용하여 wave length 520㎚에서 흡광도를 측정하였다.
Apoptosis가 진행되는 세포를 관찰하기 위하여 Hoechst 33258 (Invitrogen, USA) 염색을 실시하였다. 상기 UVB 광조사 실험과 같은 방법으로 Hs68 세포를 6 well plate에서 80mJ/cm2의 강도로 UVB를 조사시킨 후, 즉시 배지를 갈아 주고 배양시켰다. 4시간뒤 배지를 제거하고 4%의 paraformaldehyde (PFA; Sigma Aldrich, USA)/PBS on ice에서 1시간 동안 고정시켰다. 고정 뒤 1㎖ PBS에서 3번 washing 해주고 1㎖ PBS에서 Hoechst 33258을 0.2㎍/㎖의 농도로 10분간 배양하여 형광현미경 EVOS flurescent microscopy (Advanced Microscopy Group, USA)에서 UVB 조사하지 않은 정상군 및 50㎍/㎖ 神授衛生湯 추출물을 처치한 실험군과 비교 관찰하였다.
Human fibroblast 유래의 Hs68 (ATCC; CRL-1635) 세포를 1.5 x 105 cells/well으로 6-well plate에 분주하고 세포가 바닥 면에 부착되도록 24시간 배양하였다.
세포가 바닥 면에 부착한 후에 배양액을 제거하고 PBS로 2회 세척한 후 PBS에서 UVB (80 mJ/cm2; 312nm)조사를 하였다. 세포독성시험 결과를 토대로 세포 생존율이 100%인 농도부터 2~16배 희석한 배지를 처리하고 48시간 동안 배양하였다. 48시간 뒤, 배양액과 세포를 회수하고 세포 lysate로 단백질을 정량 한 뒤 ELISA kit (Amersham; Cat. RPN2610) 사용하여 배양액에 함유된 MMP-1양을 측정하였다.
Ⅲ. 결 과
神授衛生湯 추출물의 농도별 세포독성을 조사하기 위해 Hs68 세포에 神授衛生湯 추출물을 농도별로 처치하여 MTT assay를 수행하였다.
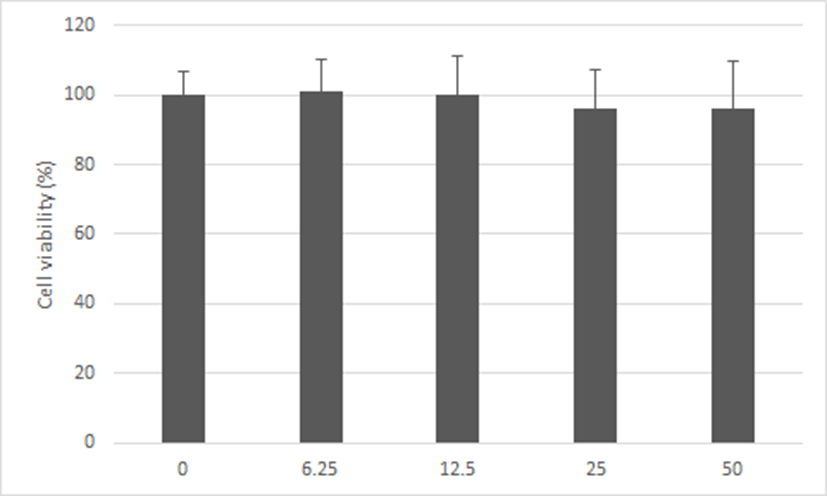
神授衛生湯 추출물 처치된 Hs68 세포의 세포생존율은 대조군의 세포생존율 100%를 기준으로 각각 6.25, 12.5, 25 및 50㎍/㎖로 처치한 실험군에서 101.20 ± 8.90, 100.01 ± 11.31, 96.16 ± 11.02 및 95.86 ± 13.59%로 나타나 모든 농도에서 세포독성이 없음을 확인하였다(Fig. 1).
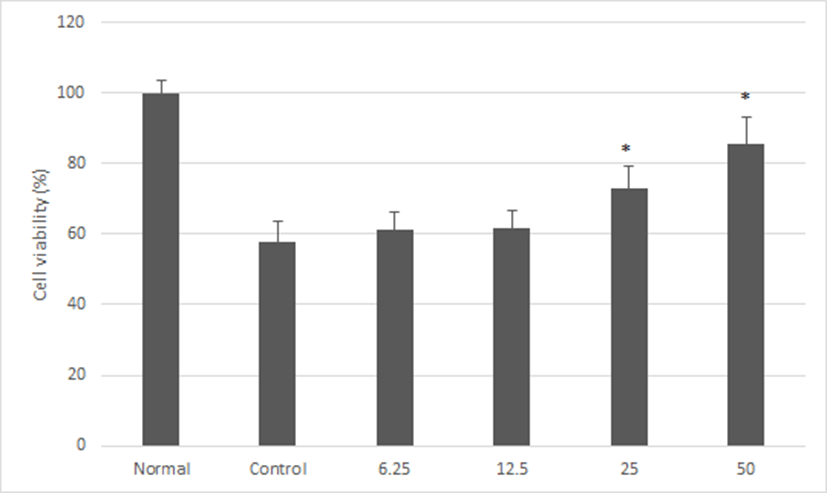
자외선에 노출된 Hs68 세포에 농도별 神授衛生湯 추출물이 미치는 영향을 실험하기 위해 UVB 광조사 후 MTT assay를 수행하였다.
神授衛生湯 추출물 처치를 하지 않고 광원에 노출된 대조군의 세포생존율은 57.71 ± 5.91 %로 나타났으며 각 6.25, 12.5, 25 및 50㎍/㎖ 농도로 神授衛生湯 추출물 처치를 받은 실험군에서 세포생존율은 각각 61.38 ± 4.99, 61.82 ± 4.77, 72.96 ± 6.07 및 85.64 ± 7.44 %로 나타나 25 및 50㎍/㎖ 실험군에서 대조군에 비해 통계적으로 유의하게 높은 세포생존율을 보였다(Fig. 2).
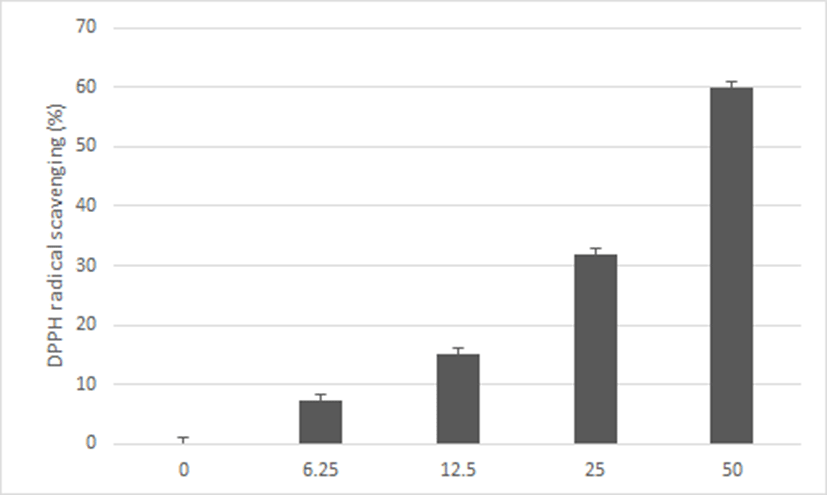
神授衛生湯 추출물의 농도별 항산화 효과를 측정하기 위해 DPPH assay를 통하여 라디컬 소거능 평가를 실시하였다. 6.25, 12.5, 25 및 50㎍/㎖의 神授衛生湯 추출물 실험군에서 DPPH radical 소거능은 각각 7.27 ± 3.26, 15.23 ± 3.54, 31.81 ± 6.86 및 59.91 ± 2.73%로 나타나 농도의존적으로 높은 효과가 있음을 관찰하였다(Fig. 3).
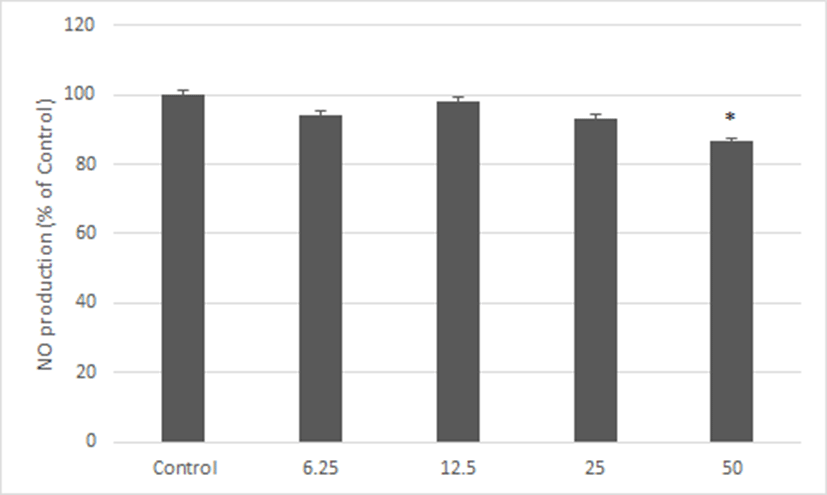
神授衛生湯 추출액이 NO 생성에 미치는 영향을 관찰하였다. 神授衛生湯을 처리하지 않은 대조군의 NO 생성율을 100%로 환산하였을 때, 神授衛生湯을 6.25, 12.5, 25 및 50㎍/㎖로 처리한 실험군에서는 NO 생성율이 94.19 ± 5.69, 98.17 ± 5.72, 93.24 ± 6.47 및 86.60 ± 6.02%로 나타났다. 神授衛生湯 50㎍/㎖ 처치군은 LPS 단독처리한 대조군에 비해서 통계학적으로 유의한 감소가 나타났다(Fig. 4).
Apoptosis가 진행되는 세포를 관찰하기 위하여 Hs68 세포에 Hoechst 33258염색을 실시하여 형광현미경으로 관찰하였다. UVB를 조사하지 않은 정상군에 비해 神授衛生湯 추출물 처치없이 UVB를 조사받은 대조군에서 DNA의 단편화와 핵의 응축으로 인해 Hoechst 염색이 밝게 보이는 세포들이 유의하게 증가된 것이 관찰되었다. 이러한 결과는 Hs68세포가 UVB조사에 의하여 apoptosis가 증가하였음을 의미한다. 반면에 神授衛生湯 추출물은 UVB에 의하여 증가된 apoptosis와 관련된 핵의 응축이 관찰되는 세포가 줄어들었음을 확인하였다(Fig. 5).

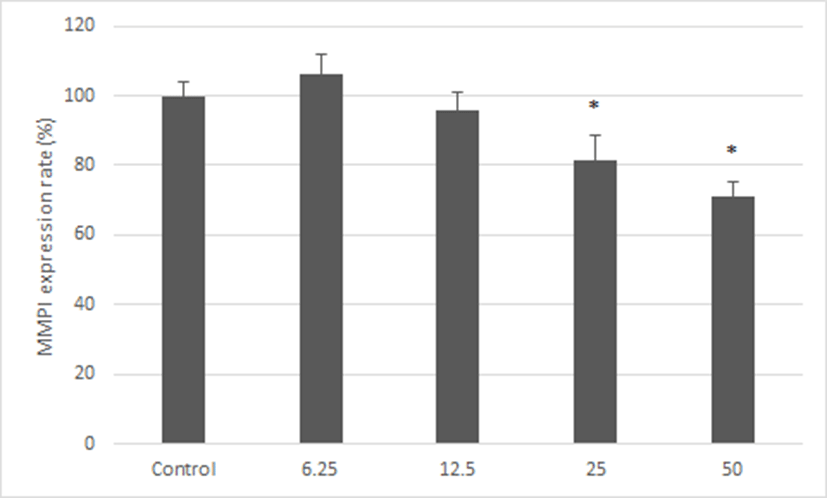
神授衛生湯이 collagenase type I 억제 활성을 측정하기 위하여 Hs68 세포주에 UVB를 조사한 후 복합물을 농도별로 처리하였다. 神授衛生湯을 처리하지 않은 대조군의 MMP-1 생성율을 100%로 환산하였을 때, 神授衛生湯을 6.25, 12.5, 25 및 50㎍/㎖로 처리한 실험군에서는 MMP-1 생성율이 106.11 ± 5.99, 95.75 ± 5.31, 81.65 ± 6.76 및 71.15 ± 4.26%로 나타났다. 따라서 MMP-1 생성이 25와 50㎍/㎖에서 감소하는 것을 확인하였다(Fig. 6).
Ⅳ. 고 찰
최근 생활수준의 향상과 평균수명의 증가로 미용과 노화방지에 대한 관심이 늘어나고 있는 반면 인간의 피부는 시간이 지남에 따라 호르몬들의 분비가 감소하고 면역세포의 기능과 활성이 저하되며 생체 단백질들의 생합성이 줄어들게 되어 발하는 각종 오염물질과 자외선에 의한 광노화에 의해 피부가 얇아지며 탄력이 감소하게 된다18,19). 이에 보다 오래 젊음을 유지하고자 하는 욕구들로 인하여 피부미용과 노화방지에 대한 의학적 수요가 늘어나고 있다. 또한 기존의 합성원료보다 천연식물자원을 선호하는 웰빙 현상으로 한약제제를 이용한 노화방지, 피부미용치료에 대한 관심과 수요가 증가하고 있는 실정이다20).
피부 노화는 피부의 구조와 생리적 기능이 나이를 먹으면서 쇠퇴하는 내인적 노화(intrinsic aging)와 태양광선 등 누적된 외부 스트레스와 함께 진행되는 외인적 노화(extrinsic aging) 두 종류로 나눌 수 있다21). 그 중에서도 태양광선은 잘 알려진 노화 원인들 중의 하나로 UVA, UVB가 일으키는 피부 노화를 광노화(photoaging)라고도 부른다22). 자외선에 의한 피부손상은 일광화상에서부터 광노화와 발암 현상에 이르기까지 노출의 정도와 기간, 피부의 상태에 따라 다양한 과정으로 나타나며23), 이로 인한 피부는 깊고 굵은 주름, 피부 처짐, 혈관확장, 탄력 감소, 수포 생성 및 자외선이 노출된 부위에 불규칙한 색소 침착이 발생한다24).
피부는 인체의 외부를 덮고 있는 조직으로 외계의 물리적, 화학적 변화를 완충시켜 인체 내부 환경을 유지하는 인체의 일차 방어기능을 담당하고 있다. 표피의 80%를 이루는 각질층은 표피의 수분증발과 손실을 억제하고 세균 및 미생물 바이러스 등이 피부로 침범하는 것을 막는 장벽역할을 한다. 자외선으로 자극된 각질세포는 활성산소를 생성하여 피부세포의 apoptosis를 촉진하며 면역기능을 억제시키고 염증을 유발하여 탄력감소, 주름, 기미 등의 발생과 피부노화를 촉진시킨다25,26). 피부 부피의 대부분을 차지하는 진피의 결체조직은 collagen, elastin, dermal matrix 등으로 구성되어 지는데 이들은 모두 fibroblast에 의해 만들어 지며 fibrolast가 자외선에 노출되게 되면 과도한 활성산소의 생성으로 피부에 산화적 스트레스를 초래하고 세포사멸을 증가시킨다27).
최근 피부미용과 노화방지에 대한 대중의 관심이 증가함에 따라 한의학계에서도 한약재의 항산화 효과와 광독성 억제활성에 대한 연구들이 이루어져 여러 가지 한약제재 및 단미재들이 UVB로부터의 광독성, 광노화 억제효과가 있다고 보고되었다28-31).
神授衛生湯은 一切瘡症이 已成潰한 이후에 사용되는 방제로, 羌活, 防風, 白芷, 穿山甲, 紅花, 連翹, 石決明, 金銀花, 皁角子, 當歸, 甘草, 天花粉, 乳香, 大黃으로 구성되어 있으며, 明代 陳은 外科正宗」에서 本方의 主治와 治療機轉에 대하여 자세하게 논하고 있다. 특히 陳은 本方이 去邪하는 약물을 위주로 구성되어 있으나 藥性이 緩和하여 癰疽나 피부의 초기 염증증상에 사용할 수 있다고 하였다13).
본 연구에서는 神授衛生湯이 자외선으로 유발된 피부손상을 억제, 치유하는데 도움을 줄 수 있는 지를 관찰하였다. 神授衛生湯의 세포독성을 관찰하고 UVB에 의하여 손상된 세포독성에 보호효과가 있는지를 관찰하였다. 또한 apoptosis에 대한 억제효과를 관찰하기 위하여 Hoechst 염색을 실시하였고, 항산화 효능을 알아보기 위하여 DPPH free radical 소거능을 관찰하였다. 또한 세포염증반응에 미치는 영향을 알아보기 위하여 NO 생성 억제능을 관찰하였으며, 주름억제 활성이 있는 지를 알아보기 위하여 MMP-1 생성억제 활성 시험도 시행하였다.
神授衛生湯의 농도별 세포독성을 조사하여 위하여 실험한 결과 6.25, 12.5, 25 및 50㎍/㎖에서 모두 90% 이상의 세포생존율을 나타내어 세포독성이 없는 것으로 확인되었다. 또한 UVB에 인한 광독성에 미치는 영향을 조사하기 위하여 실험한 결과 UVB에 인한 광독성은 정상세포에 비하여 세포생존율이 57%로 감소한 반면, 神授衛生湯 추출물 25 및 50㎍/㎖ 농도에서는 세포생존율이 통계학적으로 유의하게 증가하는 것으로 나타났다. 이러한 결과는 神授衛生湯이 정상세포에서는 세포독성이 나타나지 않을 뿐만 아니라 UVB에 의하여 손상된 세포독성에 보호효과가 있음을 알 수 있다.
염증의 발현 기전에는 다양한 매개체가 관여하고 있으며, 그 병의 원인도 다양하다. 대식세포 endotoxin으로 알려져 있는 LPS (lipopolysacharide)를 처리하면, iNOS (inducible NOS)발현에 의해 NO 생합성이 증가하며 염증 반응이 유도된다. NO는 많은 세포들이 분비하는 병리적인 2차 신호전달 물질이며, COX의 활성을 조절하고 염증반응에 상승적으로 작용한다. NO는 여러 조직에서 NOS에 의해 L-arginine으로부터 합성되는 free radical gas로 큰포식세포 의존적인 세포독성 활성과 혈관평활근 이완작용, 혈소판응집 억제작용, 중추신경에서 신경전달물질로서의 역할 등 생물학적으로 다양한 기능을 수행한다32). UVB에 의한 NO의 멜라닌 생성 촉진에 관한 연구로는 Romero-Graillet et al.(1997)이 UVB가 사람의 멜라닌세포에서 멜라닌 생성을 촉진하고, 한편 각질화세포(keratinocyte)를 자극하여 NO를 다량 생성한 뒤 간접적으로 멜라닌 생성을 촉진한다고 하였다33). Weller et al.(2002)은 UVB가 각질화세포에서 nitric oxide (NO) 합성 효소인 nitric oxide synthase (NOS) 활성을 증가시킨다고 하였다34).
본 연구에서는 神授衛生湯이 NO 생성에 미치는 영향을 관찰하였다. 神授衛生湯 50㎍/㎖ 처치군은 LPS 단독 처리한 대조군에 비해서 통계학적으로 유의한 감소가 나타났다.
또한 apoptosis가 진행되는 세포를 관찰하기 위하여 Hs68 세포에 Hoechst 33258염색을 실시하여 형광현미경으로 관찰하였다. UVB를 조사하지 않은 정상군에 비해 神授衛生湯 추출물 처치없이 UVB를 조사받은 대조군에서 DNA의 단편화와 핵의 응축으로 인해 Hoechst 염색이 밝게 보이는 세포들이 유의하게 증가된 것이 관찰되었다. 이러한 결과는 Hs68세포가 UVB조사에 의하여 apoptosis가 증가하였음을 의미한다. 반변에 神授衛生湯 추출물 실험군에서는 UVB에 의하여 증가된 apoptosis와 관련된 핵의 응축이 관찰되는 세포가 줄어들었음을 확인하였다.
神授衛生湯의 항산화 활성을 DPPH 라디칼 소거능에 의하여 관찰하였다. DPPH 라디칼은 짙은 자색을 띠는 비교적 안정한 라디칼로서 항산화 성분에 의해 환원되면 짙은 자색이 탈색되어 지는데, 특히 토코페롤, 아스코리빈산 및 방향족 아민류 등에 의해 환원력이 큰 것으로 알려졌다. DPPH 시약에 대해 神授衛生湯을 농도별로 처리하였을 때 神授衛生湯의 농도가 증가함에 따라 자유라디칼을 소거하는 활성도가 증가함을 관찰하였다. 또한 농도의존적으로 더욱 높은 활성을 보여 神授衛生湯에는 항산화 활성을 갖는 유용한 성분들이 함유되어 있음을 확인할 수 있었다. 이러한 神授衛生湯의 항산화 활성은 세포 내에서 염증발현시 증가되는 산화적 스트레스에 대해 효과적으로 방어할 것으로 사려된다.
MMPs는 활성 중심부에 아연을 갖는 금속 단백질 분해 효소로서 현재까지 약 20여종 이상의 종류가 있는 것으로 알려져 있으며, 구조와 기능에 따라 interstitial, collagenase, gelatinase, stromelysin, membarane type MMP등으로 구분하기도 한다35). MMP-1은 collagenase 1으로 알려져 있으며, type Ⅰ과 Ⅲ collagen을 기질로 하며, stromelysin Ⅰ라고도 불리는 MMP-3은 기저막의 type Ⅳ collagen을 분해하며 zymogen인 pro MMP-1을 활성화 시키는데 이러한 MMPs의 발현증가는 자외선에 의해 유도된다36). 본 연구에서는 MMPs family중 MMP-1의 단백질 발현을 보기 위하여 MMP-1의 단백질 발현을 神授衛生湯 추출물에서 MMP-1 단백질 발현이 농도 의존적으로 억제 되는 것을 확인하였다. 따라서 神授衛生湯은 주름생성 억제 활성을 보이는 것으로 판단된다.
상기의 실험결과 神授衛生湯은 UVB에 의한 광독성으로부터 Hs68 세포를 보호하는 효과가 있으며 세포의 apoptosis에 관여되는 것으로 추정된다. 또한 DPPH radical assay에 의하여 항산화 효능이 있는 것으로 관찰되었다. 그리고 神授衛生湯은 주름생성 억제 활성을 보이는 것으로 판단된다. 이러한 결과는 神授衛生湯이 자외선으로 인한 피부노화에 도움을 줄 수 있을 것으로 판단된다.
Ⅴ. 결 론
본 연구에서는 자외선 자극으로 인한 피부손상의 치료를 위한 한약제제를 개발하기 위해 사람의 foreskin에서 유래한 Hs68 세포에서 神授衛生湯 추출물을 농도별로 처치하여 세포독성, UVB 억제 효과, 세포사멸 보호효과, 주름생성 억제효과 및 항산화 효능 등을 관찰한 결과 다음과 같은 결론을 얻었다.
1. 神授衛生湯은 6.25, 12.5, 25 및 50㎍/㎖에서 Hs68 세포에 독성을 나타내지 않았다.
2. 神授衛生湯은 25 및 50㎍/㎖에서 UVB에 의하여 손상된 Hs68 세포의 생존율을 유의하게 증가시켰다.
3. 神授衛生湯은 25 및 50㎍/㎖에서 LPS에 의하여 유발된 NO 생성을 유의하게 감소시켰다.
4. 神授衛生湯은 Hoechst 염색에 의하여 UVB에 의하여 손상된 Hs68 세포의 DNA fragmentation을 억제하는 효과가 있음을 확인하였다.
5. 神授衛生湯은 농도의존적으로 높은 경향의 DPPH radical 소거능이 있음을 확인하였다.
6. 神授衛生湯은 MMP-1 단백질 발현에 억제효능이 있어 주름생성 억제에 도움을 줄 수 있는 것으로 확인하였다.
상기 결과로 神授衛生湯은 세포독성을 유발하지 않으며, 광독성으로부터 세포를 보호하는 효과가 관찰되어 향후 지속적 연구를 통해 자외선으로 인한 피부손상 및 광노화병변을 치료하는데 도움을 줄 수 있을 것으로 사려된다.






